Review AAM
description
Transcript of Review AAM

REVIEW
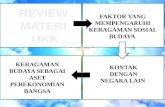
PT. Anugrah Argon Medica (AAM) merupakan perusahaan distribusi produk
farmasi dan alat kesehatan nasional yang tergabung di dalam Dexa Group. Pada awalnya,
AAM merupakan leading company yang hanya mendistribusikan produk-produk Dexa, akan
tetapi beberapa tahun belakang ini, AAM berubah menjadi perusahaan yang mendistribusikan
produk farmasi (obat-obatan, vaksin, susu, dll) dari berbagai macam perusahan farmasi.
PT AAM telah mengimplementasikan standar ISO dan Good Distribution Practices
(GDP) versi WHO sebagai upaya mewujudkan Total Drug Quality Management. Penerapan
GDP diharapkan agar dapat memastikan agar pasien mendapat obat dengan kualitas dan
khasiat yang sama, saat lolos uji dari QA pabrik; meningkatkan kompetensi dan layanan PBF
dalam pendistribusian produk farmasi; memenuhi standar pendistribusian obat yang baik
sesuai persyaratan, dan memenuhi persyaratan pendistribusian produk farmasi yang
ditetapkan oleh principalProses manjemen distribusi secara umum adalah sebagai berikut:
Supply chain : Supplier (pengadaan Raw Material) → Manufacturing (standar GMP)
→ Distribution (Standar GDP) → Retail/cabang (standar GSP) → coustemer
Proses manjemen distribusi di AAM adalah
coustemer → pemesanan barang dari Apotek atau RS → distributor cabang → National
distribution center (AAM) → Industri → coustemer
Proses dari ujung ke ujung harus ada pemantauan kualitas berdasarkan GDP dan yang
bertanggung jawab dalam hal kualitas produk yaitu Apoteker Penanggung Jawab.
Aturan yang mengatur tanggung jawab apoteker di distribusi, yaitu Depkes
1148/MENKES/PER/VII/2011 tentang Apoteker Penanggung Jawab bertanggung jawab
terhadap pelaksanaan penetuan mulai dari pengadaan, penyimpanan, dan penyaluran obat
atau/dan bahan obat. CDOB, yaitu Annex I tentang bahan obat, Annex II tentang Produk
rantai dingin, dan Annex III narkotika dan psikotropika. GDP WHO Technical Report Series,
Annex : GDP for pharmaceutical products. Berdasarkan aturan tersebut, Apoteker
Penanggung Jawab dalam pendistribusian memiliki tugas dan wewenang dalam memastikan
penerapan manajemen mutu, menjaga akurasi dan mutu dokumentasi, menyusun atau
menyetujui program pelatihan CDOB, koordinator recall, memastikan keluhan pelanggan
dengan efektif, melakukan kualifikasi dan persetujuan terhadap pemasok dan pelanggan,
meluluskan obat pembelian yang memenuhi syarat jual, turut serta dalam pembuatan
perjanjian dengan pihak transportasi atau distribusi lain, inspeksi diri dilakukan secara
Nama : Inggrid Roswita TokanNIM : 148115186

berkala, mendelegasikan tugasnya kepada apoteker lain ketika sedang berhalangan atau sakit,
dan turut serta dalam pengambilan keputusan dalam karantina dan pemusnahan obat.
Inspeksi diri tujuannya adalah untuk memmantau pelaksanaan dan kepatuhan
terhadap CDOB dan bahan tindak lanjut atau langka-langkah perbaikan. Inspeksi diri
merupakan self monitoring. Dalam CDOB inspeksi diri dilakukan sekurang-kurangnya 1
tahun dua kali. Di AAM inspeksi diri dilakukan 1 bulan sekali. Inspeksi diri dilakukan secara
independen dan rinci dan oleh orang yang berkompeten dalam hal CDOB. Apabila ada
penyimpanagan harus di CAPA dan pelaksanaannya harus di dokumenatasi. Bagi PBF yang
sudah memenuhi aturan CDOB, maka BPOM akan memberikan sertifikat CDOB, yaitu
sertifikat CCP dan non CCP.
Tenaga kerja: harus memenuhi kualifikasi, kompetensi, dan memahami prinsip CDOB dan ada kode etik untuk mengatasi adanya personil yang melakukan penyalahgunaan obat. Tenaga kerja harus dijamin keselatan kerjanya dengan menggunakan alat pelindung diri.Bangunan dan peralatan: Restricted Area, terdapat segregasi produk reservable dan non reservable; terdapat area terpisah untuk penerimaan, penyimpanan, dan pengiriman; produk tidak boleh menyentuh lantai secara langsung; layout gudang memungkinkan untuk dibersihkan; integrated Post Management; area penyimpanan melindungi produk dari cuaca; penerangan yang memadai; fasilitas distribusi dikualifikasi dan divalidasiOperasional: terdiri dari kualifikasi pemasok (pemasok resmi → Mengimplementasikan CPOB atau CDOB → Reputasi Baik) dan kualifikasi pelanggan (penyaluran ke pihak resmi → review berkala database pelanggan → transaksi dalam batas kewajaran)Penerimaan: Memastikan kiriman obat yang diterima benar berasal dari pemasok yang disetujui dan tidak mengalami kerusakanPenyimpanan Penyimpanan harus sesuai regulasi yang ada terutama pada produk narkotika dan psikotropika, obat yang suhunya diatur. Harus ada segregasi secara fisik dan sistem. Penegeluaran obat secara FEFO dan dilakukan stock opnam untuk memastikan tidak adanya selisih batch number dan jumlah obat.Pemusnahan: dilakukan untuk obat-obat yang tidak memenuhi syarat penyimpanan terpisah dan pemusnahan harus sesuai regulasi dan adanya pelaporan ke BPOM. Keluhan: harus dibedakan antara keluhan produk obat dan pelayanan, serta dikelompokkan dan dilakukan trend analisis untuk melihat berapa banyak keluhan dalam 1 bulan. Keluhan obat yang diduga palsu, yaitu harus ada protap, obat harus dilaporkan ke instansi dan industri farmasi, penghentian distribusi, disimpan terpisah. Obat kembalian: harus di identifikasi dan menjamin bukan obat palsu, pengembalian obat harus sesuai dengan aturan yang dikeluarkan pabrikan (industri farmasi), dan obat disimpan terpisah. Transportasi: Pengemudi mendapat pelatihan CPOB, kendaraan dilengkapi peralatan yang memadai, kendaraan diservis secara berkala.