Master Translate Grosfeld Chapter 3
description
Transcript of Master Translate Grosfeld Chapter 3
BAB 3Pengaruh Rekayasa Jaringan Terhadap Ilmu Bedah AnakTracy C. Grikscheit dan Joseph P. Vacanti
Pembedahan ekstirpatif sering memerlukan rekonstruksi untuk mengganti fungsi dan tampilam jaringan yang dieksisi. Pada kasus defek kongenital, defisit jaringan mungkin sudah ada. Tujuan rekayasa jaringan dan pembuatan organ adalah untuk membuat organ dan jaringan hidup, dengan keunggulan penggantian yang tepat dan ketahanan yang lebih baik terkait dengan proliferasi selular dan perbaikan autolog. Tehnik ini merupakan awal untuk membuat penggantian dari laboratorium ke ruang operasi, memberikan ketepatan dan fungsi yang lebih baik pada pasien dengan kelainan kongenital ataupun pasien yang direseksi.Pada mulanya ahli bedah mencoba untuk menggantikan fungsi atau kosmetik seperti yang dijelaskan dalam Sushruta Samhita sekitar tahun 6 sebelum Masehi, menjelaskan rhinoplasty menggunakan flap dahi, dan bermacam prostesis berbahan kayu dan besi seperti dijelaskan dalam kitab Talmud. Kemajuan modern telah mencakup kedua pendekatan ini, mengembangkan beragam prosedur yang mengandalkan penggantian jaringan seperti pada transfer ibu jari untuk menggantikan jari, ataupun penggunaan bahan pengganti yang dibentuk seperti graft aorta Dacron. Batasan penggunaan bahan pengganti ini terdapat pada dilema memprioritaskan nilai bermacam jaringan dan penggantian yang harus dilakukan. Dalam ilmu bedah anak, ada keterbatasan jaringan donor yang pada dasarnya berbeda dari jaringan yang digantikan. Bahan pengganti yang dibuat juga terdapat masalah : kerusakan bahan, resiko infeksi yang meningkat, dan kerusakan sistem imun terhadap benda asing. Berikutnya, bahan yang tidak hidup tidak tumbuh bersama pasien atau beradaptasi terhadap lingkungan yang berubah, jadi pasien anak-anak mungkin perlu dilakukan operasi bertahap dengan kompleksitas yang juga meningkat. Tidak ada pendekatan yang dapat mengatasi penggantian jaringan campuran.Transplantasi organ, versi modern dari penggantian jaringan, telah menunjukkan bahwa penggantian fungsional dapat menyelamatkan nyawa, tapi ada hambatan, termasuk suplai terbatas dan banyaknya kecacatan yang mungkin timbul sebagai akibatnya.Ketahanan terapi bedah merupakan perhatian khusus dalam ilmu bedah anak, dimana hasil pembedahan dapat dinilai selama puluhan tahun dan rekonstruksi bedah mengalami peningkatan leel aktifitas dan perubahan fisiologis. Kemudian, pada beberapa kelainan kongenital, jumlah donor yang tersedia mungkin tidak cukup, dan bahan prostetik mungkin tidak cukup tepat menggantikan fungsi dan kosmetik jaringan yang hilang, termasuk pertumbuhan.Solusi masalah pada penatalaksanaan bedah anak dengan Short Bowel Syndrome, defek kraniofasial, dan defek jantung kongenital akan segera ditemukan. Penerapan jaringan kulit dan tulang rawan bentukan pada manusia telah dilakukan. Kita berharap pada kemajuan penting dalam penggantian vaskular dan usus dan berlanjut ke organ padat, yang telah terbukti merupakan sistem paling rumit untuk direplikasi.
TEKNIK DAN PRINSIP REKAYASA JARINGANPembiakan sel monolayer merupakan ilmu yang terdefinisi dengan baik, tetapi mengatur kombinasi sel menjadi struktur tiga dimensi kompleks tergantung pada banyak faktor hubungan antara struktur yang diberikan pada sel dan sel-sel yang dikumpulkan pada struktur tersebut. Setelah komponen selular dan struktur organ yang dibentuk ditentukan, penambahan vaskularisasi yang adekuat dan pengaturan sinyal sel jaringan normal merupakan tantangan terbesar.Bermacam pendekatan rekayasa jaringan bisa diperkecil menjadi desain in vitro dan in vivo. Semua telah mencoba memberi wadah dan penunjang untuk sel, populasi sel yang cukup, dan pengganti matriks ekstraseluler. Interaksi antara sel dan matriks ekstraseluler memerlukan migrasi, proliferasi, diferensiasi dan apoptosis sel, yang semua merupakan fungsi penting untuk membangun jaringan bentukan.60Model in vitro biasanya tergantung pada formasi sistem bioreaktor atau pembentukan pola sel untuk penelitian monolayer.20,42,58,101 Bioreaktor adalah alat pembiakan jaringan dinamis yang beragam mulai dari desain mekanis sederhana hingga sistem kompleks dengan pertukaran oksigen, jumlah aliran yang ditentukan, dan stimulasi elektrik dan mekanik. Rekayasa jaringan sederhana seperti lembaran sel hanya memerlukan metode pertukaran pertumbuhan yang sederhana untuk membentuk jaringan yang terhindar dari stasis. Contohnya tabung pemutar atau wadah berputar.22Bioreaktor yang lebih kompleks telah didesain untuk melengkapi biakan regangan otot skeletal,94 tarikan sel endotel,96 dan tekanan pada kondrosit.12 Terdapat bukti bahwa bangunan sel polimer tumbuh in vitro dalam kondisi fisiologis yang lebih dekat daripada in vivo, termasuk tegangan dan aliran nutrisi periseluler, yang membuat morfologi sel, sifat pertumbuhan, dan aktifitas metabolik lebih baik.55,68,81 Penelitian terhadap kondrosit yang ditumbuhkan dalam biakan asam poliglikolik yang diberi tekanan hidrodinamik menunjukkan proliferasi sel lebih besar 50%, glikosaminoglikan lebih banyak 60%, dan kolagen lebih banyak 125% yang terbentuk dalam matriks ekstraseluler.4,32Model in vitro lain untuk rekayasa jaringan termasuk pembentukan pola sel dalam biakan monolayer ataupun tiga dimensi. Bentuk kerangka jaringan menghasilkan pola pertumbuhan dan diferensiasi yang lebih dapat diprediksikan. Pada kasus organ yang lebih kompleks, seperti hati, pembiakan tambahan dalam media jaringan spesifik menjadi keharusan untuk desain yang berhasil.5 Fotolitografi telah digunakan untuk menghasilkan domain bergantian pada N-(2-aminoetil)-3-aminopropyl-trimetoksilan dan dimetildiklorosilan yang khusus membenihkan sel-sel tulang manusia ke domain awalnya, dibantu oleh vitronektin. Pola resolusi tinggi poly-L-lysine digunakan untuk cetakan mikrokontak berskala mikrometer untuk mensejajarkan neuron yang dibiakkan,42 dilekatkan melalui cetakan mikrokontak oligopeptida spesifik.101 Batasan penyebaran sel dan pembiakan sel yang teratur lebih dekat menggandakan susunan jaringan manusia tiga dimensi yang teratur. Tanda topografi bisa saja sama pentingnya dengan sinyal biologis.Perpotongan rekayasa mikrofabrikasi dan sistem pembiakan jaringan in vitro yang menjanjikan adalah perkembangan bioreaktor yang lebih kecil dan lebih pintar, dimana mikrofluid, transfer massa, ekstraksi nutrisi, dan pertumbuhan sel semuanya dapat diteliti dengan susunan selular yang telah diketahui dan mikrofabrikasi skala mikrometer yang telah distandarisasi.8,9,20,44 Seperti yang telah dijelaskan sebelumnya dalam rekayasa jaringan hati, pendekatan ini penting untuk organ-organ kompleks.Penelitian in vivo telah menggunakan hewan sebagai bioreaktor kompleks, dengan kerangka komposit yang ditanam dalam ruang bervaskular, seperti omentum, mesenterium, lemak interskapular, atau latissimus dorsi, dimana suplai darah endogen dapat membantu angiogenesis.93 Pengganti matriks ekstraselular dalam bentuk wadah ditanam setelah pemuatan sel ke dalam kerangkan tersebut.52 Prevaskularisasi spon polimer, dengan menanam kerangka beberapa hari hingga beberapa minggu sebelum menambah sel, dapat meningkatkan angka kelangsungan hidup sel.87Pada model in vivo yang lama, sel-sel parenkim hati, usus, dan pakreas ditanam dalam polimer biodegradabel setelah pembiakan in vitro 4 hari, menghasilkan sel-sel yang viabel, gambaran mitotik, dan vaskularisasi massa sel yang tumbuh.93 Satu polimer yang digunakan untuk penelitian ini adalah kopolimer 90-10 glikolid dan laktid, diproduksi secara luas dengan nama Vicryl. Dengan perkembangan pesat biomaterial yang tersedia, peneliti telah berhasil menggunakan bermacam wadah, termasuk submukosa usus halus sebagai graft vena berdiameter kecil dengan transpaltasi hepatosit, disambung antara vena porta dengan vena cava inferior.49 Keberhasilan lainnya dengan gel kalsium alginat, yang tersedia sebagai sufaktan, agarose, perekat fibrin, dan bahan-bahan mikrofabrikasi biodegradabel menggambarkan perlunya kerjasama antara teknisi kimia dan jaringan.1,35,36,95Gabungan pendekatan in vitro dan in vivo telah memecahkan beberapa masalah sederhana rekayasa jaringan dan akan selanjutnya akan penting untuk pelepasan jaringan autolog, pembesaran di laboratorium, dan akhirnya dalam penggantian in vivo.
REKAYASA JARINGAN KARTILAGO DAN TULANGDefek struktur menjadi dasar banyak permasalahan kongenital yang dihadapi ahli bedah anak. Beberapa penatalaksanaan pionir telah terfokus pada rekayasa jaringan in situ, seperti osteogenesis distraksi diikuti graft tulang untuk mengobati sindrom Treacher Collins.57 Pada tahun 1960-an, Tessier melakukan mobilisasi segmen besar tengkorak dan translokasi mata pada kasus sindrom Apert dan sindrom Crouzon.83Untuk membantu pendekatan pionir ini, teknisi jaringan telah berupaya mencari cara untuk menghasilkan jumlah tulang dan kartilago yang lebih banyak. Hal ini dimulai dengan observasi kondrosit yang dikumpulkan dari permukaan sendi untuk didiferensiasi dalam pembiakan kartilago, kemudian kondrosit dari periosteum mulai menyerupai kartilago tapi tetap dalam pembiakan untuk membentuk tulang baru.92Jaringan yang relatif sederhana, kartilago memiliki kapasitas regenerasi spontan yang terbatas setelah terjadi kerusakan.24,26,59 Perbaikan defek besar kartilago terjadi melalui formasi jaringan fibrokartilago, dengan biokimia dan profil biomekanik yang berbeda dari kartilago asalnya.39 Osteoarthritis dengan nyeri dan penurunan fungsi dapat terjadi akibat perbaikan yang tidak adekuat.18 Pada tahun 1998 Vacanti dkk menghasilkan hyalin kartilago baru dari kondrosit sapi dalam wadah polimer.90Dalam penelitian selanjutnya menggunakan jala anyaman asam poliglikolik dan asam polilaktik, kerangka dapat dibuat menjadi bentuk yang telah ditentukan.90 Kerangka ini dapat membuat kartilago dalam bentuk telinga manusia88 dan diskus sendi temporomandibular,66 seperti kartilago yang dibentuk khusus untuk menggantikan kartilago sendi yang rusak pada penggantian meniscus.38 Rekayasa jaringan kartilago juga telah digunakan sebagai massa struktural untuk rekonstruksi puting pada babi14 dan untuk menutup defek kranial pada hewan.53 Tabung kartilago yang dibatasi oleh epitel pernafasan telah dibuat dan ditanam sebagai pengganti trakea,69,91 dan terlihat silia yang terbentuk pada beberapa sel epitel dalam 3 minggu.69
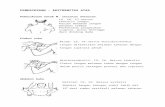
Gambar 3-1. Tiga jenis struktur jaringan komposit yang berbeda dari rekayasa jaringan jari. Struktur dibentuk in vitro dengan cara dijahit untuk membuat model falang distal (Grup I), falang tengah (Grup II), dan sendi interfalang distal (Grup III). Jaringan yang dijahit kemudian ditanam secara subkutan pada tikus tanpa thymus.Rekayasa jaringan tulang bermula pada rekayasa kartilago, dengan transfer sel periosteal sapi ke wadah asam poliglikolik dan penanaman ke tikus tanpa thymus. Susunan ini diberi osteokalsin dan menunjukkan titik-titik fokus formasi tulang pada evaluasi mikroskopik. Susunan ini kemudian ditanam untuk memperbaiki defek tulang tengkorak parietal, frontal, dan temporal pada tikus; polimer tanpa sel digunakan sebagai kontrol.89 Perbaikan tulang dengan susunan rekayasa jaringan diobservasi, dibandingkan dengan tidak adanya perubahan pada defek tengkorak pada kelompok kontrol. Demikian pula, tehnik ini telah diterapkan pada defek tulang femur yang difiksasi dengan plat untuk menjaga jarak penting. Non union terlihat pada kelompok kontrol, dan formasi kalus yang subur terlihat pada kelompok rekayasa jaringan.Kombinasi rekayasa jaringan tulang dan kartilago telah digunakan untuk membuat pengganti jari.41 Tiga tipe sel sapi periosteum, kondrosit, dan tenosit ditanam pada kopolimer asam poliglikolik dan asam poli-L-laktik membentuk jaringan komposit yang mirip sendi (Gambar 3-1). Bagian-bagian ini dikumpulkan dan dijahit bersama dalam bentuk falang distal, falang tengah, dan sendi distal interfalangeal. Kumpulan ini kemudian ditanam secara subkutan pada tikus tanpa thymus. Pada 20 minggu, bentuk dan histologi jari manusia dengan sendi dipertahankan, dengan kartilago sendi matur, tulang subkondral, dan tenokapsul. Rekayasa jaringan tulang dan kartilago sangat menjanjikan untuk rekonstruksi sendi dan untuk kelainan kongenital kompleks yang harus dihadapi ahli bedah ortopedi anak.
REKAYASA JARINGAN KARDIOVASKULARTiap tahun di Amerika Serikat terdapat 5 8 anak dari 1000 kelahiran hidup yang menderita malformasi jantung kongenital, termasuk gangguan katup.17 Pentalaksanaan bedah anak pada defek jantung kongenital biasanya membutuhkan pembuluh atau katup non autolog.56,71 Awal tahun 1960-an lebih dari 40% penggantian katup dibuat dari jaringan sapi atau babi yang diawetkan dalam glutaraldehid.71 Jaringan pengganti katup dapat menghindari masalah katup mekanik, termasuk tromboembolisme sistemik dan sumbatan trombotik,21 tapi masih 50% hingga 60% perlu dioperasi ulang dalam 10 tahun untuk masalah yang berkaitan dengan prostesis, seperti disfungsi struktural dan non struktural, penurunan progresif (kalsifik dan non kalsifik), dan infeksi.21,33 Demikian pula, jaringan katup pengganti yang paling sering digunakan memiliki jangka waktu penggunaan terbatas akibat penurunan progresif.71Katup pengganti yang sempurna harusnya non obstruktif, non trombotik, mampu memperbaiki diri sendiri yang tumbuh bersama pasien dan dapat berubah bentuk sebagai respon terhadap stimulus in vivo.71 Kriteria ini tidak berubah sejak dikemukakan oleh Harkin dkk pada tahun 1962.34 Perbaikan satu kali sangat berharga bagi pasien anak-anak, yang bisa saja memerlukan banyak operasi sepanjang hidupnya.Jaringan rekayasa katup jantung telah dicoba menggunakan metode tradisional rekayasa jaringan. Sel-sel yang dibiakkan dalam wadah susunan pertama dicoba dengan katup xenogenik deseluler, kemudian dalam polimer murni yang disesuaikan dengan bentuk yang baik.2,62,72 Pada penelitian pertama, sel endotel manusia dari vena saphena dibiakkan pada katup aorta babi yang diberi deterjen Triton untuk membuang sel asal dan meninggalkan matriks ekstraselular sebagai pendukung selular.2 Dibiakkan seperti penggantian katup pulmonar pada domba, katup-katup ini fungsional secara hemodinamik dan menunjukkan tidak ada kalsifikasi ketika dipanen.2 Hasil yang sama didapat dengan komposit bioprostesis yang dijahit dari beragam lembaran dan saluran, yang juga dideselularisasi sebelum dibenihkan.62Merekayasa perancah polimer lebih penting dibandingkan menghancurkan sel katup yang telah ada dan mengisinya kembali untuk mencapai katup yang hidup yang memungkinkan untuk tumbuh. Ketika sel autolog mengisi perancah polimer, yang kemudian berdegradasi secara biologis, sel autolog juga mensekresikan matriks ekstrasel untuk memelihara kekuatan mekanik.76 Studi-studi awal mengenai perancah asam poliglikolik yang ditanami dengan sel endotel dan miofibroblas domba, yang ditanam setelah reseksi leaflet posterior kanan alami dari katup pulmonari pada domba, menghasilkan tidak adanya stenosis dan arsitektur selular dan pembentukan matriks yang cocok.72 Ketika sel yang ditanam dilabel dengan penanda selular, leaflet meningkatkan muatan kolagen dan menambahkan elastin, dan sel-sel asli tetap ada, juga dengan fungsi katup yang dapat diperagakan oleh ekokardiografi.10Penambahan bioreaktor mekanik yang semakin menekan katup rekayasa dan meningkatkan perancah polimer (polihidroksialkanoat) menghasilkan katup pulmonari dengan regurgitasi minimal, tidak ada pembentukan trombus, jaringan serat yang berlapis, dan peningkatan matriks ekstrasel.76 Katup rekayasa yang tumbuh dalam tekanan mekanik dengan perkiraan tekanan denyut sistolik77 berfungsi in vivo sampai pada 5 bulan dan menyerupai katup alami dalam konteks pembentukan matriks, histologi, dan biomekanik.Meskipun beberapa kriteria Harken telah terpenuhi oleh katup rekayasa jaringan, dan kemampuan penting untuk tumbuh dengan inang juga dapat terpenuhi, katup-katup ini perlu diuji dan berhasil pada posisi aortik, karena inilah katup yang paling sering sakit, diteliti, dan diganti.71
REKAYASA JARINGAN VASKULARSebagai tambahan terhadap perbaikan katup, faktor kedua dalam kelainan jantung kongenital pediatrik adalah pertumbuhan saluran yang cukup, di mana homograft atau material prostetik telah digunakan. Saluran ini tidak tumbuh dan melemah secara fungsional melalui kalsifikasi dan pertumbuhan jaringan ke arah dalam, berujung kepada berbagai bedah penggantian. Pembuluh yang lebih kecil, yaitu yang kurang dari 6mm, tidak dapat dibuat dengan benar dari tekstil atau politetrafluoroetilen (PTFE) yang diperluas dan harus di-bypass oleh arteri dan pembuluh darah autolog, dengan persediaan terbatas untuk berbagai operasi.86Dengan kekurangan-kekurangan tersebut, rekayasa jaringan merupakan strategi logis untuk penggantian pembuluh kecil dan besar. Pada Februari 2001 penggunaan pembuluh rekayasa jaringan manusia pertama dilaporkan oleh Shinoka et al. (gambar 3-2) pada gadis 4 tahun yang sebelumnya melalui prosedur Fontan dan angioplasti arteri pulmonari pada usia 3 tahun 3 bulan untuk satu ventrikel kanan dan atresia pulmonari.73 Angiografi berikutnya menunjukkan total hambatan arteri pulmonari menengah kanan. Sebuah segmen autolog 2cm dari pembuluh darah periferal diambil dan selnya diisolasi dan diperluas dalam kultur sampai 12 x 106 sel dalam 8 minggu. Sebuah tabung polikaprolakton dan kopolimer asam polilaktik dalam rasio berat 1:1 yang diperkuat dengan jahitan asam poliglikolik bertindak sebagai perancah untuk sel yang ditanam, yang diimplantasikan 10 hari setelah penanaman sel untuk membangun kembali arteri pulmonari yang terhambat. Setelah 7 bulan tidak lanjut, tidak ada komplikasi yang tercatat.
Gambar 3-2. Teknik rekayasa jaringan dasar. Sel-sel dari pembuluh alami diisolasi dan diperluas in vitro dan ditanam pada perancah polimer yang berdegredasi biologis untuk membentuk arteri pulmonari rekayasa yang kemudian ditanam pada seorang anak, dengan hasil yang bagus.Perekayasaan jaringan pembuluh darah dimulai pada 1978, ketika Herring berhasil mengisolasi sel endotel dari pembuluh darah dan mentransplantasinya pada perancah sintetik.98 Beberapa peneliti meningkatkan fungsi dan arsitektur jaringan dengan protokol penanaman, komposisi perancah, dan kondisi kultur yang bergantian. Pada 1998 Shinoka et. al. mengkultur arteri domba dan sel endotel vena pada kondisi yang sama pada penggantian pada manusia dan mengganti segmen 2cm arteri pulmonari pada anak domba.74 Kontrol aselular terhambat trombus, walaupun jaringan yang dirancang memiliki lapisan endotel luminal, kolagen, dan elastin dan tidak terhambat trombus pada eksplan.74 Sama halnya, sebuah konstruksi yang ditanami dengan sel vena domba pada polimer yang berbeda (poli-4-hidroksibutirat) dan dijahit ke arteri pulmonari dalam augmentasi patch menghasilkan peningkatan proteoglikan, elastin, dan kolagen, dan tetap terbuka / paten.78 Polihidroksialkanoat dan kopolimer asam poliglikolik yang ditanami dengan sel arteri domba juga menghasilkan cangkok patch paten, dan kurva tegangan-regangan mekanik mulai menyamai kurva yang terdapat pada pembuluh darah alami seiring waktu.75Peningkatan kekuatan saluran, kelangsungan hidup, dan ketahanan akan cenderung tumbuh dengan peningkatan pemahaman interaksi antara sel dan sel dan sel dan polimer, yang mengarah kepada regenerasi arsitektur yang meliputi matriks ekstrasel, barisan halus sel endotel pada permukaan luminal, dan kolagen dan serat elastin. Penggunaan fragmen jaringan untuk mengisi konstruksi yang mengandung berbagai tipe sel, termasuk sumsum tulang, telah dilaporkan mempercepat penyembuhan cangkokan dan menghalangi hiperplasia intimal.61 Sama halnya, peningkatan pada karakteristik polimer telah meningkatkan kecepatan dan kualitas pertumbuhan pembuluh.75,100
REKAYASA JARINGAN USUSPada kondisi morbid yang terkait dengan reseksi usus, sindrom usus pendek merupakan penyakit yang paling berbahaya. Penyakit ini dicirikan oleh penurunan berat badan progresif, malnutrisi, kekurangan vitamin, dan infeksi yang terkait dengan akses vaskular yang umumnya digunakan untuk membantu pasien dengan sindrom ini.99 Sindrom usus pendek umumnya terjadi ketika kurang dari sepertiga usus kecil normal tersisa setelah reseksi masif atau perawatan bedah dari sejumlah masalah usus. Meskipun ada beberapa inovasi bedah untuk perawatan sindrom ini, termasuk transplantasi usus,13 segmen terbalik,19 recirculating loops,84 dan prosedur peruncingan dan pemanjangan untuk mendorong mukosa usus untuk berkembang biak,65,97 tidak ada solusi bedah yang sempurna. Transplantasi usus telah memiliki beberapa keberhasilan awal tetapi tidak tidak tersebar luas. Pekerjaan awal dalam perekayasaan jaringan usus meliputi patch autolog dari serosa atau pedikel yang tervaskulerisasi, yang keberhasilannya beragam.7,51,54 Hal ini juga dilakukan dengan patches yang terdiri dari polimer, alloderm, dan SIS, submukosa kolagen dari usus.3,15,40 Perekayasaan jaringan menawarkan alternatif menarik dengan tujuan mengganti usus sebelum membangun hubungan terhadap lumen usus alami.
Gambar 3-3. Esofagus rekayasa jaringan / tissue engineered esophagus (TEE) pada sambungan gastroesofageal, dengan esofagus rekayasa / engineered esophagus (EE) dan perut alami dengan kelenjar gastrik / gastric glands (GG) dalam perkiraan dekat.Dimulai dengan observasi bahwa usus janin yang ditransplantasi pada perancah polimer menunjukkan proliferasi dan morfogenesis usus,93 produksi usus rekayasa jaringan telah meluas dalam model tikus dari usus kecil sendiri untuk meliputi perut rekayasa, sambungan gastroesofageal, esofagus, dan kolon (gambar 3-3 dan 3-4).27-29,31 Pembuatan jaringan komposit yang menyerupai usus kecil dibangun dari sel usus yang ditransplantasi secara heterotopik ketika unit organoid yang pertama dilaporkan pada tahun 1998.16 Unit organoid diambil dari hasil pengambilan usus yang tebal-penuh dan dimurnikan melalui pembedahan, pencernaan enzim, dan triturasi sebelum sentrifugasi diferensial. Produk dari persiapan ini, yaitu unit organoid, dimuat pada polimer silindris tidak terjahit 2mm yang terbuat dari asam poliglikolik dan dilapisi dengan asam polilaktik sebelum implantasi ke dalam omentum. Meskipun polimer yang ditanam awalnya harus dipaparkan terhadap tekanan oksigen rendah, angiogenesis terjadi. Pertumbuhan usus rekayasa mencerminkan polarisasi sel epitel untuk menghadap ke dalam terhadap lumen kista, dengan rekonstitusi yang cocok dari lapisan dinding usus lainnya, termasuk otot dan saraf. Vaskularisasi substansial juga menyertai pertumbuhan usus rekayasa.16Tindak lanjut jangka panjang setelah anastomosis usus kecil rekayasa jaringan terhadap jejunum alami setelah 75% reseksi usus kecil pada tikus Lewis jantan menunjukkan peningkatan berat badan, keterbukaan usus, dan peningkatan statistik signifikan dalam besarnya usus rekayasa.45,48 Ketika digunakan sebagai pertolongan mengikuti reseksi usus kecil yang masif, binatang dengan usus kecil rekayasa jaringan kembali pulih berat badannya dengan lebih cepat, sampai pada berat sebelum operasi; binatang tanpa usus rekayasa menjadi memburuk.30 Penyelidikan terhadap sistem kekebalan dari usus kecil yang di-anastomosis mengindikasikan bahwa populasi sel kebal neomukosal merupakan fungsi paparan terhadap antigen luminal dan waktu pengambilan.64 Pada mukosa usus kecil rekayasa jaringan yang diambil pada 20 minggu, ketebalan dan distribusi topografis dari subset sel kebal identik dengan sel kebal yang berasal dari jejunum normal. Topografi ekspresi RNA kurir epitel dari SGLT1, ko-transporter sodium-glukosa usus, juga diperbarui pada usus kecil rekayasa yang di-anastomosis, sama halnya dengan DCT1, sebuah pengangkut zat besi; tetapi, faktor pertumbuhan endotel vaskular dan kadar faktor pertumbuhan fibroblas dasar berbeda dengan yang terdapat dalam usus alami.25,82 Pola distribusi pengangkutnya mengindikasikan bahwa usus rekayasa mengulangi pola jejunum alami, menegaskan potensi terapeutik dari saluran ini untuk pasien yang tidak memiliki usus kecil.
Gambar 3-4. Jaringan yang direkayasa pada model tikus Lewis. A esofagus rekayasa jaringan (pembesaran asli 20x). B kolon rekayasa jaringan (pembesaran asli 20x). C Perut rekayasa jaringan. Perhatikan sel parietal terang yang besar dan struktur glandular.
Dengan perbaikan dari protokol organoid untuk usus rekayasa, jumlah yang lebih besar telah dibuat dengan daerah permukaan yang lebih besar, dan kolon, perut, dan esofagus yang direkayasa dapat dibuat (lihat gambar 3-3).30 Lebih dari 20 kali volume polimer yang ditanam dapat diproduksi.27,29 Kolon rekayasa jaringan berfungsi sebagai pengganti pada tikus Lewis selama 41 hari, dengan pemeliharaan kadar sodium, penyerapan cairan, penghasilan asam lemak rantai pendek tinja, waktu transit yang diperpanjang, dan arsitektur yang meliputi sel ganglion dan histologi kolon asli.27,29 Esofagus rekayasa jaringan telah digunakan sebagai patch dan sebagai cangkok interposisi pada tikus dalam studi pendahuluan (lihat gambar 3-3).28 Dalam kasus perut rekayasa jaringan, gagasan mengenai penggantian tepat telah diperluas dalam serangkaian studi yang menunjukkan bahwa sambungan gastroesofageal rekayasa jaringan dapat disiapkan, dan juga sebagai antrum sendiri, dan tikus muda atau tua dapat menjadi donor autolog.31 Stains jaringan yang cocok untuk gastrin memiliki sel parietal, dan memiliki arsitektur yang persis dengan perut alami. Perut rekayasa jaringan dapat dilabel dengan protein viral (protein berpendar hijau) untuk identifikasi selanjutnya, membuka pintu untuk transfeksi mendatang untuk usus perancang; sebagai contoh, kolon rekayasa jaringan dapat ditransfeksi dengan SGLT1 untuk memungkinkan menyerap gula.31Penggantian usus rekayasa merupakan inti terhadap perawatan beragam penyakit bedah pediatrik dan dapat berimbas signifikan pada perawatan pasien pada dekade mendatang, dengan peningkatan area permukaan, fungsi pengangkut, karakteristik kekebalan, dan arsitektur. Sejumlah besar studi binatang telah dimulai pada beberapa laboratorium, dengan keberhasilan pertumbuhan dari sejumlah kecil usus kecil dan perut rekayasa jaringan dalam satu kesatuan.
PENGGANTIAN HATI DAN REKAYASA JARINGANHati merupakan organ yang kompleks dan tak dapat digantikan yang menyediakan fungsi vital, meliputi metabolisme, ekskresi, detoksifikasi, penyimpanan, dan fagositosis. Kegagalan global dari organ ini dengan disfungsi hati akut atau kronis menyebabkan kematian dari 30.000 orang Amerika setiap tahunnya, dengan tingkat mortalitas kegagalan hati akut melebihi 80%.85 Kegagalan kronis merupakan penyebab utama nomor 6 dari kematian di Amerika Serikat dan nomor 8 dalam biaya ekonomis di antara penyakit-penyakit utama. Saat ini, perawatan yang pasti untuk kegagalan hati yang parah hanyalah transplantasi hati ortotopik, dengan 3000 prosedur dilakukan per tahun. Usaha untuk merekayasa jaringan hati untuk penggantian telah meliputi injeksi seluler langsung atau transplantasi konstruksi polimer, dengan atau tanpa stimulasi hepatotrofik; pertumbuhan perangkat bioartifical liver (BAL) luar tubuh; dan konstruksi mikrofabrikasi tiga dimensi yang baru yang dimaksudkan untuk digunakan di dalam tubuh.Rekayasa jaringan hati awalnya bermula dengan transplantasi sel setelah observasi bahwa tranplantasi hati ortotopik mungkin tidak penting ketika penggantian dari populasi sel terpilih dapat merawat cacat fungsi hati.68 Regenerasi Promethean dari hati membuat gagasan transplantasi hepatosit lebih menarik.Pada studi awal, ketika hepatosit diinjeksi ke dalam pembuluh darah portal tikus Gunn yang kekurangan glukuroniltransferase difosfat uridin, kadar bilirubin yang rendah terjaga dibandingkan binatang kontrol yang diinjeksi dengan saline.55 Injeksi hepatosit terhadap pembuluh darah portal atau rongga peritoneal dilakukan setelah memicu kegagalan hati dengan dimetilnitrosamin.81 Tikus yang menerima injeksi hepatosit hidup jauh lebih lama dibandingkan yang berada pada kelompok kontrol. Injeksi hepatoselular ke dalam limpa, pankreas, dan rongga peritoneal menjaga kemampuan fungsional pada beberapa studi dan juga tercatat bermigrasi. Hepatosit pembuat antigen permukaan virus hepatitis B, diperkenalkan secara ektopik, tercatat bermigrasi ke pankreas, paru-paru, dan limpa saat memelihara fungsi.32 Batasan pendekatan ini adalah kemampuan fungsional keseluruhan dari sel yang terinjeksi, yang berkurang seiring waktu. Migrasi dan atrisi menyebabkan kegagalan untuk membangun massa hati diskrit.Massa hati rekayasa jaringan telah meningkat oleh stimulasi hepatotrofik yang bersamaan dan peningkatan seleksi selular. Stimulasti hepatotrofik, yang terdapat pada pasien gagal hati yang menerima terapi hati rekayasa jaringan, telah direka ulang oleh hepatektomi parsial, pemintasan portakava, dan injeksi racun hati. Mengikuti reseksi hati, telah diketahui secara luas bahwa hati yang tersisa berkembang biak dengan cepat dengan berbagai stimuli pertumbuhan, termasuk faktor pertumbuhan epiderm, faktor pertumbuhan hepatosit, insulin, dan glukagon.11 Peningkatan jumlah faktor-faktor tersebut dalam darah portal telah berujung pada pendekatan pemintasan portakava pada binatang inang ketika konstruksi rekayasa jaringan ditanam ke dalam mesenterium atau omentum, untuk memberikan konstruksi tersebut persediaan faktor trofik yang melimpah. Hepatektomi dan pemintasan portakava pada saat implantasi konstruksi menghasilkan peningkatan proliferasi hepatosit yang ditransplantasi, kelangsungan hidup sel yang lebih lama, organisasi yang lebih baik, dan kadar bersihan bilirubin yang lebih tinggi pada tikus Gunn.46,70,87Transplantasi selular, bahkan dengan stimulasi hepatotrofik maksimal, belum menghasilkan massa hepatoselular yang cukup untuk mendetoksifikasi plasma dari pasien manusia pada gagal hati fulminan. Oleh karena itu, hati rekayasa jaringan dapat memberikan pergantian fungsi hati sementara dalam bentuk perangkat BAL luar tubuh, atau perangkat mikrofabrikasi dalam tubuh yang lebih baru. Tujuan dari BAL luar tubuh adalah untuk bertindak sebagai jembatan transplantasi, menekan morbiditas dan mortalitas pasca operasi,79 dan juga untuk membantu pasien gagal hati akut ketika pembaruan hati terjadi atau pasien yang tidak dapat menjalani transplantasi karena penyakit konkomitan.Model percobaan barisan sel yang berasal dari tikus, babi, atau manusia dalam kombinasi sel dan perancah rekayasa jaringan telah digunakan untuk mendetoksifikasi darah pasien penderita gagal hati fulminant.48,80 Pada perangkat yang telah melalui percobaan pada pasien manusia penderita gagal hati, hepatosit babi yang terikat pada mikrokarier berlapis kolagen di dalam membran dialisis tersambung di luar tubuh.67Terlepas dari perkembangan sistem kultur hepatosit yang stabil, termasuk sisipan kolagen dan sistem gel ganda, paparan plasma yang berkepanjangan terhadap kultur hepatosit dalam bioreaktor yang termikrofabrikasi menghasilkan akumulasi signifikan dari tetesan trigliserida intrasel, menghasilkan pengurangan fungsi sel yang parah. Jangka hidup BAL adalah dalam hitungan jam sampai dengan hari, yang harus ditingkatkan untuk terapi jangka panjang. Dalam penelitian yang lebih terkini, hepatosit dan sel nonparenkim yang di ko-kultur lebih toleran terhadap lingkungan plasma.6Premis ko-kultur dalam kultur sel hati berasal dari pengamatan bahwa sel mesensimal dari pembuluh darah vitelin dan umbilik memicu tunas hati endoderm untuk berkembang biak, bercabang, dan berdiferensiasi dalam utero.37 Hati orang dewasa memberikan sebuah perancah beragam interaksi antara sel dan sel (duktal empedu, Kupffer, sel endotel sinusoid, dan hepatosit), yang memungkinkan fungsi organ yang terkoordinasi. Interaksi-interaksi ini mengimplikasikan peran penting untuk pensinyalan sel antara kompartemen jaringan mesensimal dan parenkim.Fisiologi sel hati bersifat kompleks, dan jangka hidup hepatosit dewasa, meskipun diperpanjang dengan peningkatan kondisi kultur, berkisar dalam hitungan mingguan.Ditambah dengan kemajuan modern dalam mikrofabrikasi, pengamatan mengenai ko-kultur sel dapat mengarah kepada hati rekayasa jaringan yang dapat ditanam. Akan tetapi, pertumbuhan vaskular ke arah dalam ke dalam konstruksi yang ditransplantasi mungkin tidak akan cukup untuk organ kompleks seperti hati. Oleh karena itu, laboratorium kami telah mencari cara untuk membangun sistem vaskular sampai pada tingkat kapiler, dan kemudian menambahkan parenkima dari organ kompleks.9 Sistem vaskular de novo dapat digunakan sebagai contoh untuk jaringan yang tebal dan kompleks seperti jantung, hati, atau ginjal, yang kesemuanya bergantung pada vaskularisasi ekstensif, melebihi batas dari pertumbuhan ke arah dalam dari inang itu sendiri.9Susunan kanal yang teratur untuk hepatosit dengan properti adhesi sel yang didesain secara regional pertama dibuat menggunakan pencetakan tiga dimensi,50,63 yang menggabungkan rancangan komputer dengan fabrikasi polimer, mengeluarkan polimer cair pada polimer bubuk dan kering melalui mesin yang menyerupai ink-jet printer. Ketika lapisan polimer padat sedang terbentuk, struktur tiga dimensi kompleks dapat dibentuk dengan resolusi tinggi. Oleh karena itu, kanal untuk persediaan darah dan bantuan selular dapat dirancang dan difabrikasi.ARAH DI MASA DEPAN : STRUKTUR DAN SEL YANG LEBIH BAIKDengan hadirnya sistem mekanik mikroelektrik (MEMS) yang juga digunakan dalam pedoman dan navigasi inersia,9 mikromesin silikon telah digunakan untuk membentuk perancah yang lebih baik untuk jaringan vaskular. Pola parit digoreskan pada contoh silikon dan Pyrex dengan resolusi sampai pada 10 m dalam pola yang meniru jaringan vaskular (gambar 3-5). Sel endotel dan hepatosit yang dikultur pada contoh MEMS tetap hidup dan berkembang biak, menghasilkan albumin.9 Tiga monolayer kemudian dapat diangkat dan dibentuk ke dalam struktur tiga dimensi. Menumpuk lapisan-lapisan ini dapat menyatukan sistem empedu dan meningkatkan area permukaan yang tersedia dari jaringan yang divaskularisasi dan parenkima-nya ditambahkan ke dalam sistem.
Gambar 3-5. Mikrograf optik dari bagian jaringan kapiler yang direkatkan pada wafer silikon menggunakan sistem mekanik mikroelektrik.
Studi lebih lanjut telah memastikan bahwa teknologi mikrofabrikasi dapat digunakan untuk membentuk lembaran besar jaringan hidup dan bahwa permukaan luminal mikromesin untuk sel endotel memungkinkan ko-kultur yang beraturan (gambar 3-6).9 Lapisan teratur yang diangkat telah ditanam sebagai cangkok permanen.Kemajuan-kemajuan tersebut disertai dengan pencarian populasi selular yang lebih cocok, yang dapat meliputi kultur campuran pada perancah yang asing. Contoh mikromesin yang lebih baik sedang dibuat berkolaborasi dengan Draper Laboratories di Massachusets Institute of Technology, dengan model matematis dari cairan mikro yang diharapkan dan transfer nutrisi. Dengan solusi terhadap masalah vaskularisasi organ kompleks, banyak target rekayasa jaringan yang sulit yang akhirnya dapat berada dalam jangkauan.
Gambar 3-6. Sel endotel yang tumbuh pada wafer Pyrex berlapis Vitrogen (30 g/mL) setelah 4 hari kultur.
Perluasan armamentarium rekayasa jaringan yang nyata adalah penggunaan sel batang atau barisan sel pluripoten di masa mendatang, yang melibatkan isu etika dan politik yang harus diatasi. Penting halnya, mayoritas solusi rekayasa jaringan berkisar seputar sel autolog atau singeneik dibandingkan penerapan sel batang secara langsung. Jumlah proyek yang menggunakan sel batang mesensimal telah meningkat pesat, dan beberapa darinya telah memperhatikan cairan amniotik sebagai sumber sel batang mesensimal untuk rekayasa jaringan janin.47 Sebagai tambahan, jaringan janin, termasuk kondrosit untuk rekonstruksi dinding dada, telah diambil dari janin domba, diperluas di laboratorium sampai kelahiran dombanya, dan kemudian ditanam saat itu, dengan penggantian struktural tercatat sampai 10 minggu setelah implantasi.23 Sebagian besar strategi rekayasa jaringan yang bergantung pada pendekatan yang tidak berbasis sel batang cenderung menggunakan sumber yang terdapat pada jaringan yang digunakan, sehingga sel batang telah digunakan dalam rekayasa jaringan tanpa teridentifikasi dengan jelas. Menarik untuk diperhatikan bahwa sel-sel ini, yang sudah cukup terdiferensiasi, cukup untuk produksi beragam jaringan.Metamorfosis yang cepat dari rekayasa jaringan telah terjadi utamanya melalui kolaborasi kreatif di antara insinyur, ahli kimia, dokter bedah, ahli fisika, ahli biologi, dan ilmuwan dalam sejumlah bidang ilmu lain, dengan kemajuan nyata tercipta melalui kemajuan yang bersamaan dalam material, fisiologi selular, dan penerapan pembedahan. Evolusi perangkat bioreaktor, meliputi perangkat yang menekan sel sampai kondisi fisiologis yang diperkirakan, juga menghasilkan jaringan yang lebih baik. Kombinasi rekayasa mekanik, rekayasa jaringan, dan riset pembedahan melambangkan masa depan rekayasa jaringan untuk masalah pembedahan umum dan pediatrik.