Laporan Parasit
-
Upload
yosia-arauna -
Category
Documents
-
view
247 -
download
4
description
Transcript of Laporan Parasit

LAPORAN KOASISTENSI ROTASI LABORATORIUM
PARASITOLOGI VETERINER
yang dilaksanakan pada 18 September – 6 Oktober 2014
di Universitas Airlangga Surabaya
OLEH
YOSIA ARAUNA, S.KH
130130100111031
PENDIDIKAN PROFESI DOKTER HEWAN
PROGRAM KEDOKTERAN HEWAN
UNIVERSITAS BRAWIJAYA
MALANG
2014

DAFTAR ISI
Halaman
COVER..................................................................................................................................i
DAFTAR ISI..........................................................................................................................ii
BAB 1 PENDAHULUAN ..................................................................................................1
1.1 Latar belakang ......................................................................................................1
1.2 Rumusan masalah.................................................................................................1
1.3 Tujuan .................................................................................................................1
BAB 2 PELAKSANAAN KEGIATAN..............................................................................2
2.1 Prosedur Pemeriksaan Cacing (Helminthes).........................................................2
2.1.1 Pemeriksaan Feses dengan Metode Natif....................................................2
2.1.2 Pemeriksaan Feses dengan Metode Sedimentasi........................................2
2.1.3 Pemeriksaan dengan Metode Apung............................................................2
2.1.4 Pemeriksaan Saluran Pencernaan Unggas...................................................3
2.1.5 Pembuatan Preparat Permanen Helminthes Kering.....................................3
2.2 Prosedur Pemeriksaan Ektoparasit.......................................................................4
2.2.1 Pengumpulan Ektoparasit (Koleksi)............................................................4
2.2.2 Pengawetan Kering Ektoparasit...................................................................5
2.2.3 Pengawetan Basah Ektoparasit....................................................................5
2.3 Prosedur Pemeriksaan Protozoa...........................................................................6
2.3.1 Pemeriksaan Protozoa Pada Feses Metode Natif.........................................6
2.3.2 Pemeriksaan Protozoa Metode Sedimentasi................................................6
2.3.3 Pemeriksaan Protozoa Metode Apung.........................................................7
2.3.4 Teknik Pembuatan Ulas Darah Tipis Untuk Pemeriksaan Protozoa Darah.7
2.3.5 Teknik Pembuatan Ulas Darah dengan Pewarnaan Giemsa........................7
BAB 3 HASIL DAN PEMBAHASAN ...............................................................................9
3.1 Helminthes............................................................................................................9
3.1.1 Trichuris sp..................................................................................................9
3.1.2 Capillaria sp...............................................................................................11
3.2 Protozoa................................................................................................................14
3.2.1 Balantidium sp.............................................................................................14
3.2.2 Leucocytozoon sp.........................................................................................17
ii

3.3 Ektoparasit............................................................................................................20
3.3.1 Otodectes sp.................................................................................................20
3.3.2 Sarcophaga sp..............................................................................................22
BAB 4 PENUTUP.................................................................................................................25
4.1 Kesimpulan ...........................................................................................................25
DAFTAR PUSTAKA...........................................................................................................26
iii

BAB 1 PENDAHULUAN
1.1 Latar Belakang
Salah satu penyakit pada ternak yang cukup merugikan adalah penyakit parasit.
Parasit adalah suatu organisme yang hidup menempel pada tubuh organisme lain yang
disebut host. Penyakit parasit ini berbeda dengan penyakit ternak yang disebabkan oleh virus
dan bakteri, karena kerugian ekonomi yang disebabkan oleh virus dan bakteri dapat diketahui
dengan mudah melalui kematian ternak. Kerugian utama akibat penyakit parasit adalah
kekurusan, terlambatnya pertumbuhan, turunnya daya tahan tubuh terhadap penyakit lain dan
gangguan metabolisme (Sudardjat, 1991).
Sebagian besar masyarakat umumnya memelihara sapi secara tradisional.
Pemeliharaan sapi dengan sistem gembala merupakan peluang besar bagi parasit untuk
berkembang biak. Peternak kecil di Indonesia umumnya menggunakan sistem semi-intensif
dengan membiarkan ternak mencari makan sendiri bahkan ada yang sama sekali tidak
dikandangkan. Menurut Wymann (2005) parasit gastrointestinal menyebabkan penurunan
produksi ternak secara luas dan sering diabaikan sehingga dapat menyebabkan kerugian pada
hewan muda. Dalam laporan ini akan menjelaskan tentang endoparasit dan ektoparasit yang
mencakup Plasmodium, Haemoproteus columbae, Dipyllidium caninum, Bunostomum
trigonocephalum, Ctenocephalides felis dan Chrysomya bezziana.
1.2 Rumusan Masalah
1) Jenis-jenis Endoparasit dan Ektoparasit apa saja yang sering ditemukan dimasyarakat?
2) Penyakit apa saja yang disebabkan oleh Endoparasit dan Ektoparasit yang ditemukan
dimasyarakat?
1.3 Tujuan
1) Mengetahui jenis-jenis Endoparasit dan Ektoparasit apa saja yang sering ditemukan
dimasyarakat.
2) Mengetahui penyakit apa saja yang disebabkan oleh Endoparasit dan Ektoparasit yang
ditemukan dimasyarakat.
1

BAB 2 PELAKSANAN KEGIATAN
2.1 Prosedur Pemeriksaan Cacing (Helminthes)
2.1.1 Pemeriksaan Feses Metode Natif
1) Oleskan feses secukupnya pada objek glass steril dengan lidi.
2) Teteskan 1-2 tetes air pada feses tersebut, kemudian aduk dengan lidi atau buat sudut
sedikit miring pada ujung cover glass.
3) Tutup dengan cover glass.
4) Periksa di bawah mikroskop dengan pembesaran 100x
2.1.2 Pemeriksaan Feses Metode Sedimentasi
1) Membuat suspensi dengan perbandingan satu bagian feses dan 10 bagian air .
2) Saring campuran dengan saringan teh dan tampung filtrate pada gelas plastik.
3) Masukkan dalam tabung, kemudian sentrifuge dengan kecepatan 1500 rpm selama 2-
5 menit.
4) Buang supernatan (bagian jernih) lalu masukkan air kemudian lakukan sentrifuge lagi
hingga diperoleh supernatan yang jernih.
5) Buang supernatan, ambil sedimen dan oleskan pada objek glass (teteskan dengan
pipet Pasteur).
6) Tutup dengan cover glass.
7) Periksa di bawah mikroskop dengan pembesaran 100x.
2.1.3 Pemeriksaan Feses Metode Apung
1) Buat suspensi tinja dengan perbandingan 1 bagian tinja dan 10 bagian air. Saring dan
filtrat dimasukkan tabung sentrifuge.
2) Disentrifugasi selama 2-5 menit dengan kecepatan 1500 rpm.
3) Hal ini diulang beberapa kali sampai supernatan jernih, pelarut dibuang dan diganti
larutan NaCl jenuh sampai 1 cm dari mulut tabung, lalu disentrifugasi dengan cara
yang sama.
4) Letakkan tabung sentrifuge pada rak tabung dan pelan-pelan ditetesi dengan larutan
gula jenuh sampai cairan terlihat cembung pada mulut tabung sentrifuge.
2

5) Letakkan cover glass pelan-pelan di atas tabung sentrifuge, biarkan 1-2 menit,
kemudian diambil dan diletakkan di atas glas obyek, kemudian diperiksa di bawah
mikroskop
2.1.4 Pemeriksaan Saluran Pencernaan Unggas
1) Potong tiga saluran utama pada unggas yaitu, vena jugularis, esophagus, dan trakea.
2) Basahi tubuh unggas dengan air agar bulunya tidak berterbangan.
3) Kulit luar pada unggas digunting untuk dilakukan pembedahan.
4) Otot perut digunting pada linea alba, kemudian pada batas costae ke arah kanan dan
kiri.
5) Diafragma digunting didekat perlekatannya dengan costae.
6) Costae di potong pada perbatasan tulang rawan dan tulang keras.
7) Kemudian menarik saluran pencernaan dari esophagus sampai ke anus, kemudian
dipisahkan menjadi tiap-tiap organ.
8) Melakukan pembedahan pada masing-masing organ tersebut dengan menggunakan
alat-alat seksi (gunting, scalpel, dan pinset).
9) Mengeluarkan isi usus dan menyayat bagian-bagian tertentu untuk menemukan
cacing.
10) Melakukan kerokan (scraping) dengan scalpel untuk mencari kemungkinan adanya
skoleks cacing pita terutama bila terdapat keradangan atau mukosa hiperemis.
11) Cacing yang ditemukan letakkan pada objek glass dan beri PZ. Cacing yang
ukurannya kecil di buat preparat permanen (pewarnaan) yang besar dimasukkan ke
dalam formalin 10%.
12) Periksa di bawah mikroskop dengan pembesaran 40x.
13) Identifikasi cacing.
2.1.5 Pembuatan Preparat Permanen Helminthes Kering
1) Cacing difiksasi diantara dua objek glass. Kedua ujung gelas diikat dengan tali rafia.
2) Objek glass dan cacing dimasukkan ke larutan alcohol gliceryn 5% selama 24 jam.
3) Kemudian dimasukkan alcohol 70% selama 5 menit.
4) Dipindahkan ke dalam larutan karmin yang sudah diencerkan dibiarkan selama
kurang lebih 8 jam tergantung ketebalan kutikula cacing.
5) Cacing dapat dilepas dari fiksasi (objek glass) dan dimasukkan ke dalam alcohol asam
selama 2 menit.
3

6) Dipindahkan ke dalam larutan alcohol basa selama 20 menit.
7) Kemudian dilakukan dehidrasi bertingkat dengan alcohol, sebagai berikut :
a) Alkohol 70% selama 5 menit.
b) Alkohol 85% selama 5 menit.
c) Alkohol 95% selama 5 menit.
8) Mounting dengan larutan Hung's I selama 20 menit.
9) Cacing diambil dari larutan Hung's I, diletakkan pada objek glass yang bersih dan
diteteskan larutan Hung's II diatas cacing tersebut. Kemudian ditutup dengan cover
glass.
10) Preparat permanen dikeringkan dalam inkubator pada suhu 370 C, kemudian ditaruh
di suhu ruang untuk pendinginan dan siap digunakan.
2.2 Prosedur Pemeriksaan Ektoparasit
2.2.1 Pengumpulan Ektoparasit (Koleksi)
a. Pengumpulan Lalat
Pengumpulan lalat dilakukan menggunakan alat berupa jaring insek.
b. Pengumpulan Kutu
Pengumpulan kutu dilakukan dengan memeriksa bulu secara teliti.
c. Pengumpulan Pinjal
Pengumpulan pinjal dilakukan dengan memeriksa bulu secara teliti
d. Pengumpulan Tungau
Pengumpulan tungau dilakukan dengan cara berikut:
1) Kulit tersangka dikerok sampai timbul perembesan darah. Kerokan kulit dicampur
dengan formalin 5%. Untuk diwetkan dalam keadaan basah.
2) Kerokan langsung dicampur KOH 10% untuk dilihat dibawah mikroskop, 5 menit
kemudian sditutup dengan gelas penutup.
e. Pengumpulan Caplak
Pengumpulan caplak dilakukan dengan memeriksa bulu secara teliti.
2.2.2 Pengawetan Kering Ektoparasit
Pengawetan kering dilakukan dengan metode pinning. Pinning dilakukan dengan
langkah-langkah berikut:
1) Mematikan serangga dengan chloroform.
4

2) Mengembangkan sayap serangga (serangga bersayap) dan kaki agar mudah dipelajari.
3) Memegang serangga diantara ibu jari dan telunjuk tangan yang satu dan menusukkan
pin dengan tangan lainnya (pin baja).
4) Pada lalat penusukan dimulai dari thorak diantara pangkal sayap depan sedikit ke
kanan pangkal garis tengah.
5) Menyeragamkan ketinggian lalat pada pin dengan pinning blok (sterofoam).
6) Serangga kecil diletakkan diatas ujung kertas segitiga dan ditempel menggunakan
canada balsem. Pin dilakukan pada kertas tersebut.
7) Mengidentifikasi dengan loop atau stereo mikroskop.
8) Memberikan label (nama spesies/genus, predileksi/inang, nama kolektor, tanggal dan
lokasi pengambilan)
9) Mengeringkan serangga dalam oven 50-600 C selama 24 jam.
10) Memasukkan ke dalam kotak penyimpanan preparat dan diberikan kapur barus.
2.2.3 Pengawetan Basah Ektoparasit
a. Permanen Mounting Tanpa Pewarnaan
1) Serangga dimatikan dengan chloroform.
2) Memasukkan serangga kedalam tabung reaksi yang berisi KOH 10% kemudian
dipanaskan dalam air yang mendidih selama 1 jam atau sampai serangga tampak
transparan.
3) Memasukkan serangga ke dalam alkohol dengan konsentrasi berturut-turut 30, 50,
70, 95, 96% masing-masing 3 menit selanjutnya mencelupkan ke dalam xylol
dalam waktu singkat (+1 menit).
4) Meletakkan serangga pada gelas obyek dan diberikan canada balsem kemudian
ditutup dengan cover glass.
5) Mengidentifikasi di bawah mikroskop dengan perbesaran 40-100x dan diberi
label.
6) Mengeringkan preparat dengan dimasukkan ke dalam inkubator.
b. Permanen Mounting Dengan Pewarnaan
1) Serangga dimatikan dengan chloroform
2) Memasukkan serangga yang sudah mati ke dalam tabung reaksi yang berisi KOH
10% dengan ketinggian sekitar 1/3 tabung kemudian direbus selama 1 jam atau
sampai serangga tampak transparan.
3) Mencuci dengan aquadest sebanyak 2x.
5

4) Merendam serangga dalam alkohol 95% selama 10 menit.
5) Merendam dalam acid fuchsin selama 30 menit.
6) Merendam dalam alkohol 95% selama 2 menit.
7) Merendam dalam alkohol 95%+xylol sama banyak selama 5 menit.
8) Merendam dalam xylol selama 1 menit.
9) Meletakkan serangga pada obyek glass dan dberikan canada balsem kemudian
ditutup dengan cover glass.
10) Mengidentifikasi dibawah mikroskop dengan perbesaran 40-100x dan dberi label.
11) Mengeringkan dalam inkubator sampai preparat kering
2.3 Prosedur Pemeriksaan Protozoa
2.3.1. Pemeriksaan Protozoa pada Feses Dengan Metode Natif
1) Teteskan 1-2 tetes air pada objek gelas
2) Ambil sedikit feses campur dengan aquadest sampai merata
3) Tutup dengan gelas penutup dan lihat dibawah mikroskop dengan perbesaran
400x -1000x
2.3.2. Pemeriksaan Protozoa pada Feses Dengan Metode Sedimen
1) Larutkan feses dengan air sehingga didapatkan konsentrasi 10% (1 bagian feses
dengan 10 bagian air).
2) Saring larutan feses dengan saringan (kain kasa).
3) Masukkan filtrat ke dalam tabung sentrifus dan lakukan sentrifugasi 1500 rpm
selama 5-10 menit.
4) Buang supernatan dan tambahkan air dalam jumlah yang sama dan aduk sampai
homogen.
5) Ulangi sentrifugasi dengan cara yang sama dan buang supernatan.
6) Ulangi cara tersebut sampai didapatkan supernatan yang bersih.
7) Buang supernatan dan sisakan sedikit air, campur dengan baik.
8) Ambil satu tetes dengan pipet pasteur, letakkan pada objek gelas dan tutup dengan
gelas penutup.
9) Lihat di bawah mikroskop dengan pembesaran 400-1000x.
6

2.3.3. Pemeriksaan Protozoa pada Feses Dengan Metode Apung
1) Larutkan feses dengan air sehingga didapatkan konsentrasi 10% (1 bagian feses
dengan 10 bagian air).
2) Saring larutan feses dengan saringan (kain kasa).
3) Masukkan filtrat ke dalam tabung sentrifus dan lakukan sentrifugasi 1500 rpm
selama 5-10 menit.
4) Buang supernatan dan tambahkan air dalam jumlah yang sama dan aduk sampai
homogen.
5) Ulangi sentrifugasi dengan cara yang sama dan buang supernatan.
6) Ulangi cara tersebut sampai didapatkan supernatan yang bersih.
7) Buang supernatan dan tambahkan gula jenuh sampai 2/3 tabung dan campur
dengan membolak balikkan tabung.
8) Sentrifugasi dengan kecepatan yang sama dengan cara sebelumnya.
9) Letakkan tabung pada rak tabung dengan posisi tegak.
10) Tambahkan gula jenuh sampai penuh dan membentuk cembung pada permukaan
tabung.
11) Tutup dengan gelas penutup dan biarkan selama 5 menit.
12) Ambil cover glass dan letakkan pada objek glass dan dilihat dibawah mikroskop
dengan perbesaran 400x-1000x
2.3.4 Teknik Pembuatan Ulas Darah Tipis Untuk Pemeriksaan Protozoa Darah
1) Siapkan objek glass (A) dan objek glass penggulas (B) yang bersih
2) Teteskan satu tetes darah pada objek glass A (sébelah ujung)
3) Ambil objek glass pengulas (B) dan letakkan ujung objek glass tersebut pada
tetesan darah sampai semua ujung objek glass pengulas terbasahi darah
4) Apabila darah yang diteteskan terlalu banyak, pindahkan usapan
5) Buat sudut antara objek glass (A) dan gelas objek pengulas (B) 30-40°C
6) Dengan gerakan kedepan yang cepat, ulaskan darah sehinga didapatkan hasil
ulasan yang semakin lama semakin tipis
Catatan: pada saat mengulas tidak diperbolehkan berhenti ditengah ulasan dan darah
habis sebelum ujung objek gelas
7) Keringkan hasil ulasan pada suhu kamar sehingga benar-benar kering
7

2.3.5. Teknik Pembuatan Ulas Darah dengan Pewarnaan Giemsa
1) Ulas darah tipis yang sudah kering dilanjutkan fiksasi dengan methanol (methil
alkohol absolut selama tiga menit)
2) Tanpa dikeringkan masukkan objek glass pada larutan giemsa 10-20% selama 30
menit
3) Untuk usapan darah tebal langsung dimasukkan kedalam pewarna giemsa tanpa
dilakukan fiksasi dengan methanol absolut.
4) Setelah 30 menit, ambil objek glass dan cuci dengan air mengalir (air keran)
dengan pelan-pelan sampai zat warna yang tersisa yang menempel hilang. Tidak
diperbolehkan menggosok hasil usapan darah
5) Pada pencucian hasil ulas darah tebal tidak diperbolehkan pada air mengalir
6) Keringkan objek glass dengan cara meletakkan objek glass posisi berdiri pada
bidang pengering pada suhu kamar. Pengeringan dapat dipercepat dengan kipas
angin
7) Periksa dibawah mikroskop dengan pembesaran 400x-1000x
8) Untuk pembesaran 1000x digunakan oil emersi
8

BAB 3 HASIL DAN PEMBAHASAN
3.1 Helmintologi
3.1.1 Trichuris sp.
Signlement:
Jenis Hewan : Unta
Anamnesa
Nafsu turun
Pakan hijauan
Lesu
Sampel yang diambil berupa feses unta yang berbentuk padat dengan konsistensi yang
lembek menunjukkan bahwa tinja unta dalam keadaan normal atau tidak dalam kondisi diare.
Hal ini juga menunjukkan bahwa unta tidak menunjukkan gejala klinis yang ditimbulkan oleh
infeksi cacing parasitik.
Gambar 1. Telur Trichuris sp pada feses unta (sedimen, perbesaran 400×)
Gambar 2. Bentuk telur Trichuris ovis (RVC, 2006)
9

Klasifikasi ilmiah dari Trichuris sp. sebagai berikut:
Kingdom : Animalia
Phylum : Nematoda
Class : Adenophorea
Order : Trichurida
Family : Trichuridae
Genus : Trichuris
Trichuris spp merupakan nematoda yang berbentuk seperti cambuk, salah satu
ujungnya tebal dan ujung lainnya panjang dan tipis. Cacing ini mempunyai siklus hidup
secara langsung. Telur nematoda akan berkembang di tanah hingga mengandung larva
stadium 3. Telur infektif (berisi larva stadium ke 3) sangat resisten di lingkungan dan dapat
bertahan beberapa bulan atau tahun. Telur infektif yang masuk ke dalam tubuh hewan akan
menetas di duodenum. Larva cacing akan berkembang di dalam vili-vili duodenum. Setelah
dewasa, Trichuris akan menuju ke kolon. Cacing ini bersifat soil borne desease atau
penularannya berasal dari tanah yang tercemar oleh telur infektif (Olsen 1974).
Gejala klinis yang terjadi akibat Trichuris infeksi ringan tidak menimbulkan gejala
klinis tetapi jika infeksinya berat dapat menyebabkan gejala klinis, misalnya lemas, diare,
diare disertai dengan tenesmus serta nafsu makan menurun kehilangan berat badan, feses
yang berbusa dan mengandung lendir.
Ciri-ciri telur jenis Trichuris menurut literatur (FAO 2006, Levine 1977 dan Taylor et
al 2007) yaitu mempunyai dinding yang tebal, berbentuk oval, tidak memiliki blastomer,
mempunyai dua polar plug pada kedua ujung serta memiliki ukuran panjang 70- 80 μm dan
lebar 30-42 μm. Hal ini menunjukkan bahwa telur cacing parasitik yang ditemukan adalah
dari genus Trichuris spp. Beberapa spesies dari Trichuris adalah Trichuris ovis pada caecum
kambing dan domba, Trichuris discolor pada caecum dari sapi, Trichuris vulvis pada anjing,
Trichuris suis pada babi, Trichuris trichiura pada manusia
Trichuriasis dapat diobati dengan anthelmintics, termasuk fenbendazole, febantel,
mebendazol, dichlorvos, thiabendazole dan butamisole (Frechette, 1973). Mebendazol,
mekanisme kerjanya yaitu menyebabkan kerusakan struktur subseluler, menghambat sekresi
enzim asetilkolinesterase, menghambat intake glukosa.
10

3.1.2 Capillaria sp
Sinyalemen hewan
Jenis hewan : Ayam
Ras : kampung
Jenis kelamin : -
Umur/BB : +- 1 tahun/1.5 kg
Anamnesa
Diperoleh dari pasar hewan di Surabaya
Pemeriksaan fisik
Anemia, bulu banyak rontok, tidak diare
Diagnosa sementara
Helminthiasis
Suspect protozoa darah
Gambar 3. Telur Capillaria sp pada feses ayam ras (ketawa) (metode apung)
Gambar 4. Bentuk telur Capillaria obsignata barrel-shaped dengan clear plugs pada setiap
ujungnya (RVC, 2006).
11

Klasifikasi ilmiah dari Capillaria sp.
Kingdom : Animalia
Phylum : Nematoda
Class : Adenophorea
Subclass : Enoplia
Order : Trichocephalida
Family : Capillariidae
Genus : Capillaria
Cacing Capillaria spp. mirip seperti rambut dapat ditemukan eksudat catarrhal dari
duodenum unggas. Cacing jantan memiliki panjang 7,8-10,6 mm (rata-rata 8,93 mm) dan
lebar 36,9-53,9 µm (rata-rata 47,4 µm). Cacing betina memiliki panjang 10,1-12,6 mm (rata-
rata 11,4 mm) dan 73.1- 85.4 µm (rata-rata 80,6 µm). Capillaria betina mudah untuk
diidentifikasi ketika terdapat telur di dalam uterus cacing yang berbentuk barrel-shaped yang
tersusun dengan plug-like structure. Tubuh cacing ini berbentuk silinder kecil dengan besar
yang sama dari anterior sampai posterior. Telur Capillaria berdinding tebal, kedua sisinya
datar dan pada ujung anterior sampai posterior terdapat operkulum (selaput penutup). Telur
capillaria berukuran: 46.1- 53.9 dan 28,3-33,1 µm (rata-rata 49,6 × 30,5 µm), yang berbentuk
barrel-shaped dan setiap ujungnya memiliki plug yang bening, dan memiliki pola retikular
pada permukaan kulit.
Beberapa spesies Capillaria (misalnya Capillaria anatis, Capillaria obsignata)
memiliki siklus hidup langsung, yaitu tidak melibatkan host perantara. Telur berkembang
menjadi larva dalam tinja dan menjadi infektif dalam 7-50 hari, tergantung pada spesies, suhu
dan kelembaban. Penularan pada unggas terjadi karena menelan telur infektif ini melalui
makanan atau air yang terkontaminasi. Telur ini dapat tetap infektif di lingkungan selama
berbulan-bulan dan dapat bertahan pada suhu dingin.
Spesies lain (misalnya Capillaria annulata, Capillaria bursata, Capillaria
caudinflata) memiliki berbagai spesies cacing tanah (Lumbricus misalnya, Eisenia, dll)
sebagai obligat host intermediate. Cacing tanah ini menelan telur, dan telur menjadi larva di
dalam cacing. Larva ini menjadi infektif dalam 2 sampai 4 minggu. Di dalam cacing tanah
larva infektif dapat bertahan hidup selama bertahun-tahun.
Setelah berada di host terakhir, larva infektif mencapai tempat predileksinya. Larva
beberapa spesies menembus ke dinding usus dan menghabiskan bagian dari perkembangan
mereka di sana, sebelum kembali lumen usus di mana mereka berkembang lengkap menjadi
12

cacing dewasa dan bereproduksi. Larva dari spesies lain tidak menembus dinding usus, tetapi
menyelesaikan seluruh pembangunan mereka menjadi dewasa di lumen usus tersebut.
Cacing ini dapat merusak lapisan tembolok dan esofagus pada ayam berumur diatas 4
bulan. Lapisan tembolok dan esofagus mengalami peradangan, menyebabkan unggas yang
mengalami infeksi ini sulit untuk menelan makanan. Cacing yang berada dalam usus dapat
merusak vili bahkan masuk ke kelenjar usus, dan dengan kasus infeksi berat dapat
menyebabkan enteritis dan fibrosis.
Tanda-tanda klinis yang dominan, terutama pada unggas muda adalah diare (lendir
atau bahkan cair), anemia, apatis, bulu rontok, kehilangan nafsu makan dan berat badan,
mengurangi produksi telur pada ayam layer. Diagnosis didasarkan pada deteksi khas telur
dalam tinja dan / atau identifikasi cacing di tempat predileksi cacing setelah nekropsi. Untuk
pencegahan atau mengurangi infeksi Capillaria dianjurkan untuk menjaga kandang tetap
kering dan sering mengganti litter, karena perkembangan telur cacing membutuhkan
kelembaban.
Banyak anthelmintics spektrum luas yang efektif terhadap cacing Capillaria,
misalnya beberapa Benzimidazole (albendazole, fenbendazole, flubendazole, mebendazole,
oxfendazole, dll), levamisol, serta lakton makrosiklik (misalnya ivermectin). Beberapa
senyawa dengan spektrum sempit juga efektif terhadap cacing ini, misalnya derivatif
piperazine dan pirantel. Kebanyakan anthelmintics, membunuh cacing segera setelah
pengobatan dan dengan cepat dimetabolisme atau dikeluarkan dalam beberapa jam atau hari.
Hal ini berarti bahwa mereka memiliki efek residu pendek, atau tidak ada efek residu sama
sekali. Akibatnya hewan sembuh dari cacing tetapi tidak dilindungi terhadap infeksi baru.
Untuk memastikan bahwa mereka tetap cacing-bebas hewan harus dilakukan pengobatan
cacing secara berkala, tergantung pada epidemiologi lokal, ekologi dan kondisi iklim.
13

3.2 Protozoa
3.2.1 Balantidium sp
Sinyalemen hewan
Jenis hewan : Kambing
Ras : Boer
Jenis kelamin : betina
Anamnesa
Diperoleh dari peternakan kambing di daerah batu
Pemeriksaan fisik
diare
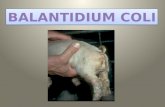
Gambar 5. Balantidium sp.
Gambar 6. Balantidium coli (Stanford, 2006)
Menurut Levine (1985) Balantidium diklasifikasi sebagai berikut:
Filum : Ciliophora
Kelas : Kinetofragminophorasida
Ordo : Trichostomatorida
Famili : Balantidiidae
Genus : Balantidium
14

Berpredileksi didalam sekum dan kolon babi (sangat umum dan kebanyakan tidak
pathogen kecuali diikuti oleh penyebab lainnya baru akan ikut memperparah (Predisposisi),
pathogen pada (manusia, kera dan monyet, dan jarang pada anjing.
Morfologi B. coli memiliki bentuk trofozoit dan kista. Bentuk trofozoitnya memiliki
karakteristik sebagai berikut: bentuk oval, panjang 30-100 µm, lebar 30-80 µm, seluruh
permukaan tubuh ditumbuhi rambut (cilia), terdapat cytostome (mulut sel) pada bagian
anterior yang menyempit dan cytopyge (alat pembuangan) pada bagian posterior, memiliki
dua buah inti, makronukleus berbentuk seperti ginjal dan mikro-nukleus berbentuk bulat,
keduanya berdekatan, terdapat vakuola kontraktil pada sitoplasma. Bentuk kistanya memiliki
morfologi sebagai berikut: bentuk bulat hingga elips dengan ukuran 45-65 µm, dinding dua
lapis, di antara keduanya terdapat cilia, namun dapat meng-hilang pada kista yang matang,
memiliki makro dan mikronukleus, terdapat vakuola. Parasit menyerang babi dan golongan
primate tinggi termasuk manusia. Habitat parasit dalam induk semang di lumen kolon. Induk
semang tertular parasit karena menelan bentuk kista yang mencemari makanan atau
minuman.
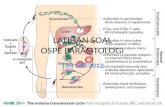
Gambar 7. Siklus hidup dari Balantidium (Stanford, 2006)
Siklus hidup Balantidium sebenarnya hampir sama dengan E. Histolytica, tetapi pada
Balantidium kista tidak dapat membelah diri. Kista akan termakan bersama dengan makanan
atau minuman yang masuk ke dalam tubuh, lalu akan terjadi ekskistasi di dalam usus halus
dan menjadi bentuk trofozoit, lalu menuju ke caecum. Setelah berada di caecum trofozoit
15

akan berbiak dan membelah diri secara belah pasang tranversal. Selain itu bentuk trofozoit ini
akan terbawa oleh aliran isi usus. Di daerah colon keadaan kurang menguntungkan bagi
trofozoit sehingga akan terjadi enkistasi. Trofozoit akan berubah menjadi kista lalu kista
tersebut akan keluar bersama dengan tinja.
Reproduksi Balantidium bentuk vegetatif selain bentuk yang masih makan, juga
merupakan bentuk yang berfungsi untuk berkembangbiak dengan cara belah transversal.
Mula – mula mikronukleus yang membelah diikuti oleh makronukleus dan sitoplasma
sehingga menjadi dua organisme yang baru. Kadang – kadang tampak pertukaran kromatin
(konjugasi). Reproduksi berlangsung seksual dan aseksual.
Perkembang biakan secara aseksual yaitu dengan belah pasang, yaitu dengan
membelah jadi dua parasit yang sama bentuknya. Hanya terjadi bila situasi kurang
menguntungkan. Misalnya tidak ada pejantan.
Perkembangbiakan secara seksual terjadi pada pembiakan ini dibentuk sel kelamin,
yaitu makrogametosit dan mikrogametosit yang kemudian membelah membentuk
makrogamet dan mikrogamet. Setelah pembuahan menjadi zigot. Inti zigot membelah
menjadi banyak yang disebut sporozoit. Proses ini disebut sporogoni.
Balantidium ini paling sering ditemukan di daerah sanitasi yang buruk serta daerah di
mana orang-orang kontak dengan babi, domba, kambing dan karena penyakit ini biasanya
ditularkan melalui air atau makanan yang terkontaminasi dengan kotoran hewan. Infeksi
biasanya tanpa gejala, namun, orang-orang yang infeksinya lebih lama akan muncul gejala-
gejala seperti diare (berair, berdarah, berlendir), mual, muntah, sakit perut, anoreksia, sakit
kepala, penurunan berat badan. Ada tiga jenis manifestasi infeksi Balantidium coli: ekskresi
kista asimtomatik, infeksi kronis dengan berulang episode nyeri perut dan diare berdarah
mungkin, kolitis akut dengan mual, muntah, sakit perut, dan diare parah hingga berdarah.
Pengobatan yang dilakukan dengan pemberian tetrasiklin, metronidazol. Tetrasiklin
mencegah pertumbuhan parasit melalui penghambatan sintesis protein. Dosis 500 mg PO qid
selama 10 hari untuk orang dewasa. Metronidazole bertindak terutama terhadap bentuk
trofozoit. Selama perawatan, penggantian cairan dan elektrolit tubuh perlu dilakukkan pada
pasien dengan diare berat.
16

3.2.2 Leucocytozoon
Sinyalemen hewan
Jenis hewan : Ayam
Ras : kampung
Jenis kelamin : -
Umur/BB : +- 1 tahun/1.5 kg
Anamnesa
Diperoleh dari pasar hewan di Surabaya
Pemeriksaan fisik
Anemia,
Gambar 8. Leucocytozoon sp.
Klasifikasi dari Leucocytozoon sp adalah sebagai berikut (Levine, 1985):
Filum : Apicomplexa
Kelas : Sporozoasida
Subkelas : Coccidiasina
Ordo : Eucoccidiorida
Sub ordo : Haemospororina
Famili : Plasmodiidae
Genus : Leucocytozoon
Morfologi pada inang definitif fase gametosit Leucocytozoon yang terlihat pada hasil
ulas darah perifer merupakan cara yang dilakukan untuk membedakan dan melakukan
identifikasi spesies Leucocytozoon. Penyakit ini menyerang beberapa jenis unggas antara
17

lain: itik dan angsa oleh Leucocytozoon neavei, Leucocytozoon numidae, Leucocytozoon
costai dan Leucocytozoon simondi; kalkun oleh Leucocytozoon smithi; ayam oleh
Leucocytozoon cauleryi, Leucocytozoon andrewsi; Leucocytozoon schoutedeni dan
Leucocytozoon Sabrasezi. Umumnya Leucocytozoon menghasilkan gametosit dalam 2 tipe
yang berbeda yaitu parasit yang tampak mengelilingi lingkaran sel darah dengan nukleus
yang terdorong ke sisi sehingga tampak terjepit dan mengecil, serta parasit yang dengan
penampakan berbentuk lingkaran, oval, ataupun elips dengan sitoplasma mengalami
perpanjangan yang merupakan perkembangan dari parasit. Namun terdapat perbedaan
morfologi pada spesies L. caulleryi yang menginfeksi ayam, gametosit pada spesies ini
berbentuk melingkar dan nukleus sel terdorong keluar dengan sedikit perubahan bentuk dan
terkadang terdorong keluar dari sel darah.
Siklus hidup Leucocytozoon terdiri dari 2 siklus yaitu siklus aseksual dan siklus
seksual. Siklus aseksual terjadi pada inang seperti ayam, bebek, atau unggas lainnya.
Sedangkan siklus seksual terjadi pada vektor yaitu Cullicidae dan Simulidae (Tampubolon
1992). Perkembangan parasit aseksual terjadi ketika masuknya sporozoit dari gigitan vektor
Simulidae atau Cullicidae pada unggas. Sporozoit yang masuk melalui luka gigitan vektor
akan masuk ke dalam sel jaringan dan berkembang dalam fase aseksual yang disebut skizon.
Skizogoni merupakan fase terbentuknya ribuan merozoit. Fase skizogoni terjadi di dalam sel
parenkim hati, sel epitel ginjal, dan sel retikuloendotel tubuh seperti ginjal dan kelenjar limfe.
Terdapat perbedaan proses skizogoni pada tiap-tiap spesies parasit, namun umumnya
skizogoni terjadi pada sel parenkim hati (Fallis dan Desser 1977).
Merozoit terbentuk setelah 4 hari pasca-infeksi yang dimulai dari pembelahan inti
secara berulang pada skizon. Skizon dengan pembelahan inti yang berulang akan mengalami
invaginasi sitoplasma dan membentuk sitomer dengan banyak inti, lalu pembelahan inti dan
sitoplasma akan dilanjutkan hingga sitomer dan dihasilkan ribuan merozoit tak berinti sebesar
1 mikron. Beberapa spesies, skizon dapat mengalami ruptur sebelum terjadinya pembentukan
merozoit secara lengkap. Ruptur dari skizon dengan beberapa inti pada sitomer disebut
dengan sinsitia. Hal ini juga menunjukan bahwa parasit kurang beradaptasi pada tubuh inang.
Merozoit yang keluar dari skizon akan masuk ke dalam aliran darah, dan masuk ke
dalam eritrosit dan eritroblas, serta mengalami perubahan menjadi gametosit. Umumnya
proses pematangan merozoit menjadi gametosit akan terjadi selama 48 jam.
Proses seksual terjadi setelah masuknya gametosit pada tubuh vector melalui hisapan
nyamuk atau lalat dari darah unggas yang terinfeksi Leucocytozoon. Awal dari fase seksual
yaitu terbentuknya gametosit jantan dan betina yang disebut juga fase gametogoni.
18

Pembentukan makrogametosit dan mikrogametosit terjadi di saluran pencernaan vektor dan
lebih distimulasi oleh perubahan kadar oksigen dan karbondioksida dibandingkan perubahan
temperature pada saat perpindahan parasit dari unggas ke tubuh vektor. Proses pendewasaan
gametosit terjadi setelah parasit keluar dari darah dan distimulasi oleh lepasnya membran sel
darah merah unggas. Proses pendewasaan pada mikrogamet terjadi ketika inti sel mengalami
kondensasi dan berubah menjadi massa yang lebih padat. Proses tersebut mengawali
pembentukan flagella yang merupakan alat gerak untuk menuju makrogamet.
Zigot terbentuk setelah proses fertilisasi antara makrogamet dan mikrogamet
berflagella dan dalam beberapa jam berubah bentuk menjadi ookinet motil dengan ukuran
mencapai 30 mikron. Ookinet melakukan migrasi menembus dinding saluran cerna untuk
menghindari proses pencernaan darah pada saluran cerna vektor. Ookinet yang tidak dapat
menembus dinding saluran cerna akan mengalami ruptur 3-4 hari sesudahnya. Ookinet yang
mampu menembus dinding usus vektor, akan mematangkan diri menjadi ookista dan
melakukan migrasi ke saluran air liur (Fallis dan Desser 1977).
Penyakit ini menimbulkan kerugian yang sangat tinggi, pada unggas muda
menyebabkan kematian yang tiba-tiba. Unggas dewasa juga bisa terinfeksi dengan
menimbulkan gejala diare, lemah, penurunan produksi, penurunan daya tetas telur, bahkan
bisa menimbulkan kematian. Kejadian penyakit pada suatu daerah bisa berbeda tergantung
letak geografis, temperature dan kelembaban yang tinggi memungkinkan perkembangan yang
pesat dari vektor penyakit ini, juga cara pemeliharaan yang memungkinkan banyak
kesempatan vektor berkontak dengan unggas (Marquerita et al.,1992). Jumlah vektor yang
membawa bentuk sporozoit di suatu daerah sangat mempengaruhi prevalensi penyakit di
daerah tersebut (Ririen, 2004).
Leucocytozoonosis dikendalikan dengan membatasi kontak langsung antara
intermediate host dengan unggas. Pengobatan dapat dilakukan dengan pemberian
Sulfonamid. Sulfonamid berkerja dengan cara menghambat asam folat sehingga pertumbuhan
schizon ditekan dan infeksi terhenti.
19

3.3 Ektoparasit
3.3.1 Otodectes sp.
Signalement
Jenis hewan : kucing (Black bruno)
Jenis kelamin : Jantan
Umur : 1 tahun 3 bulan
Berat badan : 4,3 kg
Anamnesa
- Keluar cairan daari dalam telinga
- Kucing menggaruk garuk telinga
- Makan minum normal
Gejala
- Adanya eksudat yang berlebihan berwarna coklat yang lembek pada bagian pinnea
- Tidak ada bau tidak sedap atau kelainan telinga
Pemeriksaan
- Pemeriksaan mikrioskopis
Gambar
Klasifikasi dari Otodectes sp. sebagai berikut:
Filum : Arthropoda
Kelas : Arachinida
Ordo : Acariformes
Subordo : Astigmata
Famili : Psoroptidae
Genus : Otodectes
20

Otodectes sp. memiliki ukuran tubuh yang kecil, pajang larvanya 138-224 μm, tungau
jantan dewasa panjangnya 274-362 μm, sedangkan tungau betina dewasa memiliki panjang
345-451 μm. Tungau betina relative lebih besar, bulat, jernih putih kecoklatan. Kaki kaki
tungau betina ini panjangnya melebihi batas tubuhnya, kecuali kaki ke-4 yng mengecil, atau
rudimenter. Pasangan kaki ke-1 dan ke-2 mempunyai sucker sedangkan pasangan kaki ke-3
dan ke-4 tidak. Tungau jantan ukurannya lebih kecil, keempat pasang kaki tungau jantan
panjang dan semuanya mempunyai sucker (AAVP, 2014).
Seluruh siklus hidup tungau telinga Otodectes cynotis, mulai dari telur hingga dewasa
memerlukan waktu sekitar 21 hari. Siklus tersebut melaui beberapa tahap dan mengalami
perubahan bentuk. Pada tahap pertama, setelah dewasa tungau betina biasanya bertelur setiap
hari. Setiap hari rata-rata menghasilkan 5 butir telur. Telur-telur tersebut diletakan di saluran
telinga kucing. Setelah 4 hari telur tersebut menetas menjadi larva. Pada tahap kedua, setelah
menetas, larva tungau hidup dan makan selama 4 hari kemudian beristirahat selama 24 jam.
Selama masa istirahat tersebut terjadi pergantian kulit (molting) menuju tahap berikutnya.
Pada tahap ketiga (nimfa), tahap ini bentuk tungau sudah seperti bentuk dewasanya. Bentuk
nimfa ini terdiri dari dua fase yaitu protonimfa dan deutonimfa. Masing-masing fase nimfa
makan selama 3-5 hari, istirahat, kemudian molting menuju tahap berikutnya. Tahap keempat
(tungau dewasa), Tungau dewasa berukuran + 0.4 mm, berwarna putih-krem atau kecoklatan
dan dapat diihat oleh mata telanjang. atau kaca pembesar. Tungau telinga hidup dengan
memakan sekresi telinga dan jaringan kulit saluran telinga yang mengelupas. Tungau dewasa
dapat hidup dan mencapai umur 2 bulan. Tidak seperti demodex dan scabies, tungau telinga
tidak membuat lubang di tubuh induk semangnya. Dalam satu saluran telinga bisa terdapat
ribuan tungau dan dapat menular melalui kontak langsung (AAVP,2014).
Transmisi terjadi lewat kontak langsung dan dari inang betina menginfeksi anaknya.
O. cynotis hidup pada telinga eksternal inangnya, namun pada infestasi berat juga dapat
ditemukan pada ekor, punggung, dan kepala. Semua kucing dan anjing kemungkinan
terinfeksi tungau ini dalam populasi kecil dan jarang menyebabkan masalah. O. cynotis tidak
membentuk liang pada kulit, tapi menusuk terus menerus yang menyebabkan iritasi berat.
Infestasi pada inang biasanya terjadi bilateral. Hewan yang terinfeksi memiliki warna
keabuan di dalam kanal telinga, pembentukan kerak, dan gatal hebat yang menyebabkan
hewan terinfeksi menggaruk dan menggelengkan kepala sehingga menyebabkan
pembentukan haematoma. Diagnosis infestasi O. cynotis dapat dilakukan dengan
pengambilan debris telinga menggunakan cotton swab yang dilanjutkan dengan pengamatan
21

di bawah mikroskop, serta melalui eksaminasi telinga yang terinfeksi menggunakan otoscope
(Fachri, 2013).
3.2.2 Sarcophaga sp
Gambar. Sarcophaga
Klasifikasi Sarcophaga sp adalah sebagai berikut:
Phylum : Arthropoda
Class : Hexapoda
Ordo : Diptera
Family : Sarcophagidae
Genus : Sarcophaga
Lalat ini termasuk ke dalam famili Sarcophagidae. Lalat ini berwarna abu-abu tua,
berukuran sedang sampai besar, kira-kira 6-14 mm panjangnya. Lalat ini mempunyai tiga
garis gelap pada bagian dorsal toraks, dan perutnya mempunyai corak seperti papan catur.
Lalat ini bersifat viviparus dan mengeluarkan larva hidup pada tempat perkembangbiakannya
seperti daging, bangkai, kotoran dan sayur sayuran yang sedang membusuk. Tahap larva
makan berlangsung beberapa hari, kemudian keluar dari tempat makanya untuk populasi di
daerah yang lebih kering. Lalat ini umum ditemukan di pasar dan warung terbuka, pada
daging, sampah dan kotoran, tetapi jarang memasuki rumah. Lalat ini juga dilaporkan
22

lambungnya mengandung telur cacing ascaris lumbricoides (cacing gilig) dan cacing cambuk
(Trichuris trichuira).
Gambar. Siklus hidup lalat
Sarcophaga mengalami metamorphosis lengkap melalui empat tahap perkembangan:
telur, larva, pupa, dan dewasa. Siklus hidup lengkap membutuhkan waktu sekitar 23 hari di
bawah kondisi laboratorium dari larva instar 1 sampai dewasa (Madubunyi 1986). Seperti
sarcophagids lainnya, lalat betina bereproduksi dengan melakukkan larviposition, dimana
telur menetas dalam tubuh betina dan kemudian disimpan sebagai Maggots yang diletakkan
pada daging busuk atau kotoran (Byrd dan Castner, 2001).
Instar 1 atau magogts, berukuran panjang 2 mm, berwarna puti, tidak bermata dan
sangat aktif dan ganas terhadap makanan. Setelah 1-4 hari melepas kulit dan keluar menjadi
instar 2, ukuran besarnya 2 kali dari instar 1, setelah sampai beberapa hari maka kulit akan
mengelupas dan keluar instar 3.
Instar 3 adalah larva berukuran 12 mm atau lebih, rata-rata, instar 3 selesai dalam 5-6
hari sebelum mereka menjadi kepompong (pupating) (Smith dan Whitman 1992). Larva lebih
suka lingkungan yang lembab dan bahkan dapat bertahan hidup dalam kondisi semi-akuatik
(Byrd 1998-2011). Dalam perkembangan larva juga dapat terjadi perbedaan, karena larva
tersebut sangat dipengaruhi oleh suhu, dengan suhu yang lebih tinggi umumnya mempercepat
perkembangan larva, terutama selama instar 3.
Pupa berkembang lebih cepat pada suhu dingin dengan panjang rata-rata 12 mm
(Byrd dan Butler, 1998) dan tahap menjadi pupa dapat memakan waktu sekitar 16 hari (Smith
23

dan Whitman 1992). Eclosion (proses penetasan) menjadi dewasa pada S. haemorrhoidalis
terjadi dipagi hari dan tidak melakukkan eclosion selama malam hari (Madubunyi 1986).
Dalam waktu 2-9 hari setelah dewasa muncul dari pupa, lalat melakukkan kopulasi.
Lalat jantan tidak memiliki kemampuan khusus untuk mengidentifikasi betina dari spesies
yang sama. Setelah inseminasi, telur dipertahankan oleh betina dan membutuhkan inkubasi
minimum 9 hari dengan rata-rata 13 hari sebelum larviposition terjadi (Madubunyi 1986).
Lalat betina dapat meletakkan 40 sampai 80 larva instar pertama per siklus reproduksi
(Braverman et al., 1994). Umur lalat dewasa dapat mencapai 2-4 minggu. Lalat daging
(Sarcophaga) dapat menularkan Myasis kulit, hidung, jaringan, vagina dan usus
Tindakan pengendalian lalat dapat dilakukan sebagai berikut: perbaikan Higiene dan
Sanitasi Lingkungan, mengurangi sumber yang menarik lalat, menghindari kontak langsung
lalat dengan sumberkontaminasi. Pemberantasan lalat secara langsung dan mengggunakan
Cara kimia: pemberantasan lalat dengan insektisida.
24

BAB 4 PENUTUP
4.1 Kesimpulan
Hasil identifikasi baik endoparasit maupun ektoparasit selama koasistensi di
Laboratorium Parasitologi, sebagai berikut :
1. Helminthes
a. Spesimen : Unta
Sampel : Feses
Hasil : Trichuris sp (nematoda)
b. Spesimen : Ayam
Sampel : Saluran pencernaan
Hasil : Capillaria sp (Nematoda)
2. Protozoa
a. Spesimen : Kambing
Sampel : Feses
Hasil : Balantidium sp
b. Spesimen : Ayam
Sampel : Darah
Hasil : Leucocytozoon sp.
3. Arthropoda
a. Spesimen : Kucing
Sampel : Tungau
Hasil : Otodectes sp
b. Spesimen : -
Sampel : Lalat
Hasil : Sarcophaga sp
25

DAFTAR PUSTAKA
[AAVP] American Association of Veterinary Parasitologists. 2014. Otodectes cynotis. http://www.aavp.org/wiki/arthropods/arachnids/astigmata/otodectes-cynotis/. [20 November 2014]
Park SI, Shin SS. 2010. Concurrent Capillaria and Heterakis Infections in Zoo Rock Partridges, Alectoris graeca. Case report. Korean J Parasitol. Vol. 48, No. 3: 253-257
[RVC] Royal Veterinary College. 2006. Guide to Veterinary Diagnostic Parasitology. http://www.rvc.ac.uk/Review/Parasitology/RuminantEggs/Trichuris.htm [19 November 2014]
[RVC] Royal Veterinary College. 2006. Guide to Veterinary Diagnostic Parasitology. http://www.rvc.ac.uk/Review/Parasitology/poultrEggs/capillaria.htm [19 November 2014]
Stanford. 2006. Balantidiasis. https://web.stanford.edu/class/humbio103/ParaSites2006/ Balantidiasis/Index.html. [19 November 2014]
Tampubolon, M.P. 2004. Protozologi. Bogor : Pusat Studi Ilmu Hayati Institut Pertanian Bogor.
Zajac. A. M. 2012. Veterinary Clinical Parasitology. Iowa State College Press.
26