Biolis Kel 1
-
Upload
arieanti-ulfa -
Category
Documents
-
view
110 -
download
3
Transcript of Biolis Kel 1
Moles dan AmpereSalah satu aspek dari pembelajaran bioelectricity adalah memberikan daya tarik tersendiri karena dapat dikembangkan secara mandiri berdasarkan konvensi yang dimiliki, terminology, unit dan kultural. Pada bagian ini akan menjelaskan mengenai perpindahan ion yang dideskripsikan perpindahannya berdasarkan dua perbedaan.Ketika gerakan ion dijelaskan dari perspektif ilmu kimia, jumlah ion secara alami dinyatakan dalam mol. satu mol hanyalah sejumlah bahan murni dalam gram yang secara numerik sama dengan berat atomnya. Sehingga, satu mol mencakup sejumlah ketetapan molekul, yaitu bilangan Avogadro sebesar 6.0225 x 1023 molekul. Arus ini kemudian dijelaskan dalam satuan mol per detik, dan fluks dalam satuan mol per detik per satuan luas. Fluks tersebut, dihitung dari segi jumlah mol, dilambangkan dengan huruf j.Ketika gerakan ion dijelaskan dalam perspektif electricity, jumlah ions dinyatakan dalam satuan Coulomb. Besarnya muatan pada satu elektron (dalam satu ion sama dengan satu valensi yang sama) adalah 1.6 x 10-19Coulombs. Kemudian, arus dideskripsikan Coulomb per detik atau Ampere. Sehingga fluks (aliran per satuan luas) dalam satuan ampere per satuan luas, misalnya, Ampere per cm2. Ketika dinyatakan dalam perpindahan muatan listrik, dilambangkan oleh huruf J.Ada hal yang sangat penting untuk diketahui untuk contoh dari perpindahan ion, pada fenomena fisis tunggal, dapat digambarkan pada salah satu dari dua cara sebagai aliran partikel atau sebagai arus listrik. Nilai-nilai numerik aliran akan berbeda (dengan unit yang berbeda) tergantung pada cara yang dipilih, misalnya, Mole per detik dibandingkan dengan Ampere.Suatu konversi dari unit perpindahan partikel sangat diperlukan untuk menentukan suatu nilai arus listrik. Konversi tersebut adalah Faradays Constant, F.
Ionic CompositionDari sudut pandang arus listrik, ion sodium (Na+) dan potassium (K+) merupakan ion yang sangat berpengaruh. Sedangkan Kalsium (Ca+) dan klorida (Cl-) juga berperan penting dalam beberapa kondisi, seperti halnya dengan ion yang lain.Sebagai contoh dari konsentrasi ion, nilai literatur untuk otot katak dan saraf axon cumi yang ditampilkan pada tabel 3.1. Terdapat variasi besaran konsentrasi dari ion-ion yang ada dan perbandingan intraseluler terhadap ekstraseluler. Perlu diketahui bahwa ada perbedaan yang sangat besar, meskipun kecenderungan konsentrasi rata-rata dari difusi. Konsentrasi ion dalam volume intraseluler atau ekstraseluler memungkinkan adanya arus yang signifikan mengalir di kedua tempat itu.konsentrasi antara volume intraseluler dan ekstraseluler sangat penting untuk sel excitable. Untuk semua sel excitable, konsentrasi kalium pada intraseluler lebih besar dibandingkan kalium pada ekstraseluler. Seperti halnya dalam tabel 3.1 antara otot katak dan saraf axon, meskipun konsentrasi nilai sangat berbeda ( rasio relative dari intracellular ke extracellular K+,Na+, dan Cl- pada table 3.1 adalah serupa dengan sel exitable otot dan saraf yang ditemukan pada umumnya)
Berbeda dengan K+, konsentrasi Na+ dan konsentrasi Cl- extracellular jauh lebih besar dari konsentrasi Na+ intracellular dan Cl-. Perbedaan rasio konsentrasi dari intracellular ke extracellular untuk ion K+ dan Na+ sangat penting untuk menentukan besarnya tegangan transmembran dan perubahan yang terjadi di dalamnya
(Ardika, 080810342)
Persamaan Nerst-PlanchPersamaan Nerst-Planch adalah suatu aliran ion dari dari tempat yang berbeda didalam konsentrasi atau potensial listrik. Ini sangat berguna untuk awal efek pemisahan.
Difusi dan Difusi Koefisiensi
Jika memasukan cairan tinta biru kedalam gelas kimia yang berisi air. Lalu cairan molekul akan sama bergerak menjauhi dari area konsentrasi tinggi kedalam mengelilingi air. Proses ini akan berkelanjutan sampai cairan tinta biru distribusi seragam dengan air. Proses ini dikenal dengan difusi timbul karena ada energy panas pada molekul. Pertama ketebalan konsentrasi warna dimasukan disekeliling dari konsentrasi yang akan berubah warna tersebut sangat rendah. Kosekuensinya jaringan mengalir dari pusat keluar. Kita biasanya menyebutnya difusi adalah yang mengatur perpotongan konsentrasi. Aliran ini mengambil tempat dibawah gradient konsentrasi.Tidak ada medan listrik yang memerlukan difusi tanapa terjuadi gejala listrik. Agar difusi timbulnya sebagai kosekuensi dari gerakan acak molekul terjadi temperature normal. Gerakan ini menyebabkan cairan tinta biru. Pertama terjadi banyak pergerkan mendekati tengah. Seperti gerakan acak didalam gerakan jaringan dari ujung aslinya sampai cairan menjadi difusi yang bereaksi digelas kimia.
Diskripsi kuantitatif difusi adalah hokum Ficks
Hukum Ficks, C adalah konsentrasi dari beberapa zat seperti caiaran tinta biru sebagai fungsi positif. D adalah sebagai konstanta (menyebutnya konstanta atau konstanta difusi) Ficks kadang-kadang disebut koefisiensi Ficks sejak nilainya tidak sangup berdiri sendiri dari kosentrasi tetapi endapan bertambah dengan konsentrasi yang bertambah juga.
Biasanya D adalah determinasi dari percobaan agar daripada prinsip dasar. Beberapa ahli fisika mengartikan D bisa seperti tanpa untuk Dgas Iv/3, dimana l yang artinya bebas hambatan dan v adalah kecepatan rata-rata molekul.(didalam cairan ada hubungan yang menyulitkan dari intraksi ion) Contoh salah satu percobaan nilai koefisiensi difusi.
The Flux, jd adalah bilangan ion yang bergerak persatuan waktu dibagi satuan bidang. Jarang digunakan J untuk mendeskripsikan aliran ion, tidak mudah dan sering digunakan J menujukan hubungan intensitas arus listrik itu. J menambahkan gerakan partikel pada saat perpindahan muatan.
( Rio / 080810361)
Difusi dan koefisien difusiJika setetes tinta biru ditempatkan dalam gelas air, maka molekul tinta akan, rata-rata, menjauh dari daerah sangat terkonsentrasi ke dalam air sekitarnya. Proses ini akan berlanjut sampai tinta terdistribusi secara seragam di dalam air (yang akan menjadi cahaya seragam warna biru). Proses ini dikenal sebagai difusi dan muncul karena energi termal dari molekul. Pada awalnya, konsentrasi pewarna padat di drop dikelilingi oleh konsentrasi pewarna yang jauh lebih rendah. Akibatnya, ada aliran bersih dari pusat ke luar. Kita mengatakan difusi yang ada di arah konsentrasi menurun, yaitu aliran yang terjadi "menuruni gradien konsentrasi."
Tidak ada medan listrik diperlukan untuk difusi terjadi sebagai difusi bukan merupakan fenomena listrik. Sebaliknya, difusi muncul sebagai konsekuensi dari gerak acak diucapkan molekul yang terjadi pada suhu biasa. Gerakan ini acak menyebarkan tinta biru. Pada awalnya, lebih menjauh dari pusat drop tinta daripada menuju pusat, hanya karena molekul tinta lebih banyak dekat pusat. Seperti hasil gerakan acak dalam gerakan bersih dari situs asli, sampai tinta menjadi tersebar di seluruh gelas.
Dalam hukum Fick, C adalah konsentrasi zat tertentu, seperti tinta biru, sebagai fungsi dari posisi. D adalah konstanta proporsionalitas (disebut Fick konstan atau difusi konstan). Konstan Fick kadang-kadang disebut "koefisien Fick" karena nilainya tidak cukup independen konsentrasi tetapi sedikit meningkat dengan peningkatan C. Biasanya, D ditentukan dari percobaan dan bukan dari prinsip-prinsip dasar. Beberapa wawasan fisik ke D dapat diperoleh dengan mencatat bahwa untuk gas D =? / 3, di mana? adalah jalan bebas rata-rata dan v adalah kecepatan molekul rata-rata. (Dalam cairan, hubungan ini rumit oleh interaksi ionik.) Fluks, jd, adalah jumlah partikel (ion) yang bergerak per satuan waktu melalui penampang satuan luas. Sebuah j huruf kecil digunakan untuk menggambarkan aliran ion. Seperti disebutkan sebelumnya, sebuah J huruf mengacu pada kepadatan arus listrik terkait, yaitu, j mewujudkan gerakan partikel, sedangkan J mewujudkan gerakan yang teramati.Mobilitas Medan ListrikGerakan ion sangat dipengaruhi oleh medan listrik. Gerakan acak yang terjadi pada molekul, berakibat setiap ion yang bergerak memiliki kecepatan yang berbeda-beda dan tak jarang mengakibatkan tabrakan pada sesama ion yang sedang bergerak. Hasil tabrakan ion yang bergerak akan memunculkan nilai kecepatan baru yang terbatas karena energi yang berkurang akibat dampak dari tabrakan ion yang sebelumnya. Inilah yang disebut mobilitas. Mobilitas dilambangkan up.
Jika valensi ion dilambangkan dengan Zp maka fluks ionik dari konsentrasi ion dan kecepatan adalahDimana1. adalah medan listrik.2. Zp / | Zp | adalah gaya pada ion [ positif untuk ion bermuatan positif (kation) dan negatif untuk ion bermuatan negatif (anion)], dan jika (Zp / | Zp |) dikalikan dengan akan menjadi kecepatan rata-rata ion. Mobilitas ion tergantung pada viskositas pelarut, ukuran ion, dan muatannya. Satuan flukstergantung pada unit konsentrasi ion. Seringkali fluks dinyatakan sebagai mol per satuan luas per detik. Pada persamaan ini memberikan nilai fluks ion per satuan luas.
Mobilitas Koefisien DifusiMobilitas menghubungkan gaya akibat medan listrik (- ) dengan fluks ion yang dihasilkannya. Dengan bentuk matematis yang sama, konstanta Fick berkaitan perubahan spasial dalam konsentrasi ( C). Deskripsi hubungan keduanya sesuai dengan persamaan Einstein. Dimana: P adalah spesies ion. R adalah konstanta gas.F adalah konstanta faraday. T adalah temp absolut Zp adalah nilai valensi
( Putra Arifianda / 080810727)
FLUX BERDASARKAN DIFUSI DAN MEDAN LISTRIK
Nilai fluks didapatkan dari penjumlahan difusi dan medan listrik dengan persamaan masing-masing adalah sebagai berikut : (1)(2)Persamaan (1) merupakan persamaan difusi sedangkan pada persamaan (2) merupakan persamaan medan listrik. Berdasarkan kedua persamaan tersebut, didapatkan besarnya nilai fluks adalah
(3)
Dengan besarnya Dp yang didapatkan dari persamaan Einstein(4)
Kemudian, besarnya nilai fluks tersebut dapat dikonversikan menjadi besarnya nilai rapat arus listrik dengan mengkalikan FZp, sehingga didapatkan :(5)
Selanjutnya, dengan mensubstitusikan persamaan (4) yang merupakan persamaan Einstein, maka didapatkan persamaan rapat arus listrik yang baru, yaitu :(6)
Persamaan difusi Persamaan medan listrikDengan Jp= rapat arus listrikCp= konsentrasi ion pUp= kecepatanF= konstanta FaradayR= konstanta gas= fluksT= suhuZp= ion valensi
KonduktivitasKonduktivitas merupakan sifat daya hantar listrik suatu zat atau kemampuan suatu zat dalam menghantarkan listrik. Besarnya disebut dengan konduktansi dengan satuan Siemens per cm. Nilai konduktivitas ini dapat dicari melalui persamaan (6) diatas. Berdasarkan persamaan rapat arus yang dipengaruhi oleh medan listrik seperti yang telah dijelaskan sebelumnya, maka didapat kan persamaan rapat arus tersebut yaitu :(7)Dengan nilai , maka didapatkan persamaan rapat arus listrik yang lainnya, yakni :(8)Misalnya, untuk elektrolit KCl, maka total rapat arusnya menjadi(9)Pada persamaan (9) tersebut, nilai Zp dihilangkan karena pada suatu larutan elektrolit memiliki tidak memiliki nilai ion valensi. Berdasarkan hukum ohm yang menyebutkan bahwa , maka bisa didapatkan besarnya konduktivitas, yaitu :(10)Besarnya nilai konduktivitas dapat dipengaruhi oleh nilai derajat disosiasi, sehingga persamaannya menjadi(11)
Berikut ini merupaka salah satu contoh perhitungan untuk mengetahui nilai derajat disosiasi.Untuk NaCl :NaCl Na + ClMisalkan mol NaCl awal adalah a dan berdasarkan persamaan derajat disosiasi () yang menyebutkan bahwa :
Maka didapatkan besarnya mol NaCl yang terurai adalah a, sehingga :NaClNa +ClMol awal :a--Mol terurai :aa(1- )a(1- )
Mol Sisa :a(1- )a(1- )a(1- )Karena pada saat setimbang memiliki besar mol yang sama, maka dapat diketahui besarnya mol yang terurai untuk Na dan Cl. Sehingga dapat dihitung besarnya nilai derajat disosiasinya.Mol sisa NaCl = Mol Sisa Na + Mol Sisa Cla(1- ) = 2a(1- ) 1- = 2-2 =1Selain itu, terdapat juga nilai equivalent conductance yang berfungsi untuk menghitung nilai konduktansi ion dengan persamaan :(12)Berikut ini merupakan tabel data nilai equivalent conductance untuk beberapa ion.
Nilai equivalent conductance ini juga dapat digunakan untuk mengetahui nilai konduktansi dari suatu larutan elektrolit. Melalui persamaan (12) dapat diketahui bahwa nilai konduktansi tidak dipengaruhi oleh besarnya konsentrasi masing-masing ion. Oleh karena itu, didalam perhitungan, nilai konsentrasi dapat diabaikan. Berikut ini juga tersedia tabel data yang menunjukkan bahwa besarnya konduktansi tidak dipengaruhi oleh konsentrasi.
Transference NumberTransference number (t) merupakan jumlah arus yang dibawa oleh setiap ion. Nilai transference number ini digunakan untuk mengetahui jumlah muatan yang dibawa pada ruang antara intrasel dan ekstrasel. Besarnya transference number didapatkan dari persamaan berikut ini.
(Yuni W. / 080917002)
Struktur MembranSEL EKSITABEL dikelilingi oleh membrane plasma, yang memounyai fungsi utama untuk mengontrol keluar masuknya ion dan molekul sel. Membrane mempunyai sifat listrik dibawah jaringan.Membrane plasma adalah struktur yang mengikat sel. Membrane terdiri dari lipid sebanyak 70% volume membran, sesuai dengan jenis sel. Membrane bersifat heterogen dengan protein kompleks (kurang lebih2500 asam amino) melekat didalamnya. Beberapa protein sebagai pompa dan saluran yang mengalami pertukaran ion atara intrasel dan ekstrasel.Jari-jari ion 1 amstrong. Struktur saluran ion kira-kira 100 amstrong, dengan pori-pori yang lebih lebar dari pada ion. Tebal membrane 75 amstrong. Struktur membrane mempengaruhi kapasitas membrane dan sifat ionik.
Potensial transmembranApabila Potensial listrik didalam permukaan membrane dari sel eksitabel dibandingkan dengan potensial listrik diluar membrane pada saat potensial istirahat, maka beda potensial disebut dengan potensial antar membrane.Dimana potensial antar membrane adalah Vm , Karena membrane mempuyai hambatan, yang menimbulkan arus membrane Im, dimana timbulnya arus menunjukkan ketika potensial melewati antar membrane dari dalam keluar sel. Membrane eksitabel mempunyai fase aktif dan istirahat, yang mana potensial membrane berfluktuasi kurang lebih 0,1 volts. Perbedaan 0.1 volt tidak sebanding dengan voltase rumah. Potensial transmembran memproduksi medan listrik sangat besar diluar dan didalam membrane.
Pompa dan saluran membraneKemampuan kelistrikan dari saraf dan otot sesuai dengan perpindahan ion sodium, potassium, kalsium dan lain-lain melewati membran disanalah terdapat pompa dan saluran ion. Pompa adalah proses aktiv( menggunakan energi ) dengan perpindahan ion melawan gadien konsentrasi. Pompa natrium-kalium cenderung pelan tetapi kecepatan steady dan mengatur perbedaan konsentrasi Na dan K antara intrasel dan ekstrasel.Saluran digunakan untuk menghasilkan energy yang menyebabkan perbedaan konsentrasi untuk mengikuti arus tiap jenis ion dengan gradient konsentrasinya. Aliran ion sepanjang saluran menghasilkan perubahan potensial antar membran. Kemampuan Permeabilitas membrane dari masing-masing ion adalah kemampuan meningkatkan dan menurunkan kemampuan permeabilitas. Seperti mengontrol gerbang saluran yang akan merespon munculnya medan listrik. Saluran mempercepat terjadinya perubahan potensial membran. Perubahan kecepatan ditunjukkan dengan informasi transmisi didalam saraf dan kontraksi otot.
LipidLipid menentukan ketebalan molekul tunggal (monolayer). pada kondisi ini kepala lipid yg bersifat polar(yg bersifat hidrofili) berhadapan dengan air ketika meninggalkan ekor yg bersifat nonpolar (bersifat hidrofobik).Membran terdiri dari 2 lapisan lipid. Lapisan ini terdiri dari masing2 kelompok polar msg2 lapisan behadapan dengan intrasel dan ekstrasel medium aqueous. Sebaliknya, ekor non polar nya saling terhubung dan membentuk struktur bagian dalam membrane.Satu aspek dari membrane adalah fungsi listriknya sebagai capasitansi listrik. Bila menentukan kapasitansi seperti struktur parallel dengan konstanta dielektrik yg tinggi, kemudian menggunakan rumus kapasitansi parallel.
Nilai kapasitansi 1 mikrofarad adalah nilai yg paling besar dibandingkan material yang sering digunakan pabrik pembuatan kapasitor. Hasil menunjukkan keuntungan yang besar yang dikarenakan kombinasi yang luar biasa antara resistansi membrane dan konstanta dielektrik didalam membrane yang sangan tipis.Setelah menetapkan bahwa membrane terdiri dari dua lapisan yang terpisah oleh ruang kosong dan menggumpal pada 75 amstrong.
(Ova / 080917011)
Potensial Nernst Konsentrasi ion di ruang intraseluler dibandingkan ekstraseluler menyebabkan difusi ion dari konsentrasi tinggi ke konsentrasi rendah, laju difusi tergantung pada perbedaan konsentrasi dan permeabilitas membran (yang tergantung pada kerapatan saluran terbuka dan resistensi saluran).Besarnya beda potensial bergantung pada besarnya perbandingan konsentrasi ion potasium antara sisi dalam dan sisi luar membran sel dapat diperoleh dengan menggunakan
Persamaan Nernst.Sebagaimana diketahui bahwa membran memiliki sifat selektif permeabilitas. Dengan kata lain, ion tertentu dapat melewati membran dengan mudah sedangkan beberapa ion tertentu lebih sulit atau bahkan tidak dapat melewati membran sel. Hal ini dikarenakan komposisi ionik antara daerah intraseluler dan ekstraseluler sangat berbeda. Dengan demikian, persamaan Nernst-Planck adalah ekspresi yang sesuai untuk pemeriksaan aliran ion melintasi membran biologis.
Gambar 3.2
Konsentrasi sebuah sel diilustrasikan pada Gambar 3.2. Suatu sel merupakan dua kompartemen yang dipisahkan oleh membran selektif permeabel. Konsentrasi P + di kompartemen i lebih tinggi daripada kompartemen e (tetapi Q tidak permeabel). Akibatnya, P + akan berdifusi dari i ke e, (tapi Q. tidak dapat menyebar dari i ke e). Ion dalam larutan mengalami difusi signifikan di mana pun ada perubahan yang signifikan dalam konsentrasi antara lokasi terdekat. Karena komposisi ion di luar dan di dalam sel sangat berbeda dan letak yang berdekatan (hanya dipisahkan oleh membran tipis), maka gradien konsentrasi tinggi sering terjadi.Hasil difusi diakumulasi dalam muatan positif pada e (gaya elektrostatik di dalam muatan membran), meninggalkan kelebihan muatan negatif yang sama besarnya pada i (berada pada sisi membran akibat gaya elektrostatik). Hasilnya adalah perbedaan potensial, Vm, terkait dengan muatan AP + oleh kapasitansi membran Cm (mana Vm = AP + / Cm). Untuk ketebalan membran d ada juga medan listrik E = Vm / d = AP + / (Cd). Medan listrik diarahkan dari e dengan i, dan itu jelas meningkat besarnya sebagai AP + yang berdifusi dari i ke e. Meningkatnya medan listrik semakin menghalangi difusi lebih lanjut sampai tercapainya kesetimbangan.
Kesetimbangan Nernst
Kesetimbangan medan listrik (dari e dengan i) hanya menyeimbangkan kekuatan difusi (dari i ke e). Dalam kondisi seperti ini kita peroleh dari (3.6)
Karenanya
Kami berasumsi bahwa jumlah bervariasi dalam koordinat tegak lurus terhadap membran saja. Koordinat x kemudian disederhanakan menjadi
Kemudian ditata ulang menjadi
Kita dapat mengintegrasikan (3.18) melintasi membran dari kompartemen e ke kompartemen i:
Dengan demikian perbedaan potensial pada kesetimbangan membran, V eqm, sama dengan
dimana potensial transmembran telah didefinisikan sebagai intraseluler (i) dikurangi ekstraseluler(e).
Koefisien numerik berikut menggantikan RT / F (3.21) untuk kasus yang dipilih untuk Tberada pada suhu dingin (170 C)atau, menggunakan basis 10 logaritma,Potensial ion nernst adalah Vm dirumuskan oleh persamaan ini. Ketika ion p adalahekuilibrium, potensi Nernst adalah tegangan transmembran.
Contoh untuk ion Kalium dan Sodium 1. Misalkan otot katak memiliki konsentrasi yang tertera pada Tabel 3.1, dan membran permeabel terhadap ion kalium tetapi tidak untuk yang lain. Apakah potensi transmembran akan Ekuilibrium?
Jawaban : menggunakan rumus (3.22)
2. Jika membran yang sama hanya permeabel terhadap ion natrium, apa potensi transmembran akan ekuilibrium?
Jawaban : menggunakan rumus (3.22)
Perhatikan bahwa polaritas Vm berbeda antara ion natrium dan ion kalium. Hal tersebut dikarenakan rasio konsentrasi yang berbeda, meskipun kedua ion adalah kation.
(Rizka / 080917047)
ELECTROLYTES
Penurunan muatan relatifKeseimbangan kondisi yang terjadi pada potensial Nernst dapat dicapai karena adanya gerakan muatan dari satu sisi membran ke yang lain. Untuk membran biologis, potensial istirahat tergantung pada besarnya muatan dan kapasitansi membran. Karena hal tersebut, kemudian muncul sebuah pertanyaan, berapa banyak perubahan konsentrasi intraseluler atau ekstraseluler yang disebabkan oleh gerakan muatan. Untuk menjawab pertanyaan ini, kita perlu untuk menghitung jumlah muatan yang bergerak melintasi membran untuk menyeimbangkan tegangan mencapai potensial nernst, dan membandingkan jumlah tersebut dengan jumlah muatan dalam elektrolit.Jumlah muatan yang bergerak dapat dihitung dengan persamaan Q = CV. Dengan C adalah nilai kapasitansi membran dalam satuan F. Sedangkan V adalah tegangan pada membran dalam satuan volt.Sebagai contoh diketahui serabut otot: radius =10m = 0,001 cm C/A = 1 F/cm2 = 10-6 F/cm2 V= 100 mV = 0,1 V Panjang = 1 cm Maka, jumlah muatan dapat dicari sebagai berikut:Q =10-6 x 2 x 0.001 x 1 x 0.1 = 0.628 x 10-8 CNilai (2 x 0.001 x 1) adalah nilai dari luas serabut otot. Nilai ini diikutkan dalam perhitungan untuk menyesuaikan dengan satuan yang akan dicari.Untuk konsentrasi kalium intraseluler sebesar 124 mM / liter kita dapat menemukan jumlah muatan dalam elektrolit sebagai , dengan adalah konsentrasi Kalium dan F adalah konstanta Faraday, sehingga jumlah muatan adalah
Nilai adalah nilai volume serabut otot. Nilai ini diikutkan dalam perhitungan untuk menyesuaikan dengan satuan yang akan dicari.Setelah diketahui nilai jumlah muatan tersebut, maka penurunan muatan relatif dapat diperoleh dengan membandingkan jumlah muatan konsentrasi kalium dibandingkan dengan jumlah muatan yang bergerak untuk mencapai kondisi potensial nernst.
Hasil penurunan muatan relatif yang sangat kecil ini menyatakan bahwa hanya sebagian kecil saja muatan dalam larutan yang diperlukan untuk mengisi membran Perubahan konsentrasi yang disebabkan oleh gerakan ion-ion ini tidak penting dan dapat diabaikan. Tetapi jika periodenya lebih lama dan jumlah siklus pengisian lebih banyak, mungkin ada efek kumulatif yang signifikan.
ElectroneutralityCairan elektrolit selalu mengandung muatan positif (kation) dan muatan negatif (anion) dalam jumlah yang sama. Kesetimbangan inilah yang disebut dengan elektronetralitas. untuk mencapai kondisi elektronetralitas pada cairan elektrolit, muatan-muatan akan bergerak dengan membawa gaya elektrostatik yang kuat dan cenderung untuk mengembalikan kondisi muatan bernilai nol.Pergerakan muatan untuk mencapai kondisi potensial Nernst tidak mempengaruhi elektronetralitas karena besarnya muatan yang sangat kecil, selain itu karena kelebihan muatan positif atau negatif berada pada membran, tidak dalam larutan.Untuk mencapai kondisi potensial nernst pada membran, membran tersebut harus hanya permeabel khas untuk satu jenis ion saja. Syarat ini menimbulkan keuntungan karena kita tidak perlu mengetahui berapa nilai permeabilitas membran, kita hanya perlu tahu bahwa membran tersebut hanya permeabel untuk ion potassium saja atau ion klorida saja, atau ion yang lain.Kondisi potensial nernst pada membran hanya terjadi pada saat konsentrasi tertentu saja. Ketika pada konsentrasi tertentu tersebut, potensial akan berada pada nilai setimbang dan sama di seluruh membran. Kemudian kita akan bisa memdapatkan nilai potensial ambang transmembran, pada potensial berapakah ion-ion dapat lewat.
(Vira/081017003)
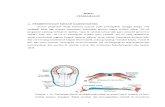
MODEL KONDUKTANSI PARALELModel konduktansi paralel menyatakan bahwa ion-ion yang berbeda akan melewati membran secara independen satu sama lain, seperti yang ditunjukkan diagram pada Gambar 3.3, yaitu membutuhkan jalur yang berbeda saat melintasi membran yang beroperasi secara paralel dan simultan. Berdasarkan premis tersebut, masalah sekarang dibagi ke dalam bagaimana masing-masing jalur beroperasi, dan bagaimana mereka bergabung bersama-sama untuk menciptakan efek gabungan seperti potensial istirahat membran.
Gambar 3.3. Model Konduktansi Paralel dari Membran Sel Eksitabel (IN = intraseluler, OUT = ekstraseluler). Saluran konduktansi Independen untuk K+, Na+, dan Cl-. Potensial Transmembran Vm bernilai positif ketika potensial intrasel memiliki lebih tinggi daripada ekstrasel. Polaritas baterai menunjukkan bahwa biasanya potensial Nernst untuk EK dan ECL adalah negatif (intrasel lebih negatif daripada ekstrasel) dan untuk ENA adalah positif (intrasel lebih positif ekstrasel).
Potensial Istirahat Potensial istirahat membran sel eksitabel merupakan salah satu penyebab membran menjadi stabil (steady state). Ini adalah nilai di mana arus total membran bernilai nol (jika tidak, kami memiliki perubahan potensial dan membran tidak pada saat istirahat). Sebelum elektroda intraseluler, dengan perkiraan bahwa semua ion permeabel secara individual dalam kesetimbangan (yaitu, dalam hal ini akan ada total tidak adanya aliran ion transmembran). Hal ini tidak terjadi, karena jelas potensial Nernst untuk masing-masing ion permeabel nilainya berbeda (tidak ada potensial transmembran tunggal yang membawa semua ion pada kesetimbangan).Untuk dapat mengatasi mekanisme yang dinamis seperti itu, kami memperkenalkan representasi membran pada Gambar 3.3. Representasi ini disebut "model konduktansi paralel." Modelnya dimaksudkan untuk mewakili aliran ion yang melalui saluran masing-masing ion di daerah kecil membran, yang sering disebut elemen membran, atau sebuah patch membran,
Arus ionikSeperti yang telah ditunjukkan, model itu mengasumsikan bahwa ion yang digunakan secara signifikan adalah kalium, natrium, dan klorida. Setiap cabang menentukan kontribusi terhadap total arus transmembran dari ion tertentu, dan masing-masing cabang dianggap sebagai gambaran makroskopik dari masing-masing saluran ion yang terbuka. Asumsi yang mendasari model konduktansi paralel adalah bahwa seseorang dapat mengidentifikasi segmen membran yang cukup kecil bahwa tegangan transmembran adalah sama semua pada patch, sementara pada saat yang bersamaan bahwa patch cukup besar mencakup berbagai saluran ionik, sehingga rata-rata perilaku saluran harus diwakili. Inilah yang mendasari asumsi dapat dibuktikan dengan benar dalam berbagai situasi.Jika potensial membran adalah Vm, maka kekuatan pendorong bersih untuk kalium (Vm-EK), yang menilai penyimpangan dari titik ekuilibrium. Arus kalium, akibatnya, proporsional untuk Vm-EK, proporsionalitas koefisien gK memiliki dimensi konduktansi, dan disebut konduktansi kalium. Konduktansi gK tidak konstan tetapi bervariasi tergantung pada banyaknya saluran yang terbuka pada saat tertentu. (Dalam bab berikutnya kita menggambarkan ketergantungan konduktansi pada kondisi membran.) Jadi IK = gK (Vm EK) (3.26) Rangkaian listrik yang sesuai diilustrasikan pada gambar 3.3. Jika Vm > EK, maka kekuatan difusi di luar tidak sepenuhnya diseimbangkan oleh medan listrik, dan fluks bersih kalium di luar, sehingga memiliki hasil. Perhatikan bahwa IK dalam (3.26) adalah tepat positif. Untuk ion sodium INa = gNa (Vm ENa) (3.27)Disini jika Vm > ENa, kemudian karena ENa, adalah positif maka Vm harus positif dan bahkan lebih besar dari ENa. Hasilnya adalah fluks natrium di luar didorong oleh medan listrik yang melebihi gaya difusi di dalam. Persamaan (3.27) memberikan tanda yang benar untuk INa. Untuk ion klorida, dianalogikan seperti (3.26), sehingga diperoleh ICl = gCl (Vm ECl) (3.28)Jika Vm > ECl, difusi klorida di dalam tidak sepenuhnya diseimbangkan dan terjadi pemasukan yang bersih. Karena masuknya ion ini dengan muatan negatif, maka hal itu merupakan arus listrik di luar; ICl harus positif, dan seperti (3.28).
Konduktansi Paralel dalam Bentuk AlternatifPerlu diingat bahwa model konduktansi paralel dalam bab ini hanya untuk menyajikan konsep model utama dalam bentuk yang sederhana. Model konduktansi paralel seperti yang digunakan dalam konteks tertentu (misalnya, bab-bab selanjutnya dalam buku ini) biasanya dimodifikasi secara signifikan dari bentuk di atas. Sebagai contoh, Hodgkin dan Huxley menggunakan model konduktansi paralel yang memiliki jalur natrium dan kalium, dan jalur ketiga diidentifikasi sebagai kebocoran. Disimpulkan sifat kebocoran channel dari pengukuran potensial transmembran, bukan dengan model aliran ion tertentu.Peneliti lain telah menggunakan model konduktansi paralel dengan jalur-jalurnya untuk mewakili ion tambahan, seperti ion kalsium, dan mekanisme tambahan, seperti pompa ion.
Arus KapasitifUntuk melengkapi daftar kontribusi pada arus transmembran maka kita tambahkan arus kapasitif (atau perpindahan), yang sangat sederhanaIC = Cm dVm/dt (3.29)Pada saat istirahat (yaitu, pada kondisi steady state), IC = 0 karena dVm/dt = 0 (karena jika dVm/dt tidak nol, Vm akan akan berubah dan dengan demikian tidak berada dalam kondisi steady state).Arus kapasitif jauh lebih memungkinkan untuk terjadi, karena membran sangat tipis sehingga sangat kapasitif.
Vm Istirahat dari Hambatan Steady-StateSeperti disebutkan di atas, membran istirahat membutuhkan kondisi steady-state, yaitu, nol arus bersih transmembran. Arus membran Im adalah Im = IC + IK + ICl + Ina Pada kondisi steady-state, IC = 0 karena dVm/dt = 0. Dengan demikian, pada steady state,Im = 0 = 0 + IK + ICl + INa Penggantian ekspresi (variabel) untuk setiap arus ion dari (3.26), (3.27), dan (3.28) memberikan gNa (Vm Ena) + gK (Vm- EK) + gCl (Vm Ecl) = 0 (3.30)Dengan begitu Vm pada (3.30) dapat diselesaikan dan diperoleh nilai istirahat, Vrest, yang diberikan oleh Vrest = (gK EK + gCl ECl + gNa ENa) / gK | gNa | gCl (3.31)Persamaan (3.31) dikenal sebagai persamaan konduktansi paralel transmembran untuk potensial istirahat. Persamaan ini menggambarkan bagaimana Vm muncul sebagai rata-rata besarnya nilai EK, ECl, dan ENa tergantung pada konduktivitas relatif masing-masing ion.
(Ratna / 081017007)
EXAMPLE FOR SQUID AXONBerdasarkan model konduktansi paralel, dapat diilustrasikan menggunakan nilai EK, ECl, dan ENa untuk akson cumi cumi dari tabel 3.1 dan persamaan 3.23.
Gambar ..... Tabel 1. Konsentrasi Ion pada Otot dan Syaraf
Gambar ..... Persamaan Potensial Nerst untuk sebuah IonBerdasarkan nilai konsentasi pada masing masing ion dan persamaan 3.23 kami memilih nilai konduktansi pada kondisi istirahat dimana nilai GK+ = 0,415 mS/cm2; GCl- = 0,582 mS/cm2; GNa+ = 0,010 mS/cm2. Nilai nilai yang telah diketahui tersebut dapat digunakan untuk penghitungan pada suatu pengujian dari pengaruh relatif potensial Nerst dan konduktivitas dalam kondisi istirahat sehingga didapatkan nilai EK+ = -74.7 mV; ENa+ = 54,2 mV; ECl- = -65,8 mV, berikut contoh penghitungan pada ion Na+ :ENa+ =
= 54,2 mVLalu dengan menggunakan rumus dibawah ini (persamaan 3.31) kita mendapatan nilai Vrest :
Dimana penghitungannya sebagai berikut :Vrest =
= - 68,0 mVPotensial istirahat (Vm) inilah yang menimbulkan efluks stabil pada potasium (K+). Efluks potasium terjadi karena adanya perbedaan nilai pada Vm dan EK sebesar 6,7 mV, sedangkan influks pada sodium terjadi karena adanya perbedaan nilai Vm pada keseimbangan potensial Nerstnya (pada contoh akson cumi cumi sebesar 122,2 mV).Efluks pada potasium (K) dan influks pada sodium (Na) dipicu oleh dorongan yang bekerja pada konduktivitas rendah agar kondisi syaraf (pada contoh ini akson cumi cumi) menjadi seimbang dan mencapai steady state. Untuk mempermudah, ion klorida (Cl-) diasumsikan sebagai dasar keseimbangan dalam perpindahan antar elektron K maupun Na. Sehingga model konduktansi paralel berdasarkan pada konduktansi membran jaringan syaraf (nerve).
(Risty/ 081017031)
Kontribusi Klorida
Peran ion klorida (Cl-) yakni menyeimbangkan konsentrasi ketika terjadi keluar masuknya ion kalium (K+). Untuk itu perbandingan jumlah ion klorida mengikuti perbandingan jumlah ion kalium. Secara matematis dapat dituliskan sebagai berikut :
[K+]i [Cl]i = [K+]e [Cl]e (3.32)
Untuk dapat melihat lebih jelas mengenai kesetimbangan klorida, maka telah dilakukan eksperimen yang dilakukan oleh Hodgkin dan Horowicz menggunakan otot katak. Hasil dari eksperimen dapat dilihat pada gambar dibawah ini :
Eksperimen yang dilakukan Hodgkin dan Horowicz
Dengan catatan sebagai berikut : Eksperimen tersebut dilakuan pada otot katak yang ditempatkan di media normal ekstraseluler. Konsentrasi kalium ekstraseluler [K+]e = 2,5 mM. Konsentrasi klorida ekstraseluler [Cl-]e = 120 mM. Konsentrasi kalium intraseluler [K+]i = 140 mM. Konsentrasi klorida intraselular [Cl-]i = 2,4 mM. Potensial istirahat WS nominal keseimbangan klorida potensi sebesar -98,5 mV.
Dapat dilihat dari gambar hasil eksperimen Hodgkin dan Horowicz bahwa pada saat t=0, dimana potensial keseimbangan klorida sebesar -98,5 mV, ketika terjadi penurunan secara tiba-tiba jumlah ion klorida yang mulanya sebesar 120 mM menjadi 30 mM maka potesial membrane akan naik. Peristiwa naiknya potensial tersebut akibat adanya ion klorida yang berdifusi kedalam membran. Peristiwa ini dapat disebut juga depolarisasi. Namun seiring bertambahnya waktu, potensial pada keadaan tersebut akan secara perlahan turun hingga mencapai keadaan semula yakni pada potensial membrane istirahat.Keadaan tersebut tetap akan dipertahankan, sampai pada menit ke-17 dimana terjadi kenaikan kembali jumlah ion klorida menjadi 120 mM yang menyebabkan potensial membrane akan turun. Sama halnya seperti pada keadaan sebelumnya, potensial membrane tersebut perlahan-lahan akan naik hingga pada menit ke-25 potensial membrane sudah kembali pada keadaan potensial membrane istirahatnya. Hal tersebut terjadi karena ketika adanya perubahan ion klorida akan diseimbangkan dengan adanya ion kalium yang jumlah perubahannya mengikuti jumlah ion klorida tersebut.
Aspek-aspek perubahan juga dapat dilihat sebagai berikut : Efek dari efluks KCl adalah berkurangnya [K+]i tetapi kita harus menyesuaikan bahwa jumlah ini adalah perubahan yang kecil dari 140 ke 138 mM. Bagaimanapun, akibat turunnya 2 mM saja, menyebabkan persentase perubahan klorida yang besar. Akhirnya, (dalam 15 menit atau lebih) ECl turun ke nilai yang ditentukan oleh EK (seperti [Cl-]i karena efluks klorida). Untuk steady state terbaru ECl -98,5 mV, diasumsikan tidak berubah, jadi [Cl-]i harus turun dengan faktor 1/4 untuk mengimbangi pengurangan [Cl-]e dengan dengan faktor 1/4 (i.e., dari 120 ke 30 mM). Konsentrasi baru ini terjadi ketika [Cl-]i mencapai 0,6 mM dari nilai awalnya yaitu 2,4 mM, kehilangan 1,8 mM. Untuk mengimbangi, efluks KCl tersebut terdiri dari 1,8 mM. Efluks ini menyebabkan penurunan konsentrasi kalium intraseluler dari 140 ke 138,2 mM. Sebagai catatan, jumlah perubahan ini diabaikan pada EK.
(Arieanti / 081017036)1
24