Isi Parasit
-
Upload
anjar-adi-setiawan -
Category
Documents
-
view
252 -
download
1
description
Transcript of Isi Parasit
BAB 1. PENDAHULUAN1.1 Latar Belakang
Parasitologi adalah ilmu yang mempelajari tentang parasit. Parasit dapat berupa hewan, tumbuhan, virus, riketsia, ragi, jamur, kapang, protozoa, artropoda, cacing, molusca dan bahkan vertebrata. Secara umum parasitologi mencakup seluk-beluk mengenai semua organisme tersebut. Namun dalam laporan ini hanya akan dibahas tentang protozoa (protozoologi), arthropoda (entomologi) dan cacing (helminthologi). Parasit dalam peranannya adalah suatu organisme yang hidup secara temporer (sementara) atau menetap pada atau dalam tubuh organisme hidup yang bertujuan untuk memperoleh makanan. Dalam hal ini parasit diuntungkan dengan adanya hubungan yang erat terhadap keberadaan induk semang. Sedangkan inangnya akan mengalami defisensi dan kerugian serta dapat menimbulkan penyakit (Bendryman, 2012). Jumlah hewan yang dapat berperan sebagai parasit sangat banyak,sehingga dibutuhkan suatu metode untuk melakukan identifikasi parasit tersebut. Laporan ini diharapkan dapat bermanfaat sebagai acuan dalam mempelajari parasitologi dari segi klasifikasi, morfologi, induk semang, vektor, cara penularan maupun siklus hidupnya (Suwanti, 2013)1.2 Rumusan Masalah 1) Jenis-jenis parasit apa saja yang sering ditemukan di Indonesia?2) Bagaimana identifikasi dan klasifikasi parasit yang ditemukan?1.3 Tujuan1) Mengetahui jenis-jenis parasit apa saja yang ditemukan.2) Mengetahui teknik identifikasi dan klasifikasi parasit yang ditemukan.BAB 2. PELAKSANAN KEGIATAN
2.1 Prosedur Pemeriksaan Cacing (Helminth)
2.1.1 Pemeriksaan Feses Metode Natif
1) Oleskan feses secukupnya pada objek glass steril dengan lidi.
2) Teteskan 1-2 tetes air pada feses tersebut, kemudian aduk dengan lidi atau buat sudut sedikit miring pada ujung cover glass.
3) Tutup dengan cover glass.
4) Periksa di bawah mikroskop dengan pembesaran 100x
2.1.2 Pemeriksaan Feses Metode Sedimentasi
1) Membuat suspensi larutan feses dengan perbandingan 1 bagian feses dan 10 bagian air .
2) Saring suspensi dengan saringan teh dan tampung larutan pada gelas plastik.
3) Masukkan larutan ke dalam tabung, kemudian sentrifuse dengan kecepatan 1500 rpm selama 2-5 menit.
4) Buang supernatan (bagian jernih) lalu masukkan air kemudian lakukan sentrifuse sekali lagi hingga diperoleh supernatan yang jernih.
5) Buang supernatan, ambil sedimen dan oleskan pada objek glass (teteskan dengan pipet Pasteur).
6) Tutup dengan cover glass.
7) Periksa di bawah mikroskop dengan pembesaran 100x.2.1.3 Pemeriksaan Feses Metode Apung
1) Buat suspensi feses dengan perbandingan 1 bagian tinja dan 10 bagian air. Saring dan filtrat dimasukkan tabung sentrifuse.
2) Disentrifugasi selama 2-5 menit dengan kecepatan 1500 rpm.
3) Hal ini diulang beberapa kali sampai supernatan jernih, pelarut dibuang dan diganti larutan NaCl jenuh sampai 1 cm dari mulut tabung, lalu disentrifuse lagi.
4) Letakkan tabung sentrifugasi pada rak tabung dan pelan-pelan ditetesi dengan larutan gula jenuh sampai cairan terlihat cembung pada mulut tabung sentrifugasi.
5) Letakkan cover glass pelan-pelan di atas tabung sentrifuge, biarkan 1-2 menit, kemudian diambil dan diletakkan di atas glas obyek, kemudian diperiksa di bawah mikroskop
2.1.4 Pemeriksaan Saluran Pencernaan Unggas
1) Potong tiga saluran utama pada unggas yaitu, vena jugularis, esophagus, dan trakea.
2) Basahi tubuh unggas dengan air agar bulunya tidak berterbangan.
3) Kulit luar pada unggas digunting untuk dilakukan pembedahan.
4) Otot perut digunting pada linea alba, kemudian pada batas costae ke arah kanan dan kiri.
5) Diafragma digunting didekat perlekatannya dengan costae.
6) Costae di potong pada perbatasan tulang rawan dan tulang keras.
7) Kemudian menarik saluran pencernaan dari esophagus sampai ke anus, kemudian dipisahkan menjadi tiap-tiap organ.
8) Melakukan pembedahan pada masing-masing organ tersebut dengan menggunakan alat-alat seksi (gunting, scalpel, dan pinset).
9) Mengeluarkan isi usus dan menyayat bagian-bagian tertentu untuk menemukan cacing.
10) Melakukan kerokan (scraping) dengan scalpel untuk mencari kemungkinan adanya skoleks cacing pita terutama bila terdapat keradangan atau mukosa hiperemis.
11) Cacing yang ditemukan letakkan pada objek glass dan beri PZ. Cacing yang ukurannya kecil di buat preparat permanen (pewarnaan) yang besar dimasukkan ke dalam formalin 10%.
12) Periksa di bawah mikroskop dengan pembesaran 40x.
13) Identifikasi cacing.
2.1.5 Pemeriksaan Saluran Pencernaan Anjing
1) Memisahkan saluran pencernaan dengan cara mengikat ganda dan memotong antara kedua ikatan tersebut sehingga usus halus terpisah dari organ lain.
2) Melakukan seksi pada organ tersebut (usus halus) dengan menggunakan alat-alat seksi seperti gunting, pinset, dan scapel.
3) Mengeluarkan isinya. Kemudian campur dengan air secukupnya dalam mangkok plastik, aduk dan selanjutnya disaring dengan alat saringan ukuran sedang atau besar secara perlahan-lahan.
4) Saringan yang digunakan memiliki lubang penyaring yang rapat atau tidak berlubang lebar agar cacing yang didapatkan dapat tersaring dengan baik.
5) Amati keberadaan cacing pada alat penyaring. Letakkan cacing pada objek glass.
6) Cacing diperikasa di bawah mikroskop 40x
7) Cacing yang ditemukan letakkan pada objek glass dan beri PZ. Cacing yang ukurannya kecil di buat preparat permanen (pewarnaan) yang besar dimasukkan ke dalam larutan formalin 10%.2.1.6 Pembuatan Preparat Permanen Helminthes Kering
1) Cacing difiksasi diantara dua objek glass. Kedua ujung gelas diikat dengan tali rafia.
2) Objek glass dan cacing dimasukkan ke larutan alcohol gliceryn 5% selama 24 jam.
3) Kemudian dimasukkan alcohol 70% selama 5 menit.
4) Dipindahkan ke dalam larutan karmin yang sudah diencerkan dibiarkan selama kurang lebih 8 jam tergantung ketebalan kutikula cacing.
5) Cacing dapat dilepas dari fiksasi (objek glass) dan dimasukkan ke dalam alcohol asam selama 2 menit.
6) Dipindahkan ke dalam larutan alcohol basa selama 20 menit.
7) Kemudian dilakukan dehidrasi bertingkat dengan alcohol, sebagai berikut :
a) Alkohol 70% selama 5 menit.
b) Alkohol 85% selama 5 menit.
c) Alkohol 95% selama 5 menit.
8) Mounting dengan larutan Hung's I selama 20 menit.
9) Cacing diambil dari larutan Hung's I, diletakkan pada objek glass yang bersih dan diteteskan larutan Hung's II diatas cacing tersebut. Kemudian ditutup dengan cover glass.
10) Preparat permanen dikeringkan dalam inkubator pada suhu 370 C, kemudian ditaruh di suhu ruang untuk pendinginan dan siap digunakan.
2.2 Prosedur Pemeriksaan Ektoparasit
2.2.1.Pengumpulan Ektoparasit.1. Pengumpulan Lalat. Pengumpulan lalat dilakukan menggunakan alat berupa jaring. 2.Pengumpulan Kutu. Pengumpulan kutu dilakukan dengan memeriksa bulu hewan.3..Pengumpulan Pinjal. Pengumpulan pinjal dilakukan dengan memeriksa bulu hewan4.Pengumpulan Tungau. Pengumpulan tungau dilakukan dengan cara berikut:. Periksa kulit hewan yang terlihat berkeropeng. Kemudian gunakan scalpel blade untuk mengerok bagian kulit yang berkeropeng sampai berdarah. Kerokan langsung dicampur KOH 10% untuk dilihat dibawah mikroskop, 5 menit kemudian ditutup dengan gelas penutup.
5.Pengumpulan Caplak. Pengumpulan caplak dilakukan dengan memeriksa bulu secara teliti.
2.2.2. Pengawetan Kering Ektoparasit
Pengawetan kering dilakukan dengan metode pinning. Pinning dilakukan dengan langkah-langkah berikut:
1) Mematikan serangga dengan chloroform.
2) Mengembangkan sayap serangga (serangga bersayap) dan kaki agar mudah dipelajari.
3) Memegang serangga diantara ibu jari dan telunjuk tangan yang satu dan menusukkan pin dengan tangan lainnya (pin baja).
4) Pada lalat penusukan dimulai dari thorak diantara pangkal sayap depan sedikit ke kanan pangkal garis tengah.
5) Menyeragamkan ketinggian lalat pada pin dengan pinning blok (sterofoam).
6) Serangga kecil diletakkan diatas ujung kertas segitiga dan ditempel menggunakan canada balsem. Pin dilakukan pada kertas tersebut.
7) Mengidentifikasi dengan loop atau stereo mikroskop.
8) Memberikan label (nama spesies/genus, predileksi/inang, nama kolektor, tanggal dan lokasi pengambilan)
9) Mengeringkan serangga dalam oven 50-600 C selama 24 jam.
10) Memasukkan ke dalam kotak penyimpanan preparat dan diberikan kapur barus.
2.2.3 Pengawetan Basah Ektoparasit
a) Permanen Mounting Tanpa Pewarnaan
1) Serangga dimatikan dengan chloroform.
2) Memasukkan serangga kedalam tabung reaksi yang berisi KOH 10% kemudian dipanaskan dalam air yang mendidih selama 1 jam atau sampai serangga tampak transparan.
3) Memasukkan serangga ke dalam alkohol dengan konsentrasi berturut-turut 30, 50, 70, 95, 96% masing-masing 3 menit selanjutnya mencelupkan ke dalam xylol dalam waktu singkat (+1 menit).
4) Meletakkan serangga pada gelas obyek dan diberikan canada balsem kemudian ditutup dengan cover glass.
5) Mengidentifikasi di bawah mikroskop dengan perbesaran 40-100x dan diberi label.
6) Mengeringkan preparat dengan dimasukkan ke dalam inkubator.b) Permanen Mounting Dengan Pewarnaan
1) Serangga dimatikan dengan chloroform
2) Memasukkan serangga yang sudah mati ke dalam tabung reaksi yang berisi KOH 10% dengan ketinggian sekitar 1/3 tabung kemudian direbus selama 1 jam atau sampai serangga tampak transparan.
3) Mencuci dengan aquadest sebanyak 2x.
4) Merendam serangga dalam alkohol 95% selama 10 menit.
5) Merendam dalam acid fuchsin selama 30 menit.
6) Merendam dalam alkohol 95% selama 2 menit.
7) Merendam dalam alkohol 95%+xylol sama banyak selama 5 menit.
8) Merendam dalam xylol selama 1 menit.
9) Meletakkan serangga pada obyek glass dan diberikan canada balsem kemudian ditutup dengan cover glass.
10) Mengidentifikasi dibawah mikroskop dengan perbesaran 40-100x dan dberi label.
11) Mengeringkan dalam inkubator sampai preparat kering
2.3 Prosedur Pemeriksaan Protozoa
2.3.1.Pemeriksaan Protozoa pada Feses Dengan Metode Natif
1) Teteskan 1-2 tetes air pada objek gelas
2) Ambil sedikit feses campur dengan aquadest sampai merata
3) Tutup dengan gelas penutup dan lihat dibawah mikroskop dengan perbesaran 400x -1000x2.3.2.Pemeriksaan Protozoa pada Feses Dengan Metode Sedimen
1) Larutkan feses dengan air sehingga didapatkan konsentrasi 10% (1 bagian feses dengan 10 bagian air).
2) Saring larutan feses dengan saringan (kain kasa).
3) Masukkan filtrat ke dalam tabung sentrifus dan lakukan sentrifugasi 1500 rpm selama 5-10 menit.
4) Buang supernatan dan tambahkan air dalam jumlah yang sama dan aduk sampai homogen.
5) Ulangi sentrifugasi dengan cara yang sama dan buang supernatan.
6) Ulangi cara tersebut sampai didapatkan supernatan yang bersih.
7) Buang supernatan dan sisakan sedikit air, campur dengan baik.
8) Ambil satu tetes dengan pipet pasteur, letakkan pada objek gelas dan tutup dengan gelas penutup.
9) Lihat di bawah mikroskop dengan pembesaran 400-1000x.
2.3.3.Pemeriksaan Protozoa pada Feses Dengan Metode Apung
1) Larutkan feses dengan air sehingga didapatkan konsentrasi 10% (1 bagian feses dengan 10 bagian air).
2) Saring larutan feses dengan saringan (kain kasa).
3) Masukkan filtrat ke dalam tabung sentrifus dan lakukan sentrifugasi 1500 rpm selama 5-10 menit.
4) Buang supernatan dan tambahkan air dalam jumlah yang sama dan aduk sampai homogen.
5) Ulangi sentrifugasi dengan cara yang sama dan buang supernatan.
6) Ulangi cara tersebut sampai didapatkan supernatan yang bersih.
7) Buang supernatan dan tambahkan gula jenuh sampai 2/3 tabung dan campur dengan membolak balikkan tabung.
8) Sentrifugasi dengan kecepatan yang sama dengan cara sebelumnya.
9) Letakkan tabung pada rak tabung dengan posisi tegak.
10) Tambahkan gula jenuh sampai penuh dan membentuk cembung pada permukaan tabung.
11) Tutup dengan gelas penutup dan biarkan selama 5 menit.
12) Ambil cover glass dan letakkan pada objek glass dan dilihat dibawah mikroskop dengan perbesaran 400x-1000x
2.3.4 Teknik Pembuatan Ulas Darah Tipis Untuk Pemeriksaan Protozoa Darah
1) Siapkan objek glass (A) dan objek glass penggulas (B) yang bersih
2) Teteskan satu tetes darah pada objek glass A (sbelah ujung)
3) Ambil objek glass pengulas (B) dan letakkan ujung objek glass tersebut pada tetesan darah sampai semua ujung objek glass pengulas terbasahi darah
4) Apabila darah yang diteteskan terlalu banyak, pindahkan usapan
5) Buat sudut antara objek glass (A) dan gelas objek pengulas (B) 30-40C
6) Dengan gerakan kedepan yang cepat, ulaskan darah sehinga didapatkan hasil ulasan yang semakin lama semakin tipis
Catatan: pada saat mengulas tidak diperbolehkan berhenti ditengah ulasan dan darah habis sebelum ujung objek gelas
7) Keringkan hasil ulasan pada suhu kamar sehingga benar-benar kering2.3.5.Teknik Pembuatan Ulas Darah dengan Pewarnaan Giemsa
1) Ulas darah tipis yang sudah kering dilanjutkan fiksasi dengan methanol (methil alkohol absolut selama tiga menit)
2) Tanpa dikeringkan masukkan objek glass pada larutan giemsa 10-20% selama 30 menit
3) Untuk usapan darah tebal langsung dimasukkan kedalam pewarna giemsa tanpa dilakukan fiksasi dengan methanol absolut.
4) Setelah 30 menit, ambil objek glass dan cuci dengan air mengalir (air keran) dengan pelan-pelan sampai zat warna yang tersisa yang menempel hilang. Tidak diperbolehkan menggosok hasil usapan darah
5) Pada pencucian hasil ulas darah tebal tidak diperbolehkan pada air mengalir
6) Keringkan objek glass dengan cara meletakkan objek glass posisi berdiri pada bidang pengering pada suhu kamar. Pengeringan dapat dipercepat dengan kipas angin
7) Periksa dibawah mikroskop dengan pembesaran 400x-1000x
8) Untuk pembesaran 1000x digunakan oil emersi
2.3.6.Swab Kerongkongan Unggas (Diagnosa Trichomoniasis)
1) Siapkan gelas objek dan cawan petri yang berisi NaCl fisiologis
2) Pegang unggas yang didiagnosa terinfeksi Trichomoniasis dan buka mulut lebar-lebar
3) Masukkan cotton bud yang telah dibasahi NaCl fisiologis sampai ke pangkal kerongkongan dan usapkan (swab)
4) Masukkan hasil usapan ke cawan yang berisi NaCl fisiologis dan campur sampai homogen
5) Ambil satu tetes dengan pipet pasteur dan letakkan pada gelas obyek dan ditutup dengan gelas penutup kemudian amati pada mikroskop dengan pembsaran 400x-1000x
6) Apabila positif Trichomoniasis akan ditemukan Trichomonas yang bergerak aktif dengan flagelaBAB 3. HASIL DAN PEMBAHASAN3.1 Helmint3.1.1 Capillaria sp
Sinyalemen hewan
Jenis hewan : Ayam
Ras
: kampung
Sex
: betina
Umur/bb: +- 1 tahun / 1.5kg
Anamnesa : diperoleh dari pasar hewan di Darmo, SurabayaPemeriksaan fisik : selaput lendir pucat, bulu banyak yang rontok, tidak diareDiagnosa tentatif : Suspect Helminthiasis, Suspect MalariaPemeriksaan feses metode sedimentasi : ditemukan telur Capillaria sp, tidak ditemukan protoza.Pemeriksaan apusan darah : tidak ditemukan protozoa darahDiagnosa : Capillariasis
Klasifikasi ilmiah dari Capillaria sp adalah sebagai berikut :
Kingdom: Animalia
Phylum: NematodaClass
: AdenophoreaOrder
: TrichocephalidaFamily
: CapillaridaeGenus
: Capillaria
Spesies
: Capillaria sp (Bendryman, 2012.)Cacing Capillaria sp morfologinya memiliki bentuk tubuh silinder kecil dengan besar sama dari anterior sampai posterior. Telur Capillaria sp berdinding tebal, kedua sisinya datar dan pada ujung anterior sampai posterior terdapat operkulum (selaput penutup). Cacing dewasa jantan memiliki panjang 10-48 mm, diameter 52-80 m, Betina memiliki panjang 25- 70 mm, diameter 77-150 m. Ukuran telur cacing sebesar 46-70 x 24-28 m (Camargo et al, 2010).Siklus hidup cacing Capilaria sp terbagi menjadi dua, yaitu secara langsung dan tidak langsung. Siklus hidup secara langsung terjadi jika telur infektif akan tertelan dan masuk ke dalam saluran pencernaan. Siklus hidup tidak langsung yaitu telur infektif termakan cacing tanah (Eisenia foetida, Allolobophora caliginosa) dan unggas terinfeksi karena makan cacing tersebut. Larva infektif dicapai dalam waktu 14-21 hari dalam cacing tanah (Nadia et al, 2014).
Gejala klinis unggas yang terinfeksi Capillaria sp adalah terjadinya infeksi berat menimbulkan peradangan pada usus halus sehingga timbul gejala diare, kelemahan otot, kekurusan, anemi, pertumbuhan terhambat dan fertilitas menurun. Gejala klinis mamalia yang terinfeksi Capillaria sp adalah apabila terinfeksi ringan tidak menunjukkan gejala klinis. Pada infeksi tinggi terjadi broncheitis kronis, bila terjadi infeksi skunder terjadi broncho pnemonia sehingga gejala klinis terjadi sesak napas, kekurusan, leleran hidung, anemi dan bulu kasar (Camargo et al, 2010).Sanitasi kandang yang baik merupakan kunci pencegahan utama. Kandang ayam harus dikondisikan agar tidak becek, litter selalu kering, tidak menggumpal dan tidak lembap. Sanitasi peralatan peternakan juga harus selalu dilakukan. Populasi dalam 1 kandang juga harus diperhatikan, kandang yang terlalu padat dapat meningkatkan resiko infestasi cacing. Pemberian vitamin A dapat memberikan nilai tambah. Pengobatan yang efektif untuk mengeliminasi cacing Capillaria sp adalah dengan menggunakan albendazole. Namun dapat pula digunakan sediaan mebendazole ataupun thiabendazole. Pengobatan sebaiknya dilakukan secara serempak dalam satu kandang atau flok (Nadia et al, 2014).3.1.2 Fasciola gigantica
Sinyalemen hewan
Jenis hewan : Sapi
Ras
: Peranakan Ongole
Sex
: jantan
Umur/bb: >2 tahun/ 400 kg
Anamnesa : hendak diqurbankan untuk Idul AdhaPemeriksaan fisik : tidak ditemukan adanya kelainanDiagnosa tentatif : sehatPost mortem : pada ductus biliverus di hepar ditemukan cacing yang diduga Fasciola gigantica.
Identifikasi cacing : berdasarkan pemeriksaan melalui mikroskop cacing tersebut dipastikan Fasciola gigantica.Pemeriksaan feses : tidak ditemukan telur cacing, tidak ditemukan protozaDiagnosa : DistomatosisKlasifikasi cacing Fasciola gigantica adalah sebagai berikut :
Phyllum
: Plathyhelminthes
Class
: Trematoda
Famili
: Fasciolidae
Genus
: Fasciola
Spesies
: Fasciola gigantica
Cacing Fasciola gigantica memiliki ukuran: 25-75 x 5-12 mm, berwarna merah kecoklatan. Bagian bahu (daerah kepala yang terdapat pelebaran) tidak begitu nyata, ukuran telur adalah 156-197 x 90-104 m, berwarna coklat. Cacing ini memiliki habitat di saluran empedu. Inang definitif Fasciola gigantica adalah hewan ruminansia, babi, kuda, kelinci, anjing, kucing, kanguru, gajah dan manusia. Biasanya pada manusia dan kuda, cacing dewasa dapat ditemukan dalam paru-paru, dibawah kulit atau ditempat lain (Bendryman, 2012).Dalam siklus hidupnya Fasciola gigantica mengalami beberapa generasi yaitu telur, mirasidium, sporokis, redia, serkaria, metaserkaria, dan cacing dewasa. Metaserkaria merupakan stadium infektif yang banyak menginfeksi inang definitif, disamping itu juga dapat menginfeksi manusia pada semua kelompok umur (Bendryman, 2012).Telur yang dihasilkan masuk duodenum bersama sama cairan empedu dan keluar bersama feses inang definitifnya. Pertumbuhan dan penetasan telur Fasciola tergantung pada temperature dan kelembapan sekelilingnya. Pada temperature 26oC dan kelembapan optimum, telur akan menetas selama 10-12 hari dan menghasilkan larva stadium I (mirasidium). Mirasidium akan berenang mencari siput muda kemudian dengan menggunakan enzim proteolitik yang dikeluarkan untuk menembus jaringan tubuh siput, selanjutnya mirasidium melepaskan silia dan berkembang menjadi sporokista. Setiap sporokista akan membentuk redia dan berkembang maksimum, ukurannya 1-3 mm (panjang tubuh) dan gumpalan redia yang terbentuk di dalam sporokista akan keluar dan berkembang menjadi redia I dengan mempunyai saluran pencernaan seperti sekum dan mempunyai alat gerak. Didalam redia terdapat gumpalan redia yang mempunyai bentuk yang sama dengan redia I disebut redia anak. Redia anak selanjutnya berekembang menjadi serkaria. Bentuk serkaria menyerupai bentuk cacing dewasa dan serkaria akan keluar dari tubuh siput bila ada rangsangan sinar dan melalui alat pengeluaran siput tersebut. Kemudian serkaria berenang di dalam air, bila serkaria tidak segera termakan oleh inang definitif, maka serkaria akan menempel pada rumput, tepi kolam/sungai. Serkaria mempunyai kelenjar yang akan digunakan sebagai pembentuk dinding kista. Infeksi terjadi apabila inang defintif memakan rumput atau air yang tercemar/terkontaminasi oleh metaserkaria. Didalam duodenum, serkaria keluar dari kista, menembus dinding usus masuk rongga peritoneum, kemudian menembus kapsula hati (Estuningsih, 2004).Pengobatan distomatosis pada hewan yaitu menggunakan sediaan obat yang mampu membunuh larva Fasciola yang sedang migrasi dan cacing dewasa, serta tidak bersifat toksik pada jaringan misalnya Derivate Benzimedazol, terutama Albendazol, Triclabendazol dan Probendazol Febantel, memperoleh perhatian luas karena selain efektif terhadap cacingnematoda, senyawa tersebut juga efektif untuk membunuh cacing hati muda dan cacing dewasa.Niclofolan, Tordas, Dovenix. Obat yang mampu membunuh fascioliasis (bersifat flukicidal) dikemas sebagai garam N-methyl Glucaumine atau Meglumine 20%.Pengobatan distomatosis pada manusia, untuk kemanjuran dan keamanan yang tinggi digunakan Triclabendazole (Egaten) dalam dosis 10-12mg/kg. Tidak ada alternatif obat yang tersedia bagi manusia. Namun sediaan nitazoxanide dan bithionocol dapat dipertimbangkan juga untuk digunakan. Pencegahan distomatosis pada hewan dilakukan dengan tidak menggembalakan ternak pada pagi hari pada rumput yang masih ada embunnya, serta dengan menggunakan molusida untuk memberantas siput yang merupakan inang perantara Fasciola spp (Estuningsih, 2004).3.2 Protozoa
3.2.1 Plasmodium spSinyalemen hewan
Jenis hewan : Ayam Ras
: kampung Sex
: jantan
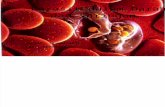
Umur/bb: 1 tahun/ 1.5 kgAnamnesa : diperoleh dari pasar hewan di SurabayaPemeriksaan fisik : selaput lendir warna rose, bulu tidak rontok, tidak diareDiagnosa tentatif : SehatPemeriksaan darah : ditemukan Plasmodium sp pada preparat ulas darah
Diagnosa : Malaria
Plasmodium adalah genus dari sporozoa atau protista mirip hewan yang tidak memiliki alat gerak. Plasmodium merupakan makhluk hidup renik dan merupakan patogen atau dapat menyebabkan penyakit yang merugikan. Plasmodium terdiri atas berbagai spesies yang dapat menyebabkan malaria. Skizogoni terjadi pada eritrosit bangsa burung, sedangkan gametogoni serta sporogoni terjadi di dalam saluran pencernaan nyamuk (Merchant, 2006).
Plasmodium morfologinya memiliki bentuk gametosit bundar, mempunyai pigment granule yang relatif besar. Bentuk skizon bundar, atau tidak beraturan dan menghasilkan 3-8 merozoit. Siklus skizogoni 36 jam. Stadium eksoeritrositik terjadi pada sel endotel dan sel RES pada lien, otak dan liver (Merchant, 2006)..Beberapa spesies plasmodium yang menyebabkan penyakit malaria adalah Plasmodium ovale, Plasmodium malariae, Plasmodium vivax, Plasmodium falciparum. Dari beberapa spesies dari plasmodium ternyata spesies Plasmodium falciparum-lah yang sangat berbahaya dengan menimbulkan penyakit malaria. Sesuai literatur gambaran Plasmodium seperti dibawah ini (Mechant, 2006).Plasmodium bereproduksi dengan dua cara yaitu seksual dan aseksual. Reproduksi aseksual plasmodium terjadi didalam tubuh hewan, sedangkan reproduksi seksualnya ada didalam tubuh nyamuk Anopheles. Siklus asexual yaitu sporozoit infeksius dari kelenjar ludah nyamuk Anopheles betina masuk ke dalam darah manusia melalui gigitan nyamuk. Dalam waktu tiga puluh menit sporozoit masuk kedalam sel sel parenkim hati dan dimulai stadium eksoeritrositik. Di dalam sel hati parasit akan tumbuh menjadi skizon dan berkembang menjadi merozoit. Sel hati yang mengandung parasit akan pecah dan merozoit keluar dengan bebas, sebagian akan difagositosis. Karena prosesnya terjadi sebelum memasuki eritrosit maka disebut stadium preeritrositik atau eksoerikrositik. Siklus eriktrositik dimulai saat merozoit memasuki sel sel darah merah. Parasit tampak sebagai kromatin kecil, di kelilingi oleh sitoplasma yang membesar, bentuk tidak teratur dan mulai membentuk tropozoit, tropozoit berkembang menjadi skizon muda, berkembang menjadi skizon matang dan membelah banyak menjadi merozoit. Sel darah merah yang pecah mengeluarkan merozoit, pigmen serta sisa sel keluar dan memasuki plasma darah. Parasit memasuki sel darah merah lainnya untuk mengulang siklus skizogoni. Beberapa merozoit memasuki eritrosit dan membentuk skizon serta lainnya membentuk gametosit yaitu bentuk seksual (Merchant, 2006).
Siklus sexual yaitu terjadi dalam tubuh nyamuk. Gametosit yang bersama darah tidak di cerna oleh sel sel lain. Pada makrogamet (jantan) kromatin membagi menjadi 6 8 inti yang bergerak ke pinggir parasit. Pada tempat tersebut beberapa filamen terbentuk seperti cambuk dan bergerak aktif disebut mikrogamet. Pembuahan terjadi karena masuknya mikrogamet ke dalam makrogamet untuk membentuk zigot. Zigot berubah bentuk menjadi ookinet yang dapat menembus lapisan epitel dan membran basal dinding lambung, ookinet berubah menjadi ookista. Di dalam ookista dibentuk sporozoit, menembus kelenjar nyamuk dan bila nyamuk menggigit manusia maka sporozoit masuk ke dalam darah dan mulailah siklus pre eritrositik (Merchant, 2006). Diagnosa yaitu malaria ayam (Suwanti, 2012).
Malaria adalah penyakit menular yang ditularkan oleh nyamuk Aedes Aegypti betina. Malaria disebabkan oleh parasit Plasmodium yang berkembang biak di tubuh nyamuk lalu menularkannya pada manusia melalui darah. Penyakit malaria adalah penyakit menular yang disebabkan oleh Plasmodium dan ditularkan melalui gigitan nyamuk Anopheles betina. Penyakit malaria ini dapat menyerang siapa saja terutama penduduk yang tinggal di daerah di mana tempat tersebut merupakan tempat yang sesuai dengan kebutuhan nyamuk untuk berkembang biak. Tempat perkembangbiakan nyamuk Anopheles adalah genangan-genangan air, baik air tawar maupun air payau, tergantung dari jenis nyamuknya. Air ini tidak boleh tercemar harus selalu berhubungan dengan tanah. Berdasarkan ukuran, lamanya air (genangan air tetap atau sementara) dan macam tempat air, klasifikasi genangan air dibedakan atas genangan air besar dan genangan air kecil. Malaria menjadi penyakit endemik di beberapa daerah di dunia, seperti Afrika, India, Bangladesh dan juga di Indonesia. Di Indonesia, malaria menjadi endemik di Papua dan Mamuju, Sulawesi Selatan. Pengobatan dapat diberikan seperti Sulfaquinoxaline (0,005%) atau Sulfadimetoxine (0,0025%) dicampur dalam makanan atau air minum. Bisa juga digunakan Pyrimethamine (0,00005%) atau Clopidol (0,0125 0,025%) (Suwanti, 2012)3.2.2 Eimeria spSinyalemen hewan
Jenis hewan : Ayam Ras
: kampung Sex
: jantan
Umur/bb: 1 tahun/ 1 kgAnamnesa : diperoleh dari pasar hewan di SurabayaPemeriksaan fisik : diareDiagnosa tentatif : Koksidiosis, Malaria, HelminthiasisPemeriksaan darah : ditemukan Plasmodium sp pada preparat ulas darah
Diagnosa : KoksidiosisKlasifikasi Eimeria sp adalah sebagai berikut :Phylum: Apicomplexa
Class
: Sporozoa
Sub class: Coceidia
Ordo
: Eucoceidia
Sub ordo: Eimeriidae
Familia: Eimeriidae
Genus
: Eimeria
Spesies: Eimeria sp
Eimeria sp. merupakan protozoa luminal yang sering menginfeksi unggas dan berbagai jenis aves lainnya. Eimeria bermultiplikasi pada saluran pencernaan dan menyebabkan kerusakan jaringan sehingga menyebabkan ganguan pada pencernaan dan penyerapan sari-sari makanan (Songer, 2005).
Secara keseluruhan ada 12 jenis Eimeria sp. yang dibedakan berdasarkan lokasi lesi, bentuk lesi yang ditimbulkan, bentuk dan ukuran berbagai stadium perkembangannya (ookista, schizont, merozoit), lokasi Eimeria sp. di jaringan dan waktu sporulasinya. Dari seluruh jenis Eimeria sp. yang ada tersebut, 9 diantara dapat menginfeksi ayam, yaitu E. acervulina, E. brunetti, E.maxima, E. Necatrix, E. mivati, E. mitis, E. praecox, E. tennela dan E. hagani. Namun dari jenis-jenis Eimeria yang menginfeksi ayam tersebut hanya 5 jenis yang bersifat patogen, yaitu E.tenella, E. maxima, E. acervulina dan E. brunetti. (Songer, 2005)Eimeria tenella merupakan jenis yang paling patogen dibandingkan spesies Eimeria lainnya. Eimeria tenella ini menyerang saluran pencernaan pada ayam, terutama pada ayam yang berusia muda. Infeksi terjadi akibat hospes menelan ookista infektif yaitu ookista yang telah mengalami sporulasi. Ookista dapat bersporulasi tergantung dari pH, kelembapan dan ketersediaan oksigen. Hewan yang terinfeksi maupun yang telah sembuh dapat mengeluarkan ookista melalui tinjanya (Suwanti, 2012).Penyakit yang ditimbulkan akibat infek dari Eimeria tenella adalah koksidiosis. Koksidiosis merupakan penyakit intestinal akut ataupun kronis yang ditandai dengan gejala diare berdarah dan kekurusan (Bagus et all, 2007).Gambar 3.5 Morfologi Eimeria sp.. Kiri: gambaran mikroskopis Eimeria sp.; Kanan: struktur morfologi skematis Eimeria sp.
Secara umum ookista berbentuk bulat,ovoid atau elips tergantung pada spesiesnya. Panjang ookista berkisar dari 16-29 mikron dan lebarnya sekitar 6-25 mikron. Ookista yang telah bersporulasi mengandung sejumlah sporokista dan sejumlah sporozoit yang jumlahnya berbeda tergantung jenisnya (Bagus, 2007).
Genus Eimeria sp. umumnya mengalami perkembangan siklus hidup secara lengkap didalam dan diluar tubuh induk semangnya dan dapat dibagi menjadi siklus aseksual dan siklus seksual. Siklus hidup ini dikenal dengan tiga stadium yaitu: stadium skizogoni, gametogoni dan sporogoni. Siklus aseksual merupakan stadium skizogoni, siklus seksual meliputi stadium gametogoni. Sedangkan sporogoni adalah stadium pembentukan spora (Suwanti, 2012).
Gambar 3.6 Skema Siklus Hidup Eimeria tenella
Siklus aseksual dimulai dari ookista yang dikeluarkan bersama-sama tinja dari ayam yang terinfeksi. Pada saat itu, ookista belum infektif tetapi pada kondisi kelembapan dan kehangatan yang optimal (25-290C) dan oksigen yang cukup ookista E. tenella akan mengalami sporulasi dalam waktu 24-48 jam dalam suhu kamar sampai terbentuk sporokista (Merchant, 2006). Ookista yang telah bersporulasi infektif tersebut tertelan oleh hospes kedalam saluran cerna dan kemudian di ventrikulus ookista akan pecah dan sporokista keluar. Sporokista kemudian masuk duodenum. Di dalam duodenum, oleh karena pengaruh trypsin dan cairan empedu, bagian ujung sporokista akan menjadi lunak dan aktif kemudian sporozoit keluar kemudian masuk kedalam epitel usus dan membulat , melakukan banyak pembelahan inti membentuk schizon yang berisi merozoit (schizon generasi pertama) merozoit pecah, terbebas bersamaan dengan pecahnya sel hospes selanjutnya merozoit yang terbebas akan menginfeksi sel epitel usus yang masih utuh kemudian membulat, berkembang biak menjadi schizon generasi kedua. Skizon generasi kedua ini membentuk merozoit generasi kedua yang kemudian menjadi skizon lagi. Siklus ini diulang sampai terbentuk merozoit generasi ketiga sehingga menyebabkan kerusakan mukosa usus (Packer, 2006). Siklus seksual berlangsung setelah melalui siklus aseksual yaitu siklus yang ditandai dengan dimulainya mikrogametosit dan makrogametosit. Setelah mikrogamet dan makrogamet bertemu didalam usus, maka akan terbentuk zigot. Dari zigot dibentuk ookista. Ookista ini akan keluar dari tubuh bersama tinja dan membentuk sporokista, masing-masing sporokista berisi dua sporozoit. Jika ookista yang telah bersporulasi tersebut tertelan oleh unggas yang rentan maka terjadi infeksi. Waktu yang dibutuhkan untuk siklus hidup Eimeria pada unggas sangat bervariasi, berkisar antara 1-5 hari (Bagus, 2007).Koksidiosis pada sekum oleh E. tenella paling sering terjadi pada ayam muda berumur 4 minggu, karena umur tersebut adalah umur yang paling peka. Ayam yang berumur 1-2 minggu lebih resisten, walaupun demikian E. tenella dapat juga menginfeksi ayam yang sudah tua. Ayam yang sudah tua umumnya memiliki kekebalan imunitas akibat sudah terinfeksi sebelumnya. Pada umumnya koksidiosis sekum terjadi akibat infeksi berat dalam waktu yang relatif pendek tidak lebih dari 72 jam. Pada ayam umur 1-2 minggu diperlukan 200.000 ookista untuk menyebabkan kematian, dan diperlukan 50.000-100.000 ookista untuk menyebabkan kematian pada ayam yang berumur lebih tua (Packer, 2006).
Pada kelompok ayam, mula-mula gejala terlihat 72 jam setelah infeksi. Ayam terkulai, anoreksia, berkelompok agar badannya hangat dan sekitar hari ke-4 sesudah infeksi terdapat darah didalam tinja. Darah paling banyak ditemukan pada hari ke-5 dan ke-6 sesudah infeksi dan menjelang hari ke-8 atau ke09 ayam sudah mati atau dalam tahap persembuhan. Kematian paling tinggi terjadi antara hari ke-4 dan ke-6 karena kehilangan banyak darah. Kematian kadang-kadang terjadi tanpa diduga. Jika ayam sembuh dari penyakit akut maka penyakit akan bersifat kronis (Suprihati, 2000).Koksidiosis dapat dicegah dengan melakukan sanitasi, pengelolaan liter dan pengelolaan sampah yang baik. Hindari kondisi liter yang basah terutama pada bagian bawah tempat air minum. Ookista koksidia sangat tahan terhadap kondisi lingkungan yang keras dan desinfektan yang umum digunakan. Usaha-usaha pengendalian dan pencegahan terhadap koksidiosis yang telah dilakukan adalah dengan pemberian obat-obatan (koksidiostat) pada pakan dan minuman serta dengan vaksinasi Beberapa vaksin yang pernah dicobakan dalam skala laboratorium adalah vaksin bentuk ookista utuh. Pemberian vaksinasi koksidiosis pada unggas dilakukan dengan pemberian ookista utuh dengan dosis rendah dan berulang-ulang. Keberhasilan program suatu vaksinasi disamping ditentukan jenis vaksin (macam-macam strain dan bentuk), juga antara lain ditentukan waktu pemberian yang tepat (Suprihati, 2000).Penyakit koksidiosis biasanya menyerang ayam pada umur muda, dan menyebabkan kematian yang tinggi. Pemberian vaksin bentuk ookista padaumur muda khususnya di bawah 2 minggu tidak menghasilkan sistem kekebalan yang baik, karena pencernaan ayam tidak mampu untuk memecah secara sempurna. Untuk mengatasi pemberian vaksin yang dapat dicerna dan menimbulkan kekebalan yang baik pada ayam diperlukan alternatif bentuk bahan vaksin yang akan diberikan. Sporokista sebagai bagian dari ookista yang mampu dicerna ayam muda karena mempunyai dinding yang lebih tipis dibandingkan dengan ookista, sehingga sporokista dapat dijadikan bahan alternatif vaksin yang dapat memberikan kekebalan bagi ayam muda sebelum terserang penyakit koksidiosis. Penelitian tentang pemberian sporokista sebagai bahan vaksin belum pernah dilaporkan sehingga perlu dilakukan penelitian pengaruh pemberian sporokista Eimeria tenella terhadap histopatologi sekum ayam sebelum dilakukan penelitian lanjut untuk pengembangan penggunaan sporokista sebagai bahan vaksin koksidiosis pada ayam (Suprihati, 2000).
3.3 Arhropoda
3.3.1 Ctenocephalides canisSinyalemen hewan
Jenis hewan : Kucing Ras
: lokal Sex
: jantan
Umur/bb: >1 tahun/ 2 kgAnamnesa : sering menggaruk seluruh tubuh,Pemeriksaan fisik : ditemukan manifestasi pinjal, kulit kemerahan dibeberapa area di abdomen dan punggung, rambut kusam, tidak diare Diagnosa tentatif : Manifestasi pinjal, suspect helmintiasisPemeriksaan identifikasi pinjal : C. canisPemeriksaan feses : tidak ditemukan protozoa dan telur cacingDiagnosa : dermatitis akibat manifestasi pinjal C. canis
Klasifikasi C. canis adalah sebagai berikut :Kingdom: Animalia
Phylum
: Arthropoda
Class
: Insecta
Order
: Siphonaptera
Family
: Pulicidae
Genus
: Ctenocephalides
Species
: Ctenocephalides canisTubuh pinjal dewasa memiliki ukuran panjang 1,5- 4 mm. Tubuhnya mempunyai kulit dengan lapisan kitin tebal serta berwarna coklat tua. Tubuh dan kaki tertutup oleh rambut-rambut kasar. Pinjal memiliki tiga pasang kaki yang panjang, berkembang sangat baik dan kuat, dan digunakan untuk lari dan meloncat. Memiliki kepala kecil, berbentuk segitigadengan sepasang simple eyes yang terdiri atas satu lensa dan 3 ruas antenna sangat pendek dan terembunyipada lekuk antenna dibelakang mata. Mulut megarah ke bawah, sesuai dengan fungsinya untuk menyobek dan menghisap.pinjal jantandan betina menghisap darah. kepala Ctenocephalides canis memiliki duri (spina) yang besar disebut sebagai genal comb atau genal ctenidia. Bagian thoraks terdiri dari 3 ruas yaitu prothoraks, mesothoraks, dan metathoraks. Pada species C. felis pada sisi posterior prothoraks terdapat sederet duri besar yang disebut pronotal comb keberadaan comb ini penting untuk identifikasi pinjal. (Hastutik, 2014).Bagian abdomen terdiri dari 10 segmen. Pada segmen ke 9 pada jantan maupun betina didapatkan lempeng cembung (dorsal plate) yag mempunyai rambut sensoris (membantu alat peraba)disebut sensilium atau pygidium. Pada pinjal jantan penis (aedeagus) berbentuk lingkaran dan terdiri dari kitin. Pinjal betina memiliki kantung sperma (spermateca) pada segmen ke 6-8 dari abdomen yang bentuknya spesifik untuk setiap spesies (Hastutik, 2014).. Siklus hidup pinjal berdasar tingkatan metamorfosisnya termasuk complete metamorphosis atau disebut sebagai holometabulous yang diawali dengan stadium telur, larva, pupa dan dewasa. Pinjal betina meletakkan telurnya 20 butir setiap kali bertelur mencapai 400 hingga 500 selama hidupnya. Telurnya berbentuk ovale dengan ukuran 0,5 mm berwarna putih kekuningan, diletakkan pada debu atau tempat kotor atau akan diletakkan pada hospes.. larva akan menetas setela 2 hingga 16 hari, larva berwarna kekuningan dan sangat aktif menghindari sinar. Larva memiliki bentuk memanjang silindris terdiri dari 3 segmen thoraks, dan 10 segmen abdomen yang dilengkapi dengan bulu-bulu panjang, tidak memiliki kaki. Pada segmen abdomen terakhir terdapat 2 tonjolan kait yang diesbut anal struts berfungsi sebagai pemegang substrat dan lokomosi. Larva mengalami 3 kali moulting (pergantian kulit) sebelum menjadi pupa. Periode larva berlangsung selama 7 hingga 10 hari atau lebih tergantung suhu dan kelembaban. Larva dewasa atau mature memiliki panjang sekitar 6 mm kemudian menggulung atau mengkerut hingga berukuran sekitar 4x2 mm dan mengalamiperubahan menjadi pupa/ coccon. Stadium pupa berlangsung selama 10 sampai 17 hari pada suhu yang sesuai. Pupa merupakan tahapan dormant (tidak aktif) berada dalam coccon terbungkus debris maupun debu (Hastutik, 2014)..
3.3.2 Rhipicephalus sanguineusSinyalemen hewan
Jenis hewan : Anjing Ras
: lokal Sex
: jantan
Umur/bb: >1 tahun/ 5 kgAnamnesa : sering menggaruk seluruh tubuhPemeriksaan fisik : Ditemukan caplak pada kulit di area punggung dan rambut, rambut mudah rontok, kulit kemerahan, tidak diare Diagnosa tentatif : dermatitis akibat manifestasi caplak, suspect helmintiasisPemeriksaan identifikasi caplak : R. Sanguineus
Pemeriksaan feses : negatif telur cacing dan protozoa.Pemeriksaan darah : negatif protozoa darahDiagnosa : dermatitis akibat manifestasi caplak R. Sanguineus
Klasifikasi Rhipicephalus sanguineus adalah sebagai berikut
Kingdom: AnimaliaPhilum
: Arthropoda
Kelas
: Arachinida
Sub Kelas: Parasitiformes
Ordo
: Parasitiformes
Sub Ordo: Metastigmata
Family
: Ixodidae
Genus
: RhipicephalusSpesies
: R. sanguineus
Rhipicephalus sanguineus disebut juga Brown Dog Tick, merupakan caplak yang menjadi ektoparasit pada sapi, kambing, domba dan anjing denganpenyebaran luas terutama pada daerah beriklim tropis. Bentuk kepala dari Rhipicephalus sanguineus yaitu cephalothorax (bagian kepala dan thorax bersatu), memiliki capitulum yang terdapat pada bagian anterior tubuhnya. Scutum (sejenis pelinding keras) terdapat pada bagian dorsal tubuh yang terbuat dari bahan chitine, Rhipicephalus sanguineus betina dewasa mempunyai scutum lebih kecil dari pada Rhipicephalus sanguineus jantan dan terdapat di sepertiga bagian anterior tubuhnya. Festoon merupakan bentuk-bentuk persegi atau bujur sangkar sepanjang tepi caudal dari tubuh Rhipicephalus sanguineus (Hastutik, 2014).
Rhipicephalus sanguineus betina dewasa mempunyai ukuran tubuh lebih besar daripada Rhipicephalus sanguineus jantan yaitu dengan panjang 1,24-11 mm dan lebar 4-7 mm sedangkan pada jantan memiliki panjang tubuh 1,7-4,4 mm dengan lebar 1,24-1,55 mm (Hastutik, 2014).
Bagian kepala Rhipicephalus sanguineus terdapat mata di sebelah lateral, berbentuk pipih atau setengah lingkaran yang memanjang, pada yang jantan, mata terletak pada bagian atas dari coxa I dan pada yang betina terletak di bagian atas dari lebarnya scutum. Rhipicephalus sanguineus memiliki mulut yang dilengkapi dengan palpus dan hypostome dan juga terdapat sejenis gigi yaitu chelicerae (Hastutik, 2014).
Bagian kaki Rhipicephalus sanguineuspada bentuk larva (seed tick atau caplak biji) mempunyai 3 pasang kaki dan pada bentuk nympha dan dewasa mempunyai empat pasang kaki. Bagian-bagian kaki dari proksimal ke distal adalah : coxa trochanter premur femur tibia pretarsus tarsus. Ujung segmen yang bulat panjang disebut petiole dan mengandung kait dan pulvili.
Rhipicephalus sanguineus mempunyai siklus hidup Three Host Tick dan dapat bertahan pada temperature yang berkisar antara 15-30 C dengan temperature minimum 10 C dan maksimum 40 C. siklus hidup sempurna dapat berlangsung pada tempat yang bersuhu 20-30 C. Banyaknya telur yang dikeluarkan oleh Rhipicephalus sanguineus betina dewasa menurut Nuttal (1915) 3900 butir/ekor/hari, Monnig (1938) 2000-3900 butir dan Hixon (1942) 1600-1800 butir. Masa pengeraman telur 24-70 hari dan menurut De Yasso (1938) berkisar antara 21-25 hari (Soulsby, 2002).
Setelah menetas larva bersembunyi dan menunggu kesempatan yang baik untuk mendapatkan inangnya mesalnya anjing. Jika mendapat makanan yang cukup, maka pergantian kulit ke bentuk nympha memerlukan 5-23 hari. Nympha akan mencari inang dan akan menghisap darah selama 4-9 hari. Pergantian kulit dari nympha menjadi bentuk dewasa menurut Christopheres diperlukan 15 hari, menurut Nuttall 11 hari dan menurut Hocher, Bis Hipp, Hood yaitu 12-73 hari (Hastutik, 2014)..
Setelah menjadi bentuk dewasa baru dapat dibedakan antara Rhipicephalus sanguineus betina dan Rhipicephalus sanguineus jantan. Rhipicephalus sanguineus betina akan mencari kemudian merayap pada tempat yang terlindung pada tubuh hewan dan menghisap darah sehingga tubuh Rhipicephalus sanguineus betina membesar dan siap untuk bertelur. Waktu yang digunakan untuk menghisap darah berkisar antara 6-15 hari. Secara keseluruhan waktu yang diperlukan dari mulai telur sampai bentuk dewasa yang siap bertelur diperlukan 40-200 hari (Soulsby, 2002).
Predileksinya pada daun telinga, lipatan kaki depan dan belakang, pangkal ekor bagian bawah dan sela-sela jari inang. Rhipicephalus sanguineus dikenal juga sebagai caplak coklat pada anjing di Asia dan Eropa, Rhipicephalus sanguineus merupakan penyebar parasit darah yaitu Ehrlichia canis dan B. canis pada anjing. Kerugiaan ekonomi yang dihasilkan akibat infestasi Rhipicephalus sanguineus yaitu menurunnya kondisi tubuh sehingga berpengaruh pada pertambahan berat badan. Akibat infestasi Rhipicephalus sanguineus dapat menyebabkan terjadinya penurunan jumlah sel darah merah, serum protein dan haemoglobin (Hastutik, 2014)..BAB 4. PENUTUP4.1 Kesimpulan
Hasil identifikasi parasit di Laboratorium Parasitologi, sebagai berikut :
1. Helmintha. Jenis hewan: Ayam kampungSampel
: FesesHasil
: Telur cacing Capillaria spb. Jenis hewan: Sapi POSampel
: Hepar (saluran empedu)Hasil
: Cacing F. gigantica2. Protozoaa. Jenis hewan: Ayam kampungSampel
: DarahHasil
: Plasmodium spb. Jenis hewan: Ayam kampungSampel
: Feses
Hasil
: ookista Eimeria sp3. Arthropodac. Jenis hewan: Kucing lokalSampel
: KulitHasil
: Ctenocephalides canisd. Jenis hewan: Anjing lokalSampel
: KulitHasil
: Rhipicephalus sanguineus
Gambar 3.1 (kiri) : Telur Capillaria sp pada sampel feses yang diperoleh melalui metode sedimentasi, dilihat pada mikroskop perbesaran 400x.
Gambar 3.1 (kanan) : Morfologi telur Capillaria sp berdasarkan literatur (Bendryman,2012).
Gambar 3.2 kiri : Cacing dewasa F. gigantica bagian posterior
Gambar 3.2 kanan : Cacing dewasa F. gigantica bagian anterior
(Perbesaran 40x)
Gambar 3.3 Plasmodium sp.
Gambarr 3.4 Ookista Eimeria sp.
Gambarr 3.7 C. canis
Gambar 3.7 C. canis
16