[The role of osteopontin in cardiovascular diseases]
-
Upload
independent -
Category
Documents
-
view
3 -
download
0
Transcript of [The role of osteopontin in cardiovascular diseases]
1
1
ARTYKUŁ REDAKCYJNY
Rola osteopontyny w chorobach sercowo-naczyniowych
WOJCIECH WITKIEWICZ, AGNIESZKA CZYŻEWSKA-BUCZYŃSKA, SEBASTIAN
BAŁASZ, JAN JANUSZ GNUS
Wojewódzki Szpital Specjalistyczny we Wrocławiu, Ośrodek Badawczo-Rozwojowy,
kierownik: prof. dr hab. med. W. Witkiewicz
Rola osteopontyny w chorobach sercowo-naczyniowych
Witkiewicz W., Czyżewska-Buczyńska A., Bałasz S., Gnus J.J.
Wojewódzki Szpital Specjalistyczny we Wrocławiu, Ośrodek Badawczo-Rozwojowy
Osteopontyna (OPN) jest fosforylowaną kwaśną glikoproteiną wydzielaną przez wiele
komórek, m.in. przez komórki układu odpornościowego, nabłonkowe, mięśni gładkich,
osteoblasty, osteoklasty oraz komórki nowotworowe. Dzięki charakterystycznej strukturze
cząsteczkowej, zawierającej domeny wiążące integryny, OPN ma zdolność do wiązania się z
wieloma receptorami integrynowymi, dzięki czemu białko to ma znaczenie w procesie
aktywacji, adhezji i migracji wielu komórek. Osteopontyna jest białkiem wielofunkcyjnym.
Bierze udział w regulacji procesów zapalnych, uczestniczy w procesie mineralizacji tkanek, a
także w nowotworzeniu. Ze względu na szeroki zakres działania, osteopontyna jest istotnym
czynnikiem, który bierze udział w patogenezie chorób sercowo-naczyniowych, w tym w
miażdżycy naczyń i w rozwoju tętniaka aorty brzusznej.
Słowa kluczowe: osteopontyna, zapalenie, miażdżyca, tętniak aorty brzusznej, choroby
sercowo-naczyniowe
The role of osteopontin in cardiovascular diseases
Witkiewicz W., Czyżewska-Buczyńska A., Bałasz S., Gnus J.J.,
Regional Specialist Hospital in Wroclaw, Poland, Research and Development Centre
2
2
Osteopontin (OPN) is an acid phosphorylated glycoprotein secreted by cells of the immune
system, epithelial cells, smooth muscle cells, osteoblasts, osteoclasts, tumor cells and many
more. Osteopontin is a multifunctional protein. Due to characteristic molecular structure
containing integrin bining domains, OPN can interact with several integrin receptors, thus it
play a role in activation, adhesion and migration of many cell types in such processes as
inflammation, tissue mineralization and tumor genesis. This broad biological action of
osteopontin underlie its presumed role in the pathogenesis of cardiovascular diseases,
including atherosclerosis and abdominal aortic aneurysm formation.
Key words: osteopontin, inflammation, atherosclerosis, abdominal aortic aneurysm,
cardiovascular disease
Osteopontyna – OPN (ang. osteopontin) jest białkiem należącym do rodziny małych,
wiążących integryny glikoprotein – SIBLING (ang. small integrin-binding ligand N-linked
glycoprotein), do której należą również kostne sialoproteiny, białka macierzy zębiny,
sialofosfoproteiny zębiny oraz glikofosfoproteiny macierzy zewnątrzkomórkowej [9].
Osteopontynę po raz pierwszy zidentyfikowano ponad 30 lat temu, jako kostną sialoproteinę
i opisano jako białko macierzy stanowiące swoisty łącznik pomiędzy komórkami kości a
hydroksyapatytem. W piśmiennictwie OPN nazywana jest fosfoproteiną o masie
cząsteczkowej 44 kDa, sialoproteiną 1 oraz wydzielniczą fosfoproteiną 1 (SSP-1), ze
względu na jej identyfikację w nadsączu komórek hodowanych w warunkach in vitro. Ze
względu na zdolność do wczesnej aktywacji limfocytów T, osteopontyna nazywana jest
cząsteczką Eta-1. W związku z wykryciem tego białka w moczu, OPN nazywana jest także
uropontyną [45].
W warunkach fizjologicznych osteopontyna jest wytwarzana przez wiele typów komórek,
takich jak: osteoblasty, osteoklasty, komórki nabłonkowe piersi, komórki nerwowe, komórki
śródbłonka naczyń, oraz komórki układu immunologicznego (limfocyty T i B, komórki NK,
komórki Kupffera, makrofagi, komórki dendrytyczne, neutrofile, mastocyty). Białko to
wykrywa się w wielu tkankach organizmu ludzkiego (mózgu, nerkach, wątrobie, płucach,
drogach pokarmowych, kościach, zębach, stawach, sercu oraz w tkance tłuszczowej).
3
3
Osteopontyna występuje również w płynach ustrojowych (we krwi, moczu, mleku, nasieniu i
żółci) [4, 28, 37].
Osteopontyna jest białkiem wielofunkcyjnym. Stanowi składnik macierzy
zewnątrzkomórkowej. Uznawana jest także za cytokinę/hormon, ze względu na zdolność do
indukowania szlaku przekazywania sygnałów komórkowych. Liczne badania potwierdziły jej
udział w wielu procesach, zarówno fizjologicznych, jak i patologicznych, takich jak: kontrola
biomineralizacji, proces przebudowy kości, angiogeneza, powstawanie kamieni nerkowych,
nowotworzenie, choroby autoimmunologiczne, reakcje zapalne, czy też aterogeneza [46].
Pomimo wielu danych dotyczących roli OPN w organizmie człowieka, nie opisano
dotychczas dokładnych mechanizmów regulacji ekspresji i aktywności tego białka w
odniesieniu do chorób sercowo-naczyniowych.
Niniejsza praca stanowi próbę przybliżenia różnorodnych funkcji osteopontyny z
uwzględnieniem jej specyficznej struktury cząsteczkowej i udziału w patogenezie chorób
sercowo-naczyniowych, w tym w rozwoju tętniaka aorty brzusznej.
Struktura osteopontyny
Gen ludzkiej osteopontyny zlokalizowany jest na długim ramieniu chromosomu 4 (4q21-
4q25). Składa się z siedmiu egzonów. Regulacja ekspresji genu OPN przebiega na kilku
poziomach i może różnić się w zależności od typu komórek. W promotorze genu
osteopontyny zlokalizowano wiele sekwencji regulatorowych, obejmujących m.in. kasety
TATA i GC, odwróconą kasetę CCAAT, a także sekwencje wiążące czynniki transkrypcyjne,
tj. AP1, PEA3, E2A, i Ets-1. Opisano również unikalny mechanizm regulacji transkrypcji
genu OPN w komórkach makrofagów, obejmujący heterogenne białka z rodziny jądrowych
rybonukleoprotein (białka wiążące RNA związane z chromatyną) [10].
Pozytywną rolę czynników transkrypcyjnych, tj. β-katenina/Lef-1, AP-1 oraz Ets, w
stymulacji transkrypcji genu osteopontyny potwierdzono w komórkach szczura. Wykazano
ponadto, że występowanie wymienionych czynników transkrypcyjnych przynajmniej
częściowo odpowiada za nadekspresję OPN w komórkach raka piersi [7]. W regulacji
ekspresji genu OPN uczestniczy również wiele substancji, w tym m.in. hormony (witamina
D3, angiotensyna II, glikokortykosteroidy, estrogen), cytokiny prozapalne (IL-1β, IL-6, IFN-
γ, TNF-α), czynniki wzrostu (m.in. płytkowy czynnik wzrostu), a także utlenione cząsteczki
LDL (oxLDL) oraz estry forbolu [6, 19, 25].
4
4
Osteopontyna jest kwaśną glikoproteiną, zbudowaną z około 300 aminokwasów. W
organizmie ludzkim występuje jako białko związane z macierzą międzykomórkową.
Funkcjonuje także jako cytokina. Ze względu na wiele modyfikacji potranslacyjnych, takich
jak fosforylacja, glikozylacja, siarkowanie, sjalowanie oraz proteoliza, jej ciężar
cząsteczkowy waha się w granicach 40–80 kDa. W reakcji katalizowanej przez
transglutaminazę powstaje również polimeryczna forma osteopontyny, o masie
cząsteczkowej około 200 kDa [15]. Uważa się, że w różnych typach komórek dochodzi do
potranslacyjnych modyfikacji OPN, co leży u podłoża różnic w fizjologicznej funkcji, jaką
pełni to białko w różnych tkankach organizmu [21].
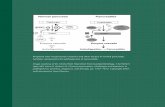
Osteopontyna zawiera kilka miejsc wiążących receptory integrynowe, dzięki czemu może
uczestniczyć w adhezji oraz migracji wielu komórek. W strukturze OPN wyróżnia się
ponadto domeny podlegające proteolitycznemu cięciu, co ma znaczenie w regulacji
biologicznej aktywności tego białka, (ryc. 1).
Domeny wykazujące zdolność wiązania receptorów integrynowych obejmują: motyw RGD,
złożony z trzech aminokwasów – arginina-glicyna-kwas asparaginowy, wiążący m.in.
receptory αVβ3, αVβ1, α5β1, α8β1 i αVβ5, sekwencję seryna-walina-walina-tyrozyna-kwas
glutaminowy-leucyna-arginina (SVVYGLR), rozpoznającą integryny α9β1, α4β1 i α4β7, a
także motyw ELVTDFTDLPAT, mający zdolność do wiązania α4β1 [39]. Wykazano, że
domena SVVYGLR jest zlokalizowana w krypcie. Do uzyskania pełnej zdolności wiązania
integryn w obrębie tej domeny konieczne jest proteolityczne cięcie cząsteczki OPN przez
trombinę [43, 49].
Osteopontyna stanowi także substrat dla wielu metaloproteinaz macierzy MMP (ang.
matrix metaloproteinase), w tym m.in. dla MMP-2, MMP-3, MMP-7, MMP-9 i MMP-12 [1,
17]. Badania wykazały, że enzymy te mogą rozcinać cząsteczkę OPN w wielu miejscach
(ryc. 1), np. w obrębie sekwencji SVVYGLR, niszcząc domenę wiążącą integryny.
Aktywność metaloproteinaz może zatem wpływać na zmianę powinowactwa OPN do
receptorów typu α4α9, tym samym regulując aktywność tego białka i funkcje wielu komórek.
Fragmenty N-końcowe OPN, powstające po proteolitycznym odcięciu przez trombinę
wykazują większą zdolność do indukowania adhezji komórek, w porównaniu z pełną
cząsteczką OPN. Sugeruje się, że może to wynikać ze zmian konformacyjnych, jakie
zachodzą przy tym w obrębie domeny RGD [41].
Domena SVVYGLR odsłonięta po cięciu cząsteczki OPN przez trombinę również wykazuje
zdolność indukowania adhezji oraz migracji komórek poprzez receptory α4 i α9 [42].
5
5
Aktywność metaloproteinaz powoduje z kolei utratę zdolności do wiązania integryn α9 przez
nowopowstały fragment N-końcowy [49, 50]. C-końcowe fragmenty osteopontyny
generowane przez trombinę i MMP nie zawierają żadnej domeny wiążącej integryny,
immobilizowane nie mają zdolności do indukowania adhezji komórek. Co więcej, jak
wskazują wyniki badań z wykorzystaniem linii komórkowych monocytów, fragmenty te
hamują mediowaną przez OPN adhezję i migrację komórek [11, 42]. Ostatnie dane wskazują,
że polimeryzacja cząsteczek OPN w reakcji katalizowanej przez transglutaminazę 2 zwiększa
z kolei zdolności adhezyjne osteopontyny przez receptor integrynowy α9β1, niezależnie od
domeny SVVYGLR [31].
Osteopontyna w swej strukturze zawiera miejsce wiązania receptora kwasu hialuronowego
(CD44) (ryc. 1). Domena ta zlokalizowana jest w obrębie fragmentu C-końcowego
cząsteczki OPN generowanego przez trombinę i zdolna jest do wiązania pewnych izoform
CD44, m.in. CD44v3-v6 i v7, stymulując w ludzkich komórkach nowotworowych
transkrypcję genu CD44 i ekspresję receptora CD44s, v6 i v9 na powierzchni wielu komórek
[22]. Wykazano na przykład, że osteopontyna jest ważnym regulatorem ekspresji receptora
CD44 na powierzchni osteoklastów [5].
Interakcja OPN z receptorem CD44 odbywa się w sposób niezależny od domeny RGD i
wymaga obecności integryn β1 [20, 47]. Ligacja izoform CD44 przez OPN umożliwia
chemotaksję i adhezję fibroblastów, limfocytów T, a także komórek szpiku kostnego.
Związanie OPN z receptorem CD44 zmniejsza ekspresję IL-10 w makrofagach
otrzewnowych [46].
Osteopontyna może wiązać się również ze składnikami macierzy zewnątrzkomórkowej.
Wykazano, że cząsteczka OPN zawiera dwie konserwatywne N-końcowo lokalizowane
domeny wykazujące homologię do heparyny, umożliwiające interakcje OPN z siarczanem
heparanu, a także wiąże się bezpośrednio z fibronektyną i kolagenem [26, 29]. W swej
strukturze OPN ma ponadto sekwencje bogate w kwas asparaginowy wiążące wapń oraz
fosforylowaną serynę i treoninę uczestniczące w wiązaniu hydroksyapatytu, niezależnie od
domen wiążących receptory integrynowe [39].
Udział osteopontyny w zapaleniu
Osteopontyna wykazuje zdolność do regulacji odpowiedzi zapalnej na wielu poziomach.
Działanie to obejmuje m.in. zdolność OPN do regulacji adhezji, migracji i aktywności
6
6
komórek zapalnych, a także aktywacji limfocytów T i indukcji syntezy cytokin o charakterze
prozapalnym, m.in. IL-12. Aktywność OPN prowadzi w konsekwencji do zaostrzania reakcji
zapalnej oraz do utrzymywania przewlekłego stanu zapalnego.
Osteopontyna jest potencjalnym czynnikiem chemotaktycznym makrofagów i uczestniczy w
gromadzeniu tych komórek w miejscu rozwoju zapalenia. Osteopontyna reguluje również
aktywność komórek fagocytujących. Badania wykazały, że makrofagi podlegają
autoregulacji za pośrednictwem OPN w sposób autokrynny [39].
Osteopontyna indukuje wczesną odpowiedź limfocytów Th1, dzięki czemu zyskała miano
cytokiny szlaku Th1. Wywołuje chemotaksję i adhezję limfocytów T, a także uczestniczy w
proliferacji tych komórek. Indukuje ekspresję ligandu dla receptora CD40 (CD40L) oraz
wzmaga syntezę IFN-γ. Wzmożona ekspresja CD40L przez limfocyty T powoduje aktywację
proliferacji limfocytów B i syntezę przeciwciał [34]. Aktywacja komórek T odpowiada
również za CD3-zależną aktywację makrofagów i indukcję syntezy IL-12, hamując
jednocześnie wydzielanie IL-10.
Synteza IL-12 jest wynikiem interakcji fragmentu N-końcowego OPN z receptorem
integrynowym αVβ3, podczas gdy wydzielanie IL-10 hamowane jest za pośrednictwem
fragmentu C-końcowego, prawdopodobnie przez receptor CD44 [48]. Osteopontyna odgrywa
rolę w przeciwbakteryjnej i przeciwwirusowej odpowiedzi makrofagów i limfocytów T i
uczestniczy w modulacji aktywności komórek dendrytycznych i chemotaksji neutrofilów
[25].
Osteopontyna jest cytokiną nie tylko o charakterze prozapalnym, ale także wykazuje
właściwości przeciwzapalne [33]. Działanie to polega m.in. na zdolności do hamowania
wydzielania MMP-2 i cytokin przez makrofagi, a także na zahamowaniu ekspresji syntazy
tlenku azotu, co potwierdzono w badaniach na szczurach, a także w ludzkich makrofagach i
w komórkach nabłonkowych kanalików nerkowych [27, 40].
Rola osteopontyny w chorobach sercowo-naczyniowych
Choroby sercowo-naczyniowe obejmują grupę schorzeń, u których podłoża leżą zmiany
miażdżycowe rozwijające się w ścianie tętnic.
Miażdżyca tętnic uznawana jest obecnie za chorobę przewlekłą o podłożu zapalnym, w
której powstawaniu uczestniczy wiele czynników, zarówno środowiskowych, jak i
biologicznych. Klasyczne czynniki ryzyka rozwoju miażdżycy, takie jak: dyslipidemia,
7
7
cukrzyca i otyłość, odpowiadają za rozwój reakcji zapalnej poprzez kompleksowe
mechanizmy, obejmujące, takie procesy jak: glikacja i peroksydacja lipidów oraz
zwiększenie syntezy cytokin prozapalnych, co powoduje kumulację komórek zapalnych
(makrofagów) w miejscu zmienionego śródbłonka. Rozwój miażdżycy jest związany nie
tylko z miejscową kumulacją komórek prozapalnych, ale także z rozwojem ogólnoustrojowej
reakcji zapalnej.
W warunkach fizjologicznych głównym źródłem osteopontyny w ścianie naczyń
krwionośnych są komórki mięśni gładkich oraz komórki nabłonkowe wydzielające OPN w
bardzo niewielkich ilościach, co ma znaczenie w ochronie przed mineralizacją. W procesie
aterogenezy za zwiększenie stężenia OPN odpowiadają przede wszystkim makrofagi licznie
naciekające ścianę naczynia. Znamienne zwiększenie ekspresji mRNA dla osteopontyny
wykazano w komórkach makrofagów otaczających zmiany miażdżycowe rozwijające się w
ścianie naczynia. Co więcej zmiany te korelowały z nasileniem procesu miażdżycowego
[16].
Badania wykazały zwiększone stężenie OPN w obrębie tętnic wieńcowych zmienionych
miażdżycowo, w porównaniu z tętnicami wieńcowymi niewykazującymi tego typu zmian
[8]. Zwiększone stężenie OPN zanotowano także w objawowej miażdżycy tętnic szyjnych, w
porównaniu ze zmianami miażdżycowymi, które nie dają objawów klinicznych, co
dodatkowo może mieć znaczenie w ocenie stabilności blaszki miażdżycowej [13].
Osteopontyna uczestniczy w regulacji procesu przebudowy ściany naczyń krwionośnych,
zachodzącej podczas aterogenezy. Indukuje migrację i proliferację komórek mięśni gładkich
ściany naczyń oraz miofibroblastów przydanki [24]. Badania wykazały ponadto związek
nadeksprsji OPN ze zmniejszeniem grubości kompleksu błony wewnętrznej i środkowej
ściany naczynia IMT (ang. intima-media thickness) wraz z wiekiem, zarówno in vivo, jak i
u myszy transgenicznych z wywołanym uszkodzeniem tętnic [18]. Potwierdzono ponadto
reekspresję OPN w komórkach mięśni gładkich ściany naczyń w procesie restenozy [35].
Udział osteopontyny w procesie remodelingu ściany naczyń krwionośnych ma związek ze
zdolnością tego białka do regulacji wydzielania i aktywności białek macierzy
międzykomórkowej. Wykazano, że domena SVVYGLR, odsłonięta po proteolitycznym
cięciu cząsteczki OPN, ma zdolność do indukcji ekspresji białka pro-MMP-9 w hodowanych
komórkach mięśni gładkich ściany naczyń oraz w tętnicach myszy z indukowaną cukrzycą
[23].
8
8
Na zmiany ekspresji osteopontyny mogą wpływać tradycyjne czynniki ryzyka rozwoju
miażdżycy. Wykazano, że zwiększoną syntezę OPN w ścianie zmienionej miażdżycowo
indukuje wewnątrzkomórkowy metabolizm glukozy, a proces ten jest bezpośrednio
regulowany przez czynniki transkrypcyjne USF-1 i AP-1, a także czynnik jądrowy
aktywowanych limfocytów T (NFAT) [2, 30, 44].
Z patologicznego punktu widzenia dużą rolę w modulacji ekspresji OPN w ścianie naczyń
odgrywają również lipidy. Badania wykazały, że acetylowane cząsteczki LDL mogą
stymulować komórki mięśni gładkich ściany naczyń do zmiany fenotypu, w wyniku czego
komórki te zaczynają wydzielać białka charakterystyczne dla osteoblastów, w tym również
OPN, konsekwencją czego jest tworzenia centrów wapnienia w obrębie ściany naczynia
zmienionej miażdżycowo [36]. Wykazano również istnienie zależności pomiędzy wzrostem
stężenia osteopontyny w krążeniu, a występowaniem stresu oksydacyjnego [12, 23].
Wyniki badań oceniające kliniczne znaczenie zwiększonej ekspresji OPN wskazują na
związek pomiędzy stężeniem tego białka w osoczu, a chorobą wieńcową, niezależnie od
występowania tradycyjnych czynników ryzyka rozwoju miażdżycy tętnic. Co więcej,
zwiększone stężenie OPN koreluje nie tylko ze zmianami miażdżycowymi w tętnicach
wieńcowych, ale również z ich rozległością [32].
Z kolei wyniki badań przeprowadzonych przez Georgiadou i wsp. [12] wskazują na istnienie
pozytywnej korelacji pomiędzy stężeniem OPN w krążeniu, a występowaniem stresu
oksydacyjnego u pacjentów z rozpoznaną chorobą wieńcową. Znamienne zwiększenie
stężenia OPN w osoczu notuje się również u pacjentów z przewlekłą niewydolnością serca,
w porównaniu ze zdrowymi. Co więcej, stężenie tego białka w osoczu jest znacznie wyższe u
pacjentów z ostrą niewydolnością serca, w odniesieniu do pacjentów z wyrównaną
niewydolnością serca [38].
Wskazuje się również na związek pomiędzy zwiększonym stężeniem OPN w krążeniu, a
rozwojem tętniaka aorty brzusznej. Udział OPN w patogenezie tętniaka potwierdzono np. w
mysim modelu tego schorzenia, a także w badaniach in vitro [3]. Wyniki badań oceniających
stężenie OPN zarówno w osoczu pacjentów, jak i w tkankach, wskazują na istnienie
pozytywnej korelacji pomiędzy poziomem ekspresji OPN, a obecnością tętniaka aorty
brzusznej, niezależnie od występowania innych czynników ryzyka. Co więcej, autorzy
sugerują, że oznaczanie stężenia OPN w osoczu może być użytecznym markerem służącym
ocenie wielkości tętniaka i progresji choroby, szczególnie we wczesnym okresie rozwoju
[14].
9
9
Podsumowanie
Osteopontyna jest białkiem pełniącym wiele różnorakich funkcji. Owa wielofunkcyjność
wynika z modyfikacji, jakim podlega cząsteczka OPN w komórkach (ekspresja
specyficznych izoform) oraz z możliwości ekspresji w różnych tkankach. Osteopontyna jest
uznawana za jeden ze znaczących regulatorów odpowiedzi komórkowej w procesie
aterogenezy. Ekspresja tego białka przez komórki układu odpornościowego jest
odpowiedzialna za wzmacnianie i utrzymywanie procesu zapalnego. Jego wydzielanie przez
komórki mięśni gładkich i komórki nabłonkowe ściany tętnic stymulują dodatkowo
aktywację enzymów, uczestniczących w procesie przebudowy tętnic przyczyniając się do
progresji zmian miażdżycowych.
Poznanie mechanizmów oddziaływania osteopontyny oraz jej funkcjonalnych fragmentów
pozwoli na opracowanie procedur diagnostycznych, pozwalających na wczesne wykrywanie
zmian w układzie naczyniowym, a także na wdrożenie skutecznych strategii postępowania
terapeutycznego, selektywnie ograniczających funkcje tego białka.
Piśmiennictwo
1. Agnihotri R., Crawford H.C., Haro H. i wsp.: Osteopontin, a novel substrate for matrix
metalloproteinase-3 (stromelysin-1) and matrix metalloproteinase-7 (matrilysin). J. Biol.
Chem., 2001, 276, 28261-28267.
2. Bidder M., Shao J.S., Charlton-Kachigian N. i wsp.: Osteopontin transcription in aortic
vascular smooth muscle cells is controlled by glucose-regulated upstream stimulatory factor
and activator protein -1 activities. J. Biol. Chem., 2002, 277, 44485-44496.
3. Bruemmer D., Collins A.R., Noh G. i wsp.: Angiotensin II-accelerated atherosclerosis and
aneurysm formation is atteuated in osteopontin-deficient mice. J. Clin., Invest., 2003, 112,
1318-1331.
4. Bulfone-Paus S., Paus R.: Osteopontin as a new player in mast cell biology. Eur. J.
Immunol., 2008, 38, 338-341.
5. Chellaiah M.A., Kizer N., Biswas R. i wsp.: Osteopontin deficiency produces osteoclast
dysfunction due to reduced CD44 surface expression. Mol. Biol. Cell, 2003, 14, 173-189.
6. Denhardt D.T., Noda M. Osteopontin expression and function: Role in bone remodeling. J.
Cell Biochem., 1998, 30, 92-102.
10
10
7. El-Tanani M., Platt-Higgins A., Rudland P.S. i wsp.: Ets gene PEA3 cooperates with β-
catenin-Lef-1 and c-Jun in regulation of osteopontin transcription. J. Biol. Chem., 2004, 279,
20794-20806.
8. Fitzpatrick. L.A., Severson A., Edwards W.D. i wsp.: Diffuse calcification in human
coronary arteries. Association of osteopontin with atherosclerosis. J. Clin. Invest., 1994, 94,
1597-1604.
9. Fisher L.W., Torchia D.A., Fohr B. i wsp.: Flexible structure of SIBLING proteins, bone
sialoprotein and osteopontin. Biochem. Biophys. Res. Commun., 2001, 280, 460-465.
10. Gao C., Guo H., Mi Z. i wsp.: Transcriptional regulatory functions of heterogenous
nuclear ribonucleoprotein-U and A/B in endotoxin-mediated macrophage expression of
osteopontin. J. Immunol., 2005, 175, 523-530.
11. Gao Y.A., Agnihotri R., Vary C.P. i wsp.: Expression and characterization of
recombinant osteopontin peptides representing matrix metalloproteinase proteolytic
fragments. Matrix Biol., 2004, 23, 457-466.
12. Georgiadou P., Iliodromitis E.K., Varounis C. i wsp.: Relationship between plasma
osteopontin and oxidative stress in patients with coronary artery disease. Expert. Opin. Ther.
Targets., 2008, 12, 917-920.
13. Golledge J., McCann M., Mangan S., i wsp.: Osteoprotegerin and osteopontin are
expressed at high concentrations within symptomatic carotid atherosclerosis. Stroke, 2004,
35, 1636-1641.
14. Golledge J., Muller J., Shephard N. i wsp.: Association between osteopontin and human
abdominal aortic aneurysm. Arterioscler. Thromb. Vasc. Biol., 2007, 27, 655-660.
15. Higashikawa F., Eboshida A., Yokosaki Y.: Enhanced biological activity of polymeric
osteopontin. FEBS Lett., 2007, 581, 2697-2701.
16. Hirota S., Imakita M., Kohri K. i wsp.: Expression of osteopontin messenger RNA by
macrophages in atherosclerotic plaques. A possible association with calcification. Am. J.
Pathol., 1993, 143, 1003-1008.
17. Hou P., Troen T., Ovejero M.C. i wsp.: Matrix metalloproteinase-12 (MMP-12) in
osteoclasts: new lesson on the involvement of MMPs in bone resorption. Bone, 2004, 34, 37-
47.
18. Isoda K., Nishikawa K., Kamezawa Y. i wsp.: Osteopontin plays an important role in the
development of medial thickening and neointimal formation. Circ. Res., 2002, 91, 77-82.
11
11
19. Jalvy S., Renault M.A., Leen L.L. i wsp.: Autocrine expression of osteopontin contributes
to PDGF-mediated arterial smooth muscle cell migration. Cardiovasc. Res., 2007, 75, 738-
747.
20. Katagiri Y.U., Sleeman J., Fujii H. i wsp.: CD44 variants but not CD44s cooperate with
beta 1-containing integrins to permit cells to bind to osteopontin independently of arginine-
glycine-aspartic acid, thereby stimulating cell motility and chemotaxis. Cancer Res., 1999,
59, 219-226.
21. Kazanecki C.G., Uzwiak D.J., Denhardt D.T.: Control of osteopontin signaling and
function by post-translational phosphorylation and protein folding. J. Cell Biochem., 2007,
102, 912-924.
22. Khan S.A., Cook A.C., Kappil M. i wsp.: Enhanced cell surface CD44 variant (v6 i v9)
expression by osteopontin in breast cancer epithelial cells facilitates tumor cell migration:
novel post-transcriptional, post-translational regulation. Clin. Exp. Metastasis., 2005, 22,
663-673.
23. Lai C.F., Seshadri V., Huang K. i wsp.: An osteopontin-NADPH oxidase signaling
cascade promotes pro-matrix metalloproteinase 9 activation in aortic mesenchymal cells.
Circ. Res., 2006, 98, 1479-1489.
24. Lenga Y., Koh A., Perera A.S. i wsp.: Osteopontin expression is required for
myofibroblast differentiation. Circ. Res., 2008, 102, 319-327.
25. Lund S.A., Giachelli C.M.: The role of osteopontin in inflammatory processes. J. Cell
Commun. Signal., 2009, 3, 311-322.
26. Martin S.M., Schwartz J.L., Giachelli C.M. i wsp.: Enhancing the biological activity of
immobilized osteopontin using a type-1 collagen affinity coating. J. Biomed. Mater. Res.,
2004, 70, 10-19.
27. Mazzali M., Kipari T., Ophascharoensuk V. i wsp.: Osteopontin – a molecule for all
seasons. Q. J. Med., 2002, 95, 3-13.
28. Mrochem J., Bartnik W.: Osteopontyna – nowy marker w chorobach nowotworowych.
Wsp. Onkol., 2008, 12, 349-353.
29. Mukherjee B.B., Nemir M., Beninati S. i wsp.: Interaction of osteopontin with fibronectin
and other extracellular matrix molecules. Ann. N. Y. Acad. Sci., 1995, 760, 201-212.
30. Nilsson-Berglund L.M., Zetterqvist A.V., Nilsson-Ohman J. i wsp.: Nuclear factor of
activated T cells regulates osteopontin expression in arterial smooth muscle in response to
diabetes-induced hyperglycemia. Arterioscler. Thromb. Vasc. Biol., 2010, 30, 218-224.
12
12
31. Nishimichi N., Higashikawa F., Kinoh H.H. i wsp.: Polymeric osteopontin employs
integrin alpha 9 beta 1 as a receptor and attracts neutrophils by presenting a de novo binding
site. J. Biol. Chem., 2009, 284, 14769-14776.
32. Ohmori R., Momiyama Y., Taniguchi H. i wsp.: Plasma osteopontin levels are associated
with the presence and extent of coronary artery disease. Atheroscler., 2003, 170, 333-337.
33. O`Regan A.W., Berman JS. Osteopontin a key cytokine in cell-mediated and
granulomatous inflammation. Int. J. Exp. Pathol., 2000, 81, 373-390.
34. O`Regan A.W., Hayden J.M., Berman J.S.: Osteopontin augments CD3-mediated
interferon-gamma and CD40 ligand expression by T cells, which results in IL-12 production
from peripheral blood mononuclear cells. J. Leukoc. Biol., 2000, 68, 495-502.
35. Panda D., Kundu G.C., Lee B.I. i wsp.: Potential roles of osteopontin and alphaVbeta3
integrin in the development of coronary artery restenosis after angioblasty. Proc. Natl. Acad.
Sci. U S A., 1997, 94, 9308-9313.
36. Proudfoot D., Dawies J.D., Skepper J.N. i wsp.: Acetylated low-density lipoprotein
stimulates human vascular smooth muscle cells calcification by promoting osteoblast
differentiation and inhibiting phagocytosis. Circulation, 2002, 106, 3044-3050.
37. Ramaiah S.K., Rittling S.: Pathophysiological role of osteopontin in hepatic
inflammation, toxicity and cancer. Toxicol. Sci., 2008, 103, 4-13.
38. Rosenberg M., Zugck C., Nelles M. i wsp.: Osteopontin, a new prognostic biomarker in
patients with chronic heart failure. Circ. Heart Fail., 2008, 1, 43-49.
39. Scatena M., Liaw L., Giachelli C.M.: Osteopontin: A multifunctional molecule regulating
chronic inflammation and vascular disease. Arterioscler. Thromb. Vasc. Biol., 2007, 27,
2302-2309.
40. Scott J.A., Weir M.L., Wilson S.M. i wsp.: Osteopontin inhibits inducible nitric oxide
synthase activity in rat vascular tissue. Am. J. Physiol., 1998, 275, 2258-2265.
41. Senger D.R., Perruzzi C.A., Papadopoulos S.A. i wsp.: Adhesive properties of
osteopontin: regulation by a naturally occuring thrombin-cleavage in close proximity to the
GRGDS cell-binding domain. Mol. Biol. Cell, 1994, 5, 565-574.
42. Smith L.L., Cheung H.K., Ling L.E. i wsp.: Osteopontin N-terminal domain contains a
cryptic adhesive sequence recognized by alpha9beta1 integrin. J. Biol. Chem., 1996, 271,
28485-28491.
43. Smitch L.L., Giachelli C.M.: Structural requirements for alpha 9 beta-1 mediated
adhesion and migration to thrombin-cleaved osteopontin. Exp. Cell Res., 1998, 242, 351-360.
13
13
44. Sun J., Xu Y., Sun Y.: Intermittent high glucose enhances proliferation of vascular
smooth muscle cells by upregulating osteopontin. Mol. Cell Endocrinol., 2009, 313, 64-69.
45. Waller A.H., Sanchez-Ross M., Kaluski E. i wsp.: Osteopontin in cardiovascular disease:
a potential therapeutic target. Cardiol. Rev., 2010, 18, 125-131.
46. Wang K.X., Denhardt D.T.: Osteopontin: Role In immune regulation and stress response.
Cytokine Growth Factor Rev., 2005, 19, 333-345.
47. Weber G.F., Ashkar S., Cantor H.: Interaction between CD44 and osteopontin as a
potential basis for metastasis formation. Proc. Assoc. Am. Physicians, 1997, 109, 1-9.
48. Weber G.F., Zawaideh S., Hikita S. i wsp.: Phosphorylation-dependent interaction of
osteopontin with its receptors regulates macrophage migration and activation. J. Leukoc.
Biol., 2002, 72, 752-761.
49. Yokosaki Y., Matsuura N., Sasaki T. i wsp.: The integrin alpha(9)beta(1) binds to a novel
recognition sequence (SVVLYGR) in the thrombin-cleaved amino-terminal fragment of
osteopontin. J. Biol. Chem., 1999, 274, 36328-36334.
50. Yokosaki Y., Tanaka K., Higashikawa F. i wsp.: Distinct structural requirements for
binding of the integrins αVβ6, αVβ5, α5β1 and α9β1 to osteopontin. Matrix Biol., 2005, 24, 418-
427.
Otrzymano 1 czerwca 2010 r.
Adres: Agnieszka Czyżewska-Buczyńska, Wojewódzki Szpital Specjalistyczny we
Wrocławiu, Ośrodek Badawczo-Rozwojowy, ul. H.M. Kamieńskiego 73a, 51-124 Wrocław,
tel. (71) 327 01 25, fax (71) 32 54 101, e-mail: [email protected]
Ryc. 1. Schemat struktury cząsteczki osteopontyny (OPN). Od strony lewej do prawej
zaznaczono: N-końcowo-zlokalizowaną sekwencję sygnalną, regulującą wydzielanie OPN,
która następnie jest odcinana po wydzieleniu białka; miejsce polimeryzacji OPN w reakcji
katalizowanej przez transglutaminazę; bogatą w kwas asparaginowy domenę Poli-D wiążącą
hydroksyapatyt; miejsca wiązania jonów wapnia; trzy domeny wiążące integryny; miejsca
cięcia cząsteczki przez trombinę i metaloproteinazy macierzy; C-końcowo zlokalizowaną
sekwencję rozpoznająca receptor CD44; kropki oznaczają potencjalne miejsca fosforylacji
OPN
14
14
Fig. 1. Osteopontin (OPN) structure scheme. From left side to right side are indicated: the N-
terminal signal sequence regulating OPN secretion, that is cleaved off after the protein
secretion; OPN polymerization side enzymatically mediated by transglutaminase; an aspartate
rich region (Poly-D) hydroxyapatite binding; calcium ions binding sides; three integrin binding
domains; sites cleaved by trombin and matrix metalloproteinases; C-terminal CD44 binding
sequence; dots indicate potential phosphorylation sites
![Page 1: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/1.webp)
![Page 2: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/2.webp)
![Page 3: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/3.webp)
![Page 4: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/4.webp)
![Page 5: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/5.webp)
![Page 6: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/6.webp)
![Page 7: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/7.webp)
![Page 8: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/8.webp)
![Page 9: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/9.webp)
![Page 10: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/10.webp)
![Page 11: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/11.webp)
![Page 12: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/12.webp)
![Page 13: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/13.webp)
![Page 14: [The role of osteopontin in cardiovascular diseases]](https://reader039.fdokumen.com/reader039/viewer/2023051615/6345a46803a48733920b74c5/html5/thumbnails/14.webp)