penyelamatan embrio
Transcript of penyelamatan embrio
-
8/14/2019 penyelamatan embrio
1/10
TOPIK 8
PENYELAMATAN EMBRIO TANAMAN HASIL FERTILISASI
Disusun oleh
Angela
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2010
-
8/14/2019 penyelamatan embrio
2/10
I. PENDAHULUAN
I.1 Latar belakang
Konservasi keanekaragaman hayati secara luas diakui sebagai prioritas
tinggi untuk perhatian dalam debat yang berlangsung antara lingkungan dan
pembangunan. Khususnya, konservasi sumber daya genetik tanaman untuk
pangan dan pertanian, satu sektor keanekaragaman hayati, dianggap sebagai
elemen utama dari setiap strategi untuk mencapai pembangunan pertanian
berkelanjutan, bersama dengan konservasi sumber daya alam lainnya. Beragam
metode konservasi dilakukan sesuai dengan situasi yang dihadapi. Metode ini
dapat dibagi secara luas menjadi ex situ dan in situ.
Konservasi in situ merupakan konservasi di area hutan belantara, cagar
alam, kawasan lindung, dan dalam sistem pertanian tradisional (disebut demikian,
on-farm konservasi). Konservasi ex situ melibatkan menghilangkan sumber daya
genetik tanaman dari habitat alam mereka dan menempatkan mereka di bawah
kondisi penyimpanan buatan.
Pendekatan konservasi ex situ yang paling sering dilakukan adalah
penyimpanan benih. Tiga kategori tanaman yang menimbulkan masalah
penyimpanan benih antara lain; 1) tidak menghasilkan benih sama sekali dan
diperbanyak secara vegetatif , contohnya pisang, 2) tanaman tersebut memiliki
genotipe steril atau benih ortodoks, seperti kentang dan singkong, dan 3) tanaman
tersebut memproduksi benih rekalsitran (Altman, 1998)
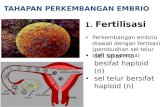
Terdapat dua kategori embrio yang mungkin tumbuh dengan normal, atau
terkadang in vivo, atau dibawah kontrol lingkungan in vitro:
1. Zygotic embryos, terbentuk dari zigot yang dihasilkan dari fusi regulertelur.
2. Non-zygotic embryos, dibentuk oleh sel-sel selain zigot
Parthenogenetic embryos, terbentuk dari telur yang tidak dibuahi,
atau telur yang dibuahi tanpa kariogamy
Androgenetic embryos, yang dibentuk dari mikrospora,
microgametophytes atau sperma.
-
8/14/2019 penyelamatan embrio
3/10
Somatic embryos (embryoids), dibentuk dari sel somatic baik
secara in vivo ataupun in vitro.(Huang, 1988)
Masalah lainnya adalah penyerbukan dan pembuahan dapat berhasil
namun setelah persilangan buatan seringkali dijumpai buah yang terbentuk gugur
saat embrio belum matang, terbentuk buah dengan endosperm yang kecil atau
terbentuk buah dengan embrio yang kecil dan lemah. Kondisi tersebut dapat
menghambat program pemuliaan tanaman karena embrio muda, embrio dengan
endosperm kecil atau embrio kecil dan lemah seringkali tidak dapat berkecambah
secara normal dalam kondisi biasa.
Untuk mengatasi hal tersebut di atas maka embrio tersebut dapat
diselamatkan dan ditanam secara aseptis dalam media buatan sehingga dapat
berkecambah dan menghasilkan tanaman utuh. Teknik untuk menanam embrio
muda ini dikenal dengan sebutan penyelamatan embrio (embryo rescue)
(Muslim,2009)
Embryo culture atau kultur embrio adalah salah satu yang paling awal
untuk kultur jaringan yang menggunakan embrio muda (immature embryo) atau
embrio dewasa/tua (mature embryo) yang diisolasi agar dapat menghasilkan
tanaman yang lengkap (Conger,1980).
I.2 Tujuan
Tujuan dari percobaan ini adalah melatih mahasiswa cara untuk
mengisolasi embrio dari biji dan menumbuhkannya pada media in vitro.
-
8/14/2019 penyelamatan embrio
4/10
II. BAHAN DAN METODE
II.1 Waktu dan tempat
Percobaan ini dilakukan pada:
Hari / tanggal : Selasa / 2009
Waktu : pukul 13.00 16.00 WIB
Tempat : Laboratorium Bioteknologi Tanaman
II.2 Bahan dan alat
Bahan :
Bahan tanaman adalah 15 biji kacang merah
Media MS11 ( MS + 0.5 mg/L BAP + 0.1 mg/L IAA + 30 g/L gula ), pH
media 5.9 sebelum di autoclave
Bahan sterilisasi biji adalah detergen
Clorox ( Sodium hypoclorit ) 30 % dan 5 %
Aquades steril
Alkohol 70 %
Alat yang dipergunakan antara lain Laminar Air Flow Cabinet
(dibersihkan terlebih dahulu dengan alkohol), pinset dan scalpel (disterilisasi
dalam autoclave selama 1 jam dalam suhu 1210C tekanan 0.175 bar), bunsen,
hand sprayer, masker, tissue.
II.3 Cara kerja
Biji kacang merah dicuci dengan menggunakan air detergen, biji dicuci
sambil dibuang kulitnya (dilakukan di luar laminar), kemudian dibilas dengan
aquades steril sebanyak dua kali. Selanjutnya di dalam laminar, biji direndam
dalam larutan Clorox 30 % selama 15 menit, kemudian dibilas dengan aquades
satu kali.
Setelah itu, biji kacang merah dibelah dengan hati-hati agar embrio tidak
rusak, selanjutnya embrio diisolasi dari endospermanya. Embrio direndam dalam
larutan Clorox 5 % selama 2 menit, lalu dibilas dengan aquades sebanyak dua
-
8/14/2019 penyelamatan embrio
5/10
kali. Embrio yang telah steril ditanam pada media MS11 sebanyak 5 embrio per
botol, kemudian disimpan dalam ruang kultur dengan penyinaran 16 jam per hari.
2.4 Pengamatan
Pengamatan yang dilakukan terhadap peubah:
1. jumlah embrio yang steril dan tumbuh
2. jumlah embrio yang mati dan gejalanya
3. persentase embrio yang berkecambah dan saat mulai berkecambah
-
8/14/2019 penyelamatan embrio
6/10
III. HASIL DAN PEMBAHASAN
III.1 Hasil
Kelompok Jumlah embryo steril dan tumbuh
1 MST 2 MST 3 MST 4 MST 5 MST
1 7 7 7 5 5
2 13 5 5 5 5
3 15 15 15 15 15
4 15 15 15 15 15
5 5 5 3 0 0
6 7 0 0 0 0
7 13 9 0 0 0
8 5 5 5 5 5
9 15 15 10 10 10
10 15 15 15 13 11
11 5 1 0 0 0
12 15 15 15 15 15
sd 10.833 4.549 8.916 5.853 7.5 6.274 6.916 6.3597 6.75 6.210
Kelompok Jumlah embryo mati
1 MST 2 MST 3 MST 4 MST 5 MST1 8 8 8 10 10
2 1 9 9 9 9
3 0 0 0 0 0
4 0 0 0 0 0
5 0 0 2 5 5
6 8 15 15 15 15
7 0 4 13 13 13
8 10 10 10 10 10
9 0 0 5 5 5
10 5 5 5 7 9
11 0 2 3 5 5
12 0 0 0 0 0 sd 2.667 3.9157 4.416 5.0535 5.833 5.169 6.583 5.0354 6.75 5.083
-
8/14/2019 penyelamatan embrio
7/10
0
2
4
6
8
10
12
1 MST 2 MST 3 MST 4 MST 5 MST
embrio steril d
tumbuh
embrio mati
Kelompok
Jumlah embrio
berkecambah
Persentase embrio
berkecambah1 7 46.70%
2 5 35.71%
3 15 100%
4 15 100%
5 3 60%
6 7 46.77%
7 0 0%
8 5 33.33%
9 15 100%
10 15 100%
11 7 3%
12 15 100% sd 9.083 5,567 60.46% 39%
III.2 Pembahasan
Dari data yang diperoleh dapat dilihat bahwa jumlah embrio yang steril
dan tetap tumbuh semakin menurun setiap minggunya, hingga pada 5 MST rata-
rata embrio yang tumbuh adalah 6.75 dengan standar deviasi 6.210. nilai standar
deviasi yang cukup besar ini dikarenakan terdapat empat kelompok dengan
jumlah embrio tumbuhnya nol (0) sedangkan kelompok lainnya diatas lima (5).
Sedangkan jumlah embrio yang mati berbanding terbalik dengan jumlah
embrio yang tumbuh. Setiap minggunya jumlah embrio yang mati bertambah dan
pada 5 MST rata-rata embrio yang mati adalah 6.75 dengan standar deviasi 5.083.
Meningkatnya jumlah embrio yang mati dapat disebabkan oleh
kontaminasi virus, bakteri, atau cendawan. Hal ini terjadi karena praktikan dan
peralatan yang kurang steril atau tidak hati-hati saat melakukan praktikum.
-
8/14/2019 penyelamatan embrio
8/10
Pada data jumlah embrio yang berkecambah dan persentase
perkecambahannya, yang paling kecil adalah kelompok 7 dengan persentase 0%
tetapi terdapat lima kelompok dengan persentase perkecambahan 100% dan
kelompok lainnya dengan persentase di bawah 50%. Rata-rata untuk jumlah
embrio yang berkecambah adalah 9.083 dengan standar deviasi 5.567, sedangkan
rata-rata untuk persentase perkecambahan adalah 60.46 % dengan standar deviasi
39%. Dengan nilai rata-rata perkecambahan di atas 50% bisa dikatakan praktikum
penyelamatan embrio ini berhasil.
-
8/14/2019 penyelamatan embrio
9/10
IV. KESIMPULAN DAN SARAN
4.1 Kesimpulan
Jumlah embrio yang tumbuh dan mati berbanding terbalik. Jumlah embrio
yang tumbuh menurun setiap minggunya, tapi jumlah embrio yang mati setiap
minggunya meningkat. Dapat dikatakan praktikum penyelamatan embrio pada
media in vitro ini cukup berhasil karena rata-rata perkecambahan di atas 50 %.
4.2 Saran
Metode penyelamatan embrio ini semoga dapat dikembangkan dan
dilaksanakan pada praktikum selanjutnya dengan bahan tanaman yang berbeda.
Selain untuk menambah wawasan dan kemampuan mahasiswa dalam mengisolasi
embrio, juga untuk menambah koleksi plasma nutfah yang tidak dapat
dikembangbiakan secara generatif yang saat ini semakin langka.
-
8/14/2019 penyelamatan embrio
10/10
DAFTAR PUSTAKA
Altman, Arie. 1998.Agricultural Biotechnology . New York: Marcel Dekker, Inc.
Muslim, Ahmadi. 2009.Kultur Embrio dan Penyelamatan Embrio (Embryo
Culture and Embryo Rescue). [online].
(http://bloginvitro.blogspot.com/search/label/KULTUR%20ANTHERA
%20(MIKROSPORAdiakses tanggal 04 Januari 2010)
Conger, B.V. 1980. Cloning Agricultural Plants via In Vitro Techniques.
Florida: CRC Press, Inc.
Huang, Cheng-Hwa. 1988. Cell and Tissue Culture in Field Crop Improvement.
Taiwan: Agriculture Building, 14 Wenchow Street
http://bloginvitro.blogspot.com/search/label/KULTUR%20ANTHERA%20(MIKROSPORAhttp://bloginvitro.blogspot.com/search/label/KULTUR%20ANTHERA%20(MIKROSPORAhttp://bloginvitro.blogspot.com/search/label/KULTUR%20ANTHERA%20(MIKROSPORAhttp://bloginvitro.blogspot.com/search/label/KULTUR%20ANTHERA%20(MIKROSPORA