Lap Lengkap Histo
-
Upload
krisye-pasanea -
Category
Documents
-
view
327 -
download
6
Transcript of Lap Lengkap Histo

1
PROSEDUR PEMBUATAN PREPARAT HISTOLOGI KARANG (Goniopora sp.)
LAPORAN LENGKAP HISTOLOGI
Oleh :
NAMA : KRISYE
NIM : L111 07 057
KONSENTRASI KONSERVASI SUMBER DAYA HAYATI LAUT
LABORATORIUM FISIOLOGI HEWAN AIR
JURUSAN ILMU KELAUTAN
FAKULTAS ILMU KELAUTAN DAN PERIKANAN
UNIVERSITAS HASANUDDIN
MAKASSAR
2010

2
I. PENDAHULUAN
A. Latar Belakang
Histologi berasal dari bahasa Yunani yaitu histos yang berarti jaringan dan
logos yang berarti ilmu. Jadi histologi berarti suatu ilmu yang menguraikan
struktur dari hewan secara terperinci dan hubungan antara struktur
pengorganisasian sel dan jaringan serta fungsi-fungsi yang mereka lakukan.
Jaringan merupakan sekumpulan sel yang tersimpan dalam suatu kerangka
struktur atau matriks yang mempunyai suatu kesatuan organisasi yang mampu
mempertahankan keutuhan dan penyesuaian terhadap lingkungan diluar batas
dirinya (Bavelander, 1998).
Ilmu histologi merupakan ilmu yang tidak hanya berguna dalam melihat dan
menganalisis struktur jaringan pada manusia saja, tetapi juga dapat digunakan
untuk menganalisis struktur jaringan dari karang. Berdasarkan latar belakang
diatas, maka dianggap perlu untuk melakukan praktek tentang gonad histologi.
Sehingga memudahkan untuk melihat struktur jaringan dari gonad.
B. Tujuan dan Kegunaan
Adapun tujuan dari praktikum ini, yaitu:
1. Mengetahui prosedur/metode dalam pembuatan preparat histologi;
2. Mengetahui kelebihan dan kekurangan prosedur pembuatan preparat
histologi;
3. Mengetahui dan tingkat kematangan gonad dari sudut histologi.
Sedangkan kegunaan dari praktikum ini yaitu agar mahasiswa dapat
mengetahui cara pembuatan preparat histologi khususnya karang sehingga
nantinya dapat dijadikan informasi yang dapat dijadikan pembanding antara teori
dan praktek.

3
II. TINJAUAN PUSTAKA
A. Morfologi dan Sistematika Ikan Nila (Oreochromis niloticus)
Bentuk koloni columnar , masif dan encrusting. Koralit tebal tapi
berdinding keropos dan calice memiliki septa yang kokoh dan memiliki columella.
Polip genus Goniopora berukuran panjang dan keluar baik pada malam maupun
siang hari. Polip genus Goniopora memiliki 24 tentakel.
Kingdom: Animalia
Phylum: Cnidaria
Class: Anthozoa
Subclass: Hexacorallia
Order: Scleractinia
Family: Poritidae
Genus: Goniopora
Spesies: Goniopora sp.
B. Proses Histologi
Sediaan histologis disebut mikroteknik. Pembuatan sediaan dari suatu
jaringan dimulai dengan operasi, biopsi, atau autopsi. Jaringan yang diambil
kemudian diproses dengan fiksatif yang akan menjaga agar sediaan tidak akan
rusak (bergeser posisinya, membusuk, atau rusak). Fiksatif yang paling umum
digunakan adalah formalin (10% formaldehida yang dilarutkan dalam air).
Larutan Bouin juga dapat digunakan sebagai fiksatif alternatif meskipun hasilnya
tidak akan sebaik formalin karena akan meninggalkan bekas warna kuning dan
artefak. Artefak adalah benda yang tidak terdapat pada jaringan asli, namun

4
tampak pada hasil akhir sediaan. Artefak ini terbentuk karena kurang
sempurnanya pembuatan sediaan (Ali, 2007).
Sediaan mikroskopis yang sehari-hari di sebut “preparat”, ialah potongan-
potongan tipis jaringan yang berasal dari blok parafin, setebal 2 – 6 mikron (pada
umumnya 4 mikron), yang siap diperiksa di bawah mikroskop.
Pembuatan Sediaan mikroskopis terdiri dari 4 tahap, sebagi berikut :
Pemotongan jaringan dari blok parafin (pemotongan tipis jaringan ringan)
Menempelkan potongan-potongan tipis tersebut pada gelas preparat
Deparafinisasi yang dilanjutkan dengan pemulasan Menutup dengan gelas
penutup menggunakan perekat (mounting) (Ali, 2007).
Menurut Caroko (2009), jaringan yang telah difiksasi dan dipotong-potong
menurut ukuran semestinya telah dimasukkan ke dalam kaset, selanjutnya di
“olah” sehingga berubah menjadi jaringan yang padat dan kaku agar dapat
dipotong amat tipis, 4-6 mikron menggunakan alat pemotong yang disebut
mikrotom. Tahap-tahap “pengolahan” jaringan yaitu :
a. Dehidrasi
Tindakan ini bertujuan mengeluarkan air dari dalam jaringan. akibat fiksasi
jaringan di dalam formalin 10%, maka jaringan mengandung banyak air. Hal
ini menghalangi impregnasi (penyusupan) lilin parafin ke dalam jaringan.
Agar impregnasi berjalan baik, maka terlebih dahulu air dikeluarkan dari
jaringan:dengan cara merendam jaringan di dalam larutan yang dapat
menarik air keluar. Umumnya digunakan alkohol sebagai penarik air
(dehidratyng agent atau dehydrant).
b. Penjernihan (clearing)
Proses penjernihan dari preparat histologis yaitu :
a. Setelah dilakukan dehidrasi, maka jaringan telah dibebaskan dari air, tapi
jadi mengandung alkohol.

5
b. Lilin parafin bersifat tidak dapat larut dalam alkohol,maka impregnasi
masih tidak dapat berlangsung baik.
c. Oleh karena itu perlu suatu larutan yang dapat bercampur baik dengan
alkohol maupun dengan lilin parafin sebagai perantara, sehingga
impregnasi dapat berlangsung.
d. Umumnya dipilih larutan benzol sebagai “perantara”
e. Larutan benzol dapat menaikkan indeks refraksi jaringan, sehingga
jaringan mejnadi lebih transparan/jernih.
f. Larutan benzol ini disebut sebagai “clearing agent”.
3. Impregnasi
Yaitu menyusupnya lilin parafin ke dalam jaringan menggantikan benzol yang
telah ada di dalam jaringan. Ketiga tahap (dehidrasi, penjernihan, impregnasi)
berjalan dalam keadaan suhu sekitar 60-65 derajat celcius, terutama untuk
mencairkan lilin parafin dan memudahkan penyusupan. Bila jaringan yang
mengandung lilin parafin didinginkan, maka jaringan menjadi kaku.
2. Penanaman (embedding)
Jaringan yang mengandung lilin parafin tersebut dimasukkan/ditanam di
dalam cairan lilin parafin panas yang disediakan dalam kotak-kotak kecil
serupa kotak pencetak es. Bila di dinginkan maka terbentuklah blok parafin
yang mengandung jaringan di dalamnya.Tahap dehidrasi selain alkohol dapat
pula dipakai bahan lain sebagai dehidrant, contoh: Aceton, Pyridine, Dioxane,
Butanol, isopropanol Tahap Penjernihan, bahan lain yang dapat di pakai
sebagai “clearing agent” adalah : Xylene Toulene, Chloroform, Cedar wood
oil.
Menurut Ali (2007), secara detail pengolahan preparat histologis diuraikan
sebagai berikut :
1. Pemotongan Tipis Jaringan

6
Pekerjaan pemotongan tipis jaringan ini dilakukan dengan menggunakan alat
khusus, yakni mikrotom
2. Menempelkan potongan jaringan pada gelas objek
Urutan-urutannya sebagai berikut : Siapkan gelas objek yang bersih dan
tetesi beberapa tetes cairan albumin sebagai perekat jaringan. Potongan-
potongan tipis jaringan dari mikrotom yang sudah dipisahkan dari deretannya,
dimasukkan ke dalam air hangat dan setelah mengembang dipindahkan ke
objek glas. Objek glass dengan potongan tipis jaringan diatasnya kemudian
diletakkan di atas pemanas (hot plate). Potongan tipis jaringan tadi akan
mengembang dan parafin akan melunak. Setelah potongan-potongan
mengembang rata, sisa albumin dibuang dengan jalan memiringkan objek
glas dan dikeringkan. Setelah kering, dijepit diantara dua lembar kertas
saring yang telah dibasahi dengan alkohol 96%. Kemudian simpan di hot
plate, sampai parafin meleleh. Potongan siap untuk diwarnai.
3. Deparafinisasi dan Pemulasan.
Deparafinisasi ialah membuang parafin serta sisa-sisanya pada jaringan yang
akan dipulas. Kemudian dilanjutkan dengan pemulasan histopatologi, yaitu
dengan pulasan Hematoxylin-Eosin. Setelah semua langkah pemulasan
selesai, sisa xylol dibuang, lalu objek glass ditetesi entelan (sebagai perekat)
dan dilanjutkan dengan menutup sediaan dengan gelas penutup (cover-
glass)
4. Staining
Setelah pita-pita parafin melekat erat, lakukan dewaxing (pelarutan parafin),
yaitu dengan memasukkan slide glass ke dalam slide container yang berisi
xilol selama 30 menit. Ulangi lagi jika parafin belum hilang dengan
menggunakan xilol yang lain. Setelah itu, pindahkan ke container lain yang
berisi xilol:alkohol (1:1) selama 5 menit. Lalu pindahkanke alkohol murni

7
selama 2 menit. Kemudian pindahkan ke alkohol seri konsentrasi turun: 95-
80-60-40-20% masing-masing selama 2 menit diikuti dengan air I dan II
masing-masing 2 menit. Pindahkan ke larutan Mayer Hemalum selama 2 jam.
Setelah itu, cuci kelebihan dengan air mengalir, bersihkan Mayer Albumin
yang mengikat warna dengan tissue. Pindahkan ke air I dan II masing-masing
2 menit. Lalu pindahkan ke alkohol 20-40-60-80-95% masing-masing 2 menit.
Lanjutkan ke alkohol murni II dan I masing-masing 2 menit. Kemudian,
lanjutkan ke xilol:alkohol (1:3; 1:1; 3:1) masing-masing 2 menit. Terakhir
pindahkan ke xilol murni II dan I masing-masing 2 menit. Tetesi dengan
entelan dan tutup dengan coverslip.

8
III. METODE PRAKTEK
A. Waktu dan Tempat
Praktikum Histologi ini dilaksanakan pada hari Selasa 23 sampai dengan
Kamis 25 Maret 2010 bertempat di Laboratorium Fisiologi Hewan Air, Fakultas
Ilmu Kelautan dan Perikanan, Universitas Hasanuddin Makassar.
B. Prosedur Kerja
a. Fiksasi
Membersihkan wadah botol kaca kecil sebanyak satu buah untuk
preparat organ gonad karang Galaxea sp dengan menggunakan aquades
dan mengeringkannya dengan menggunakan tissue rol. Meletakkan
preparat ginjal yang telah dipotong tipis / kecil, dan memasukkan larutan
HCL secukupnya kedalam wadah yang sudah berisi preparat hingga
terendam seluruhnya selama 24 jam.
b. Washing
Mengeluarkan larutan HCL yang dipakai pada proses fiksasi.
Memasukkan alkohol 70% secukupnya hingga sampel terendam
seluruhnya. Untuk memaksimalkan pengeluaran HCL, maka botol sampel
yang didalamnya terdapat preparat yang telah terendam dengan alkohol
digerak-gerakkan naik turun secara berulang-ulang. Tahapan ini
berlangsung selama 2x15 menit.
c. Dehidrasi
Mengeluarkan alkohol 70% yang dipakai pada proses washing,
memasukkan alkohol 70% kedalam botol sampel sehingga potongan
sampel terendam seluruhnya. Selanjutnya secara bertahap alkohol 70%

9
diganti dengan alkohol 80%, dan 96%. Pada masing-masing tahapan
dehidrasi, sampel direndam dengan durasi 2X15 menit.
d. Clearing
Mengeluarkan Alkohol 96% dari wadah dengan menggunakan pipet tetes,
memasukkan larutan xylene kedalam wadah secukupnya hingga preparat
terendam seluruhnya dengan durasi 2x15 menit
e. Impregnasi
Meletakkan jaringan yang telah direndam di dalam larutan xylene, ke
dalam cassete dan deckle, cassete dan deckle yang telah berisi jaringan
dimasukkan kedalam moldtray yang memiliki 3 wadah. Memasukkan
preparat kedalam wadah I yang mengandung xylene dan parafin murni
dengan perbandingan 1 : 1 selama 30 menit, memasukkan preparat ke
wadah II yang mengandung parafin cair selama 30 menit, dan selanjutnya
memasukkan preparat ke wadah III yang juga berisi parafin cair selama
30 menit
f. Embeding
Jaringan yang sudah diimpregnasi diletakkan dalam lempengan blok
(dibagian worksurf dari Histoembedder) dengan posisi yang sudah diatur
sedemikian rupa. Kemudian lempengan blok ini diisi dengan parafin cair
dan ditutup dengan cassette dan deckle, kemudian didinginkan di cold
plate selama 5-10 menit atau sampai parafin mengeras.
g. Cutting
Proses pemotongan ini dilakukan dengan menggunakan mikrotom.
Sampel dipotong dengan ketebalan 5-7 mikrometer. Preparat yang telah
dipotong diletakkan di objek glass, kemudian ditetesi aquades dan
diletakkan di atas penangas air selama + 24 jam.
h. Staining

10
Memasukkan jaringan ke dalam xylene selama 2x15 menit, kemudian di
rehidrasi dengan alkohol berkonsentrasi tinggi ke konsentrasi rendah
yaitu alkohol 96%, alkohol 80% dan alkohol 70% masing-masing selama
10 menit. Kemudian jaringan direndam dalam aquades selama 10 menit,
setelah itu jaringan dimasukkan dalam pewarna Haematoksilin selama 20
menit, kemudian jaringan dimasukkan dalam eosin selama 1 menit, lalu di
dehidrasi dari alkohol konsentrasi rendah ke tinggi 70%, 80%, dan 96%
masing-masing selama 10 menit. Proses terakhir yakni jaringan ini
dicelupkan ke dalam xylene dan ditiriskan, lalu objek glass diberi entelan
dan ditutup dengan deglass, kemudian diamati dibawah mikroskop.
i. Mounting
gunakan etelan sebagai media perekat pada deck glass setelah kering
selama 5 menit, deck glass tadi di amati dimikroskop.

11
IV. HASIL DAN PEMBAHASAN
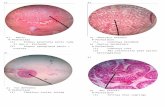
A. Gambar Histologi Karang Goniopora sp.
B. Prosedur Histologi
a. Fiksasi
Membersihkan wadah botol kaca kecil sebanyak satu buah untuk
preparat organ gonad karang Galaxea sp dengan menggunakan aquades
dan mengeringkannya dengan menggunakan tissue rol. Meletakkan
preparat ginjal yang telah dipotong tipis / kecil, dan memasukkan larutan
HCL secukupnya kedalam wadah yang sudah berisi preparat hingga
terendam seluruhnya selama 24 jam.
b. Washing
Mengeluarkan larutan HCL yang dipakai pada proses fiksasi.
Memasukkan alkohol 70% secukupnya hingga sampel terendam
seluruhnya. Untuk memaksimalkan pengeluaran HCL, maka botol sampel
yang didalamnya terdapat preparat yang telah terendam dengan alkohol
digerak-gerakkan naik turun secara berulang-ulang. Tahapan ini
berlangsung selama 2x15 menit.
c. Dehidrasi
Mengeluarkan alkohol 70% yang dipakai pada proses washing,
memasukkan alkohol 70% kedalam botol sampel sehingga potongan
sampel terendam seluruhnya. Selanjutnya secara bertahap alkohol 70%
diganti dengan alkohol 80%, dan 96%. Pada masing-masing tahapan
dehidrasi, sampel direndam dengan durasi 2X15 menit.

12
d. Clearing
Mengeluarkan Alkohol 96% dari wadah dengan menggunakan pipet tetes,
memasukkan larutan xylene kedalam wadah secukupnya hingga preparat
terendam seluruhnya dengan durasi 2x15 menit
e. Impregnasi
Meletakkan jaringan yang telah direndam di dalam larutan xylene, ke
dalam cassete dan deckle, cassete dan deckle yang telah berisi jaringan
dimasukkan kedalam moldtray yang memiliki 3 wadah. Memasukkan
preparat kedalam wadah I yang mengandung xylene dan parafin murni
dengan perbandingan 1 : 1 selama 30 menit, memasukkan preparat ke
wadah II yang mengandung parafin cair selama 30 menit, dan selanjutnya
memasukkan preparat ke wadah III yang juga berisi parafin cair selama
30 menit
f. Embeding
Jaringan yang sudah diimpregnasi diletakkan dalam lempengan blok
(dibagian worksurf dari Histoembedder) dengan posisi yang sudah diatur
sedemikian rupa. Kemudian lempengan blok ini diisi dengan parafin cair
dan ditutup dengan cassette dan deckle, kemudian didinginkan di cold
plate selama 5-10 menit atau sampai parafin mengeras.
g. Cutting
Proses pemotongan ini dilakukan dengan menggunakan mikrotom.
Sampel dipotong dengan ketebalan 5-7 mikrometer. Preparat yang telah
dipotong diletakkan di objek glass, kemudian ditetesi aquades dan
diletakkan di atas penangas air selama + 24 jam.
h. Staining

13
Memasukkan jaringan ke dalam xylene selama 2x15 menit, kemudian di
rehidrasi dengan alkohol berkonsentrasi tinggi ke konsentrasi rendah
yaitu alkohol 96%, alkohol 80% dan alkohol 70% masing-masing selama
10 menit. Kemudian jaringan direndam dalam aquades selama 10 menit,
setelah itu jaringan dimasukkan dalam pewarna Haematoksilin selama 20
menit, kemudian jaringan dimasukkan dalam eosin selama 1 menit, lalu di
dehidrasi dari alkohol konsentrasi rendah ke tinggi 70%, 80%, dan 96%
masing-masing selama 10 menit. Proses terakhir yakni jaringan ini
dicelupkan ke dalam xylene dan ditiriskan, lalu objek glass diberi entelan
dan ditutup dengan deglass, kemudian diamati dibawah mikroskop.
i. Mounting
Gunakan etelan sebagai media perekat pada deck glass setelah kering
selama 5 menit, deck glass tadi di amati dimikroskop.

14
V. SIMPULAN DAN SARAN
A. Simpulan
B. Saran
DAFTAR PUSTAKA
Ali, I. 2007. Jaringan Otot. http://iqbalali.com/2007/04/29/jaringan-otot/. [Diakses tanggal 29 Maret 2010]
Bavelander G, dkk. 1998. Dasar-Dasar Histologi. Erlangga. Jakarta.










![Lap KA I [Lengkap]](https://static.fdokumen.com/doc/165x107/577ce4951a28abf1038ea80b/lap-ka-i-lengkap.jpg)