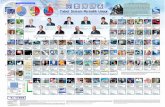
Sistem periodik unsur
-
Upload
fakhriyah-elita -
Category
Education
-
view
68 -
download
0
Transcript of Sistem periodik unsur

KIMIASistem Periodik Unsur
Kelompok 1 :
- Cindy Reisa- Diana Islamiah
- Dwi Rahayu- Fakhriyah Elita
- Riani Sirait

Hubungan Sistem Periodik dengan
Konfigurasi ElektronKonfigurasi elektron sangat erat hubungannya dengan sistem periodik unsur. Jika jumlah elektron luar yang mengisi orbital dalam subkulit sama dengan bilangan kuantum utama (n), maka atom unsur tersebut pasti terletak pada golongan yang sama (selain yang berbentuk ion). Sedangkan nilai n (bilangan kuantum utama) yang terbesar menunjuk nomor periode unsur tersebut dalam sistem periodik unsur.Misal konfigurasi elektron unsur K sebagai berikut:
19K : 1s2 2s2 2p6 3s2 3p6 4s1.
Nilai n terbesar adalah 4, maka K menempati periode 4

Dengan berkembangnya pengetahuan tentang struktur atom, dapat disimpulkan bahwa sifat-sifat unsur ditentukan oleh konfigurasi elektronnya, terutama oleh elektron valensi. Unsur-unsur yang memiliki struktur elektron terluar (elektron valensi) yang sama ditempatkan pada golongan (kolom) yang sama. Dengan demikian, unsur-unsur yang segolongan memiliki sifat-sifat kimia yang sama.
Distribusi elektron-elektron terluar pada subkulit s, p, d, f sangatlah menentukan sifat-sifat kimia suatu unsur. Oleh, karena itu, unsur-unsur perlu dibagi 3 kelompok

1. Unsur-Unsur Utama (Representatif)
Unsur-unsur utama adalah unsur-unsur yang pengisian elektronnya berakhir pada subkulit s atau subkulit p. Blok p disebut unsur representative dikarenakan disitu terdapat semua jenis logam, nonlogam dan metaloid.
Aturan penomoran golongan unsur utama :a. Nomor golongan sama dengan jumlah elektron di
kulit terluar.b. Nomor golongan dibubuhi huruf A (sistem
Amerika).

Beberapa contoh unsur dan golongannya :


Catatan:1. Hidrogen, dengan konfigurasi elektron 1s1, tidak
termasuk golongan IA (alkali), meskipun sering ditempatkan sekolom dengan golongan alkali. Akan tetapi, hidrogen tidak dapat dimasukkan ke dalam golongan manapun, dan sebaiknya ditempatkan di tengah-tengah pada bagian atas sistem periodik.
2. Helium, dengan konfigurasi elektron 1s2, adalah salah satu gas mulia. Jadi, meskipun hanya memiliki dua elektron, helium termasuk golongan VIIIA.

2. Unsur-Unsur Transisi (Peralihan)
Unsur-unsur transisi adalah unsur-unsur yang pengisian elektronnya berakhir pada subkulit d. Berdasarkan prinsip Aufbau, unsur-unsur transisi baru dijumpai mulai periode 4. Pada setiap periode kita menemukan 10 buah unsur transisi, sesuai dengan jumlah elektron yang dapat ditampung pada subkulit d. Diberi nama transisi karena terletak pada daerah peralihan antara bagian kiri dan kanan sistem
periodik.


Aturan penomoran golongan unsur transisi adalah:a. Nomor golongan sama dengan jumlah elektron
pada subkulit s ditambah d yang terakhir.b. Nomor golongan dibubuhi huruf B.
Catatan:1. Jika s + d = 8, 9, 10, termasuk golongan VIIIB.2. Jika s + d = 11, termasuk golongan IB.3. Jika s + d = 12, termasuk golongan IIB.


3. Unsur-UnsurTransisi Dalam
Unsur-unsur transisi–dalam adalah unsur-unsur yang pengisian elektronnya berakhir pada subkulit f. Unsur-unsur transisi-dalam hanya dijumpai pada periode keenam dan ketujuh dalam sistem periodik, dan ditempatkan secara terpisah di bagian bawah. Sampai saat ini, unsur-unsur transisi-dalam belum dibagi menjadi golongan-golongan seperti unsur utama dan transisi.

Unsur-unsur ini baru dibagi menjadi dua golongan besar, yaitu unsur lantanida dan unsur aktinida. Unsur-unsur lantanida (seperti lantanum), adalah unsur-unsur yang elektron terakhirnya mengisi subkulit 4f dan unsur-unsur aktinida(seperti aktinum), adalah unsur-unsur yang elektron terakhirnya mengisi subkulit 5f.


Kegunaan Sistem PeriodikSistem periodik dapat digunakan untuk
memprediksi harga bilangan oksidasi, yaitu:1. Nomor golongan suatu unsur, baik unsur utama
maupun unsur transisi, menyatakan bilangan oksidasi tertinggi yang dapat dicapai oleh unsur tersebut. Hal ini berlaku bagi unsur logam dan unsur non logam.
2. Bilangan oksidasi terendah yang dapat dicapai oleh suatu unsur bukan logam adalah nomor golongan dikurangi delapan. Adapun bilangan oksidasi terendah bagi unsur logam adalah nol. Hal ini disebabkan karena unsur logam tidak mungkin mempunyai bilangan oksidasi negatif.

Kaitan Sistem Periodik dan Aturan Aufbau; Blok s, p, d, dan f.

Dapat kita lihat bahwa asas Aufbau bergerak dari kiri ke kanan sepanjang periode, kemudian meningkat ke periode berikutnya. Setiap periode dimulai dengan subkulit ns dan ditutup dengan subkulit np (n = nomor periode).
Berdasarkan jenis orbital yang ditempati oleh elektron terakhir, unsur-unsur dalam sistem periodik dibagi atas blok s, blok p, blok d, dan blok f.
• Blok s: golongan IA dan IIA• Blok s tergolong logam aktif, kecuali H dan He. H tergolong
nonlogam, sedangkan He tergolong gas mulia.• Blok p: golongan IIIA sampai dengan VIIIA• Blok p disebut juga unsur-unsur representatif karena di situ
terdapat semua jenis unsur logam, nonlogam, dan metaloid.• Blok d: golongan IIIB sampai dengan IIB• Blok d disebut juga unsur transisi, semuanya tergolong logam.• Blok f: lantanida dan aktinida• Blok f disebut juga unsur transisi–dalam, semuanya tergolong
logam. Semua unsur transisi–dalam periode 7, yaitu unsur-unsur aktinida, bersifat radioaktif.

Sekian,Terima kasih^^