PERIODIK UNSUR
-
Upload
ariyana-intan -
Category
Documents
-
view
120 -
download
15
description
Transcript of PERIODIK UNSUR

PERIODIK UNSURAnggota Kelompok :
Baiq Hurun Infarlina (E1M 011 004)Dewi Citrawati (E1M 011 006)
Heru Bustanil Majdi (E1M 011 014)Kastri Aswari (E1M 011 018)
Lusi Lolita (E1M 011 024)Zunnurraini (E1M 011 045)

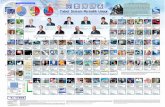
SISTEM PERIODIK MODERN
Semula diyakini bahwa sifat unsur merupakan fungsi periodic dari massa atomnya, yang dikenal dengan hukum periodik.
Saat ini hal demikian tidak diyakini lagi, sehingga hukum periodiknya menjadi sifat unsur merupakan fungsi periodik dari nomor atomnya, yang dikemukakan oleh Moseley


Sistem periodik bentuk panjang terdiri atas, Periode dan Golongana. Periode adalah lajur yang horizontal.
Periode menunjukan jumlah kulit elektron yang dimiliki atom.Unsur-unsur yang terletak dalam satu periode memiliki jumlah kulit yang sama.• Periode 1, terdiri dari 2 buah unsur periodik sangat
pendek•Periode 2, terdiri dari 8 buah unsur periodik pendek•Periode 3, terdiri dari 8 buah unsur periodik pendek•Periode 4, terdiri dari 18 buah unsur periodik
panjang•Periode 5, terdiri dari 18 buah unsur periodik
panjang• Periode 6, terdiri dari 32 buah unsur periodik sangat
panjang• Periode 7, terdiri dari 23 buah unsur periodik belum
lengkap

b. Golongan adalah lajur yang fertikal dan ditulis dengan angka Romawi.
GOLONGAN DALAM PERIODIK UNSUR
GOLONGAN UTAMAGOLONGAN UNSUR
TRANSISI

Golongan utama (golongan A)a. Golongan IA (Golongan Alkali)Sifat Periodik : Sulit
mengalami reduksi dan mudah mengalami oksidasi, Termasuk zat pereduksi kuat (memiliki 1 buah elektron)
Sifat Fisik : Semua unsur berwujud padat pada suhu ruangan, Memiliki warna yang jelas dan khas
Sifat Kimia : Sangat reaktif, Dapat membentuk senyawa basa kuat, Mudah larut dalam air (kelarutannya semakin ke bawah semakin besar)

b. Golongan IIA (Golongan Alkali tanah)
Sifat periodik : mudah mengalami oksidasi, termasuk zat pereduksi kuat ( memiliki 2 buah elektron, sehingga tidak sekuat golongan alkali)
Sifat fisik : Semua unsurnya berwujud padat pd suhu ruangan, Kerapatan logam alkali tanah lebih besar, shg logam alkali Tanah lebih keras
Sifat kimia : Mudah bereaksi dengan unsur non logam, Bersifat reaktif

c. Golongan IIIA (Golongan Aluminium)
Sifat-sifat unsur golongan yang terletak pada golongan III A (B, Al, Ga, In, Ti) adalah sebagai berikut :Memiliki energi ionisasi yang merendah semakin ke
bawah namun kembali naik pada unsur TiMemiliki jari-jari atom yang semakin tinggi semakin
ke bawahSifat logam semakin tinggi semakin ke bawahBoron secara alami tidak reaktif kecuali pada
temperatur tinggi, sedangkan Alumunium sangat reaktif
Membentuk ikatan kovalen dengan unsur halogen (Cl, Br, F) dan mempunyai titik didih yang rendah (bersifat volatil)
Dapat membentuk senyawa kompleks hidrat

d. Golongan IVA (Golongan Karbon)
Sifat umum golongan karbon :Mempunyai empat elektron valensiMampu membentuk senyawa katenasi, yaitu
membentuk rantai dari atom-atomnya sendiriBilangan oksidasi C, Si, Ge dalam senyawa
minimal -4 dan maksimal +4, untuk Sn dan Pb adalah +2 dan +4.

e. Golongan VA (Golongan Nitrogen)
Sifat-sifat yang terletak pada golongan V A (N, P, As, Sb, Bi) adalah sebagai berikut :Energi ionisasi sangat tinggi, sehingga sukar untuk
membentuk kationOksida Sb membentuk oksida amfoter, sedangkan N, P, As
membentuk oksida asam dan Bi membentuk oksida basaKecuali N, dapat mempunyai bilangan oksidasi 6As dan Sb berbentuk unsur metaloidDapat membentuk senyawa hidrida yang makin menurun
kestabilannyaKecuali N, dapat bertindak sebagai konduktor listrikDi alam terdapat bebas dalam bentuk mineral seperti
Apait Ca5(PO4)3 OH, Orpiment As2S3, Stibnit Sb2S3, Bismuthinite Bi2S3

f. Golongan VIA (Golongan Kalkogen/ Oksigen)Beberapa sifat fisika unsur golongan 16 Jari- jari atom dan ion
Jari-jari atom dan ion dari meningkat dari atas ke bawah dalam satu golongan. Hal ini disebabkan oleh adanya peningkatan jumlah kulit elektron
Energi Ionisasi Energi ionisasi kelompok oksigen lebih kecil dibandingkan dengan kelompok nitrogen. Dari atas ke bawah energi ionisasi menurun. Energi ionisasi oksigen seharusnya lebih besar daripada N karena penurunan ukuran. Hal ini disebabkan nitrogen telah terisi lengkap setengah orbital dan konfigurasinya stabil karena konfigurasi setengah diisi dan terisi penuh. Sedangkan O kurang stabil sehingga energi ionisasinya kecil (Anonymous, 2010).
Elektronegatifitas Oksigen unsur kedua yang paling elektronegatif setelah fluor. Elektronegatifitas menurun dari atas ke bawah dalam satu golongan karena peningkatan ukuran atom (Anonymous, 2010)..
Afinitas Elektron Unsur-unsur golongan ini memiliki afinitas elektron tinggi.

g. Golongan VIIA (Golongan Halogen)
1) Halogen merupakan golongan yang sangat reaktif dalam menerima elektron dan bertindak sebagai oksidator kuat dalam satu golongan. Makin ke atas, oksidator makin kuat.2) Keelektronegatifan halogen dalam satu golongan makin ke atas makin besar. Unsur yang paling elektronegatif dibanding unsur lain dalam sistem periodik adalah fluor (perhatikan data keelektronegatifan).3) Jari-jari atom halogen dalam satu golongan makin ke atas makin kecil (perhatikan data). Ini berarti makin ke atas ukuran molekul makin kecil, maka gaya tarik-menarik antar-molekul (gaya Van der Waals) akan makin kecil. Perhatikan juga titik didih dan titik lelehnya, makin ke atas makin kecil. Unsur halogen sangat berbahaya terhadap mata dan tenggorokan. Unsur halogen mempunyaibau yang merangsang dan berwarna. Walaupun brom berwujud cair, tetapi brom mudah sekali menguap. Begitu juga iodium, mudahsekali menyublim.4) Unsur golongan halogen bersifat oksidator.

h. Golongan VIIIA (Golongan Gas Mulia)Struktur elektron terluar gas mulia yang oktet (8) (kecuali helium duplet (2)) merupakan struktur yang paling stabil, oleh karena itu gas mulia sukar bereaksi dengan unsur lain sehingga disebut gas inert (lamban).
Wujud gas muliaUnsur gas mulia terdapat sebagai gas tak berwarna yang monoatomik, ini erat kaitannya dengan struktur elektron oktet dan duplet dari gas mulia. Sedangkan wujud gas pada suhu kamar disebabkan titik cair dan titik didih gas mulia yang rendah.
Titik cair dan titik didihTitik cair dan titik didih gas mulia meningkat dengan bertambahnya nomor atom. Hal ini disebabkan semakin bertambahnya gaya dispersi antar atom gas mulia sesuai bertambahnya massa atom relatif (Ar).
KelarutanKelarutan gas mulia dalam air bertambah besar dari Helium (He) hingga Radon (Rn). Pada suhu 0 °C dalam 100 ml air terlarut 1 ml He, 6 ml Ar, dan 50 ml Rn.
Unsur-unsur gas mulia mengandung 8 elektron pada kulit terluarnya kecuali He mengandung 2 elektron.
Energi ionisasinya sangat tinggi, akibatnya unsurunsur gas mulia sukar bereaksi dengan unsurunsur lainnya.
Molekul gas mulia monoatomik.

2. Golongan unsur transisi/ Gol BUNSUR
TRANSISI
Unsur blok f (Unsu
r transi
si dalam
)
Unsur blok d
(golongan IIIB,
IVB, VB, VIB, VIIB, VIIIB,
IB, dan IIB),
Unsur transisi mempunyai siat-sifat khas yang membedakan dari unsure glongan utama,antara lain :a) Sifat logam, semua unsure transisi tergolong logam dengan titk cair dan titik didih yangrelatif tinggi.b) Bersifat paramegnetik (sedikit tertarik ke dalam medan magnet).c) Membentuk senyawa-senyawa yang berwarna.d) Mempunyai beberapa tingkat oksidasi.e) Membentuk berbagai macam ion kompleks.f) Berdaya katalitik, banyak unsur transisi atau senyawanya yang berfungsi sebagai katalis, baik dalam proses industri maupun dalam metabolisme

Unsur blok d (golongan IIIB, IVB, VB, VIB, VIIB, VIIIB, IB, dan IIB)

Unsur transisi dalam meliputi :
A. Deret lantanidaLantanida adalah kelompok unsur kimia yang terdiri
dari 15 unsur, mulai lantanum (La) sampai lutetium (Lu) pada tabel periodik, dengan nomor atom 57 sampai 71. Semua lantanida, kecuali lutetium, adalah unsur blok-f yang berarti bahwa elektronnya terisi sampai orbit 4f. Golongan ini diberi nama berdasarkan lantanum.
B. Deret aktinidaAktinida adalah kelompok unsur kimia yang mencakup
15 unsur antara aktinium dan lawrensium pada tabel periodik, dengan nomor atom antara 89 sampai dengan 103. Seri ini dinamakan menurut unsur aktinium. Semua aktinida, kecuali lawrensium merupakan unsur blok-f. Unsur-unsur kelompok aktinida adalah radioaktif, dengan hanya aktinium, torium, dan uranium yang secara alami ditemukan di kulit bumi.

SIFAT-SIFAT KEPERIODIKAN UNSURPengelompokkan unsur-unsur seperti pada sistem periodik modern ternyata menghasilkan beberapa sifat yang berubah secara periodik.
SIFAT-SIFAT KEPERIODI
KAN UNSUR

JARI-JARI ATOM Jari-jari atom dipengaruhi : jumlah kulit atom bertambah, makin besar jari-jari atom. Jumlah proton bertambah, gaya tarik inti makin kuat, Jari-jari
atom makin kecil
Kecenderungan jari-jari atom dalam sistem periodikDari atas ke bawah ( segolongan ) cenderung bertambah.
Dari kiri ke kanan ( seperiode ) cenderung berkurang.
Dalam satu golongan semakin kebawah jumlah kulit bertambah (periode bertambah) jarak inti terhadap elektron di kulit terluar makin jauh jari-jari atom bertambah.
Dalam satu periode (jumlah kulit tetap) semakin kekanan no atom bertambah (proton bertambah , partikel inti makin besar) gaya tarik inti terhadap elektron kulit terluar makin kuat jari-jari atom makin kecil.


ENERGI IONISASIEnergi ionisasi adalah energi yang diperlukan untuk
melepas satu elektron yang terikat paling lemah dari atom yang berbentuk gas.A(g) A+ (g) + e–
Energi ionisasi erat hubungannya dengan jari-jari dan kestabilan.Makin besar jari-jari atom makin kecil energi
ionisasinya.Makin stabil suatu atom makin besar energi ionisasinya.Kecenderungan energi ionisasi dalam sistem periodikDalam satu golongan dari atas ke bawah cenderung
berkurang.Dalam satu periode dari kiri ke kanan cenderung
bertambah

ENERGI IONISASI

AFFINITAS ELEKTRONAffinitas elektron ialah besarnya energi yang menyertai
(dilepaskan / diserap) jika atom dalam bentuk gas mengikat/ menerima satu elektron.
Y(g) + 1e– Y– (g)Unsur-unsur halogen paling mudah menerima elektron
karena afinitas elektronnya besar. Harga afinitas bertanda Negatif krn atom gas saat menyerap elektron disertai pelepasan energi.
Unsur-unsur gas mulia memiliki afinitas paling kecil sehingga sulit menerima elektron Harga afinitas bertanda Positif krn saat menyerap elektron diperlukan energi.
Afinitas elektron yang bertanda positif berarti atom saat menyerap elektron memerlukan energi, yaitu unsur gol IIA dan VIIIA
Dalam satu golongan dari atas ke bawah, affinitas elektron semakin berkurang.
Dalam satu periode dari kiri ke kanan, affinitas elektron semakin bertambah

AFINITAS ELEKTRON

KEELEKTRONEGATIFAN
Keelektronegatifan : Kemampuan suatu atom untuk menarik elektron dari atom lain dalam suatu ikatan. Pauling menyusun harga keelektronegatifan atom-
atom tanpa satuan. Unsur F merupakan unsur yang paling mudah menarik elektron dalam ikatan dan diberi harga keelektronegatifan 4 ( merupakan standar ). Unsur Fr memiliki harga keelektronegatifan paling kecil yaitu 0,7.
Kecenderungan keelektronegatifan dalam sistem periodik
Dari atas ke bawah ( segolongan ) cenderung berkurang.
Dari kiri ke kanan ( seperiode ) cenderung bertambah

Sifat Logam
Ditinjau dari konfigurasi elektron, unsur-unsur logam cenderung melepas elektron ( memiliki energi ionisasi kecil ), sedangkan unsur-unsur bukan logam cenderung menangkap elektron ( memiliki keelektronegatifan besar ). Dengan demikian dalam sistem periodik sifat-sifat logam :
Dari atas ke bawah ( segolongan ) cenderung berkurang.
Dari kiri ke kanan ( seperiode ) cenderung berkurang

Kereaktifan
Reaktif artinya mudah bereaksi. Unsur-unsur logam pada sistem periodik
makin ke bawah makin reaktif ( makin mudah bereaksi ), sebab makin mudah melepas elektron. Misalnya kalium lebih reaktif dibanding natrium.
Unsur-unsur non logam pada sistem periodik makin ke bawah makin kurang reaktif ( makin sukar bereaksi ), karena makin sukar menangkap elektron. Misalnya fluorin lebih reaktif dibandingkan klorin.

Titik Didih dan Titik LelehDari kiri ke kanan titik leleh dan titik didih mula-
mula naik secara bertahap dan mencapai puncaknya pada golongan IVA kemudian turun secara drastis.
Titik leleh dan titik didih tertinggi dimiliki unsur golongan IVA sedangkan terendah dimiliki oleh unsur golongan VIIIA.
Bagi unsur-unsur logam dalam satu golongan, titik leleh dan titik didih makin ke bawah makin rendah. Sebaliknya bagi unsur-unsur non logam segolongan, titik leleh dan titik didih makin ke bawah makin tinggi.