Sistem Periodik
Transcript of Sistem Periodik

5/13/2018 Sistem Periodik - slidepdf.com
http://slidepdf.com/reader/full/sistem-periodik-55a755d430555 1/5
Sistem Periodik
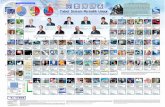
Sistem Periodik Modern disusun berdasarkan konfigurasi elektron (nomor atom) yang dituangkan dalam
bentuk tabel. Tabel Periodik terdiri dari baris dan kolom. Baris disebut perioda, sedangkan kolom
disebut golongan. Unsur-unsur yang jumlah kulitnya sama, diletakkan pada perioda yang sama.
Nomor perioda = Jumlah Kulit
Unsur-unsur yang struktur elektron terluarnya (elektron valensinya) sama diletakan pada golongan
yang sama. Karena sifat kimia ditentukan oleh struktur elektron valensi maka unsur-unsur segolongan
mempunyai sifat kimia yang mirip.
Untuk menentukan golongan, unsur-unsur dibagi menjadi tiga kelompok, yaitu unsur utama (A), unsur
transisi (B), dan unsur transisi dalam.
a. Unsur Utama (A)
Unsur-unsur yang pengisian elektronnya berakhir pada subkulit s atau subkulit p
nsx atau ns
2np
yn = perioda, nomor golongan = x atau nomor golongan = 2 + y
PENGECUALIAN !!
1H [1s1] : Hidrogen tidak mempunyai golongan
2He [1s2] : Helium termasuk gas mulia (VIIIA)
b. Unsur transisi (B)
Unsur-unsur yang pengisian elektronnya berakhir pada subkulit d.
nsx(n - 1)d
zn = perioda
x + z = nomor golonganPENGECUALIAN !!
Jika x + z = 9 golongan VIIIB
Jika x + z = 10 golongan VIIIB
Jika x + z = 11 golongan IB
Jika x + z = 12 golongan IIB
Nomor
golongan
Nama
Golongan
Elektron
Valensi
IA Alkali ns1
IIA Alkali Tanah ns2
IIIA Boron-Al ns2
np1
IVA Karbon ns2
np2
VA Nitrogen ns2
np3
VIA Oksigen ns2
np4
VIIA Halogen ns2 np5 VIIIA Gas Mulia ns
2np
6

5/13/2018 Sistem Periodik - slidepdf.com
http://slidepdf.com/reader/full/sistem-periodik-55a755d430555 2/5
c. Unsur Transisi Dalam
Unsur-unsur yang pengisian elektronnya berakhir pada subkulit f.
y Lantanida : berakhir di 4f (nomor atom 58 sampai 71)
y Aktinida : berakhir di 5f (nomor atom 90 sampai dengan 103)
Contoh Soal 1
Unsur yang terletak pada periode kelima golongan IIIB mempunyai konfigurasi elektron..
Jawab
Periode ke-5, n = 5, gol. III B = unsur transisi, jadi..
nsx(n - 1)d
z= 5s
24d
1
1s2
2s2
2p6
3s2
3p6
4s2
3d10
4p6
5s2
4d1
Contoh Soal 2
Di antara unsur-unsur 3P 12Q 19R 33S 53T, yang terletak pada golongan yang sama adalah..
Jawab
3P : [He] 2s1
(2/IA) 33S : [Ar] 4s2
3d10
4p3
(4/ VA)
12Q : [Ne] 3s2 (3/IIA) 53T : [Kr] 5s2 4d10 5p5 (5/VIIIA)
19R : [Ar] 4s1
(4/IA)
Jawaban : P dan R
Contoh Soal 3
Pada Tahun 1998, tim dari Dubna (Rusia) berhasil mensintesis unsur dengan nomor atom 114. Unsur
tersebut termasuk golongan
114X : [Rn] 7s2 5f 14 6d10 7p2
Jawaban : Golongan IV A

5/13/2018 Sistem Periodik - slidepdf.com
http://slidepdf.com/reader/full/sistem-periodik-55a755d430555 3/5
Contoh Soal 4
Unsur yang elektron terakhirnya memiliki bilangan kuantum n = 3, l = 2, m = -1, s = +1/2 dalam sistem
periodik terletak pada periode dan golongan.
n = 3, l = 2, m = -1, s = +1/2 = 3d2
nX : [Ar] 4s2
3d2
Jawaban : periode 4, golongan IVB
Sifat-sifat Periodik
a. Jari-jari atom ( r )
Jari-jari atom adalah jarak dari inti hingga kulit terluar. Unsur yang mempunyai jari-jari terbesar
ialah fransium (Fr, golongan IA), terletak pada bagian kiri-bawah sistem periodik.
b. Sifat Logam
Sifat logam meliputi daya hantar listrik/panas, dapat ditempa, dapat diregangkan, sangat erat
kaitannya dengan kecenderungan atom untuk melepas elektron. Makin mudah melepas
elektron (r besar, EI kecil) maka sifat logam makin bertambah.
Unsur yang mempunyai sifat logam paling kuat adalah fransium (Fr, golongan IA) terletak pada
bagian kiri-bawah sistem periodik.
c. Sifat Basa
d. Sifat Reduktor
Adalah sifat atom suatu unsur yang cenderung melepas elektron (mengalami oksidasi)
e. Affinitas Elektron (AE)
Adalah energi yang dibebaskan pada saat suatu atom menangkap elektron. Makin jauh elektron
dari inti makin besar energinya. Bila elektron yang ada di luar atom, ditangkap dan menempati salah
satu kulit (tingkat energi) dalam atom, maka elektron tersebut harus membuang sebagian energinya
agar setara dengan tingkat energi kulit elektron yang ditempatinya.
f. Energi Ionisasi (EI)
Adalah energi yang diperlukan untuk melepaskan elektron pada kulit terluar. Makin kecil EI
makin mudah melepaskan elektron, dan sebaliknya. Unsur yang mempunyai EI terbesar adalah Helium
(He, golongan VIIIA), terletak pada bagian kanan-atas sistem periodik.

5/13/2018 Sistem Periodik - slidepdf.com
http://slidepdf.com/reader/full/sistem-periodik-55a755d430555 4/5
g. Keelektronegatifan (KE)
Kecenderungan atom untuk menangkap (menarik) elektron. Makin besar (KE) makin mudah
menangkap elektron. Unsur yang mempunyai KE terbesar adalah Fluorin (F, golongan VIIA), terletak
pada bagian kanan atas sistem periodik.
h. Sifat oksidator
Adalah sifat atom suatu unsur yang cenderung menangkap elektron (mengalami reduksi).
i. Sifat Asam
j. Kereaktifan
Unsur logam:
y Ke kanan makin kurang reaktif, ke bawah makin reaktif
Unsur nonlogam:
y Ke kanan makin reaktif, ke bawah makin kurang reaktif.
k. Titik leleh dan titik didih
y Titik leleh dan titik didih unsur logam terutama ditentukan oleh ikatan loga
y Titik leleh dan titik didih unsut non logam terutama ditentukan oleh gaya Van der Waals.
Unsur logam
y Ke kanan makin tinggi, ke bawah makin rendah
Unsur non logam:
y Ke kanan makin rendah, ke bawah makin tinggi
EI
Elektronegativitas
Biloks
Oksidator
Affinitas
Asam
Jari2
Volum
Konduktivitas
Logam
Reduktor
basa

5/13/2018 Sistem Periodik - slidepdf.com
http://slidepdf.com/reader/full/sistem-periodik-55a755d430555 5/5
Contoh Soal
Konfigurasi elektron dari beberapa unsur adalah sebagai berikut:
P [Ar] 3d10
4s2
4p6
5s1
R [Ar] 3d10
4s2
4p3
Q [Ar] 3d10
4s2
4p6
5s2
S [Ar] 4s2
Pernyataan yang benar adalah
(1) energi ionisasi P lebih kecil dari Q (2) keelektronegatifan R lebih tinggi dari P
(3) kereaktifan Q lebih besar dari S
(4) jari-jari atom S lebih kecil dari R
Jawab
P [Ar] 3d10 4s2 4p6 5s1 (5/IA) R [Ar] 3d10 4s2 4p3 (4/VA)
Q [Ar] 3d10 4s2 4p6 5s2 (5/IIA) S [Ar] 4s2 (4/IIA)
S R
P Q
Jawaban : 1 dan 3














![[New] Sejarah an Sistem Periodik](https://static.fdokumen.com/doc/165x107/5571f7cf49795991698c0bac/new-sejarah-an-sistem-periodik.jpg)