Bahan Ajar Sistem Periodik Unsur
-
Upload
bimbel-briliant -
Category
Documents
-
view
187 -
download
4
description
Transcript of Bahan Ajar Sistem Periodik Unsur


- Page1 -
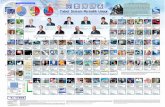
SISTEM PERIODIK UNSUR
1. Penentuan periode dan golongan: a. untuk menentukan periode: lihat n yang terbesar. b. untuk menentukan golongan: lihat min 3 subkulit terakhir.
Gol. utama El. valensi Gol. transisi El. valensi IA ns1 IIIB (n-1) d1 ns2
IIA ns2 IVB (n-1) d2 ns2
IIIA ns2 np1 VB (n-1) d3 ns2
IVA ns2 np2 VIB (n-1) d5 ns1
VA ns2 np3 VIIB (n-1) d5 ns2
VIA ns2 np4 VIIIB (n-1) d6, 7, 8 ns2
VIIA ns2 np5 IB (n-1) d10 ns1
VIIIA ns2 np6 IIB (n-1) d10 ns2
2. Sistem periodic unsur menurut Dobereiner: a. kelompokkan unsure-unsur yang punya kesaman sifat kimi. b. masing-masing kelompok terdiri 3 unsur = triad yang disusun menurut kenaikan massa atom. c. massa atom tengah = massa tom rata-rata unsure I dan III.
3. Sistem periodic unsur menurut Newland: a. dikelompokkan menurut kenaikan massa atom. b. sifat unsur ditemukan lagi secara periodic setelah 8 unsur (oktaf).
4. Sistem periodic Meyer dan Mendeleyev: a. disusun berdasar kenaikan massa atom. b. unsur yang sifat kimianya sama diletakkan dibawah unsur yang telah ada.
kelemahan: penempatan unsur Te (128) di depan I (127). 5. Sistem periodic Moseley (yang dipakai sekarang):
a. disusun berdasar kenaikan nomor atom. b. sifat unsur merupakan fungsi dari nomor atomnya. c. deret horizon disebut periode, vertical disebut golongan.
6. Unsur-unsur gol. IA s.d. VIIIA → gol. utama. Unsur-unsur gol. IB s.d. VIIIB → gol. transisi. Unsur-unsur gol. lantanida dan aktinida → gol. transisi dalam.
7. Nama-nama lain golongan-golongan: IA = Alkali. IIA = Alkali tanah. IIIA= Boron/Aluminium. IVA = Karbon. VA = Nitrogen.
Briliant Private www.briliantprivate.co.cc

- Page2 -
VIA = Khalkogen. VIIA= Halogen. VIIIA= Gas mulia.
8. Sifat jari-jari atom: Jari – jari atom adalah jarak inti atom sampai kulit terluar dari atom a. dalam 1 gol. dari atas ke bawah bertambah. b. dalam 1 periode dari kiri ke kanan berkurang. Jari – jari ion positif < jari – jari atomnya. Jari – jari ion negativ >jari – jari atomnya
9. Sifat-sifat energi ionisasi(EI): EI adalah energi yang dibutuhkan untuk mengeluarkan electron di kulit terluar a. dalam 1 gol. dari atas ke bawah berkurang. b. dalam 1 periode dari kiri ke kanan bertambah. Pengeculian: EI Golongan IIA > EI Golongan IIIA, juga EI Golongan VA > EI Golongan VI A karena susunan electron golongan IIA lebih stabil daripada IIIA, juga golongan VA lebih stabil daripada VIA sehingga butuh energi ionisasi lebih besar untuk mengeluarkan elektronnya
10. Sifat-sifat afinitas electron Afinitas electron adalah energi yang dibutuhkan/dilepaskan ketika 1 elektron masuk ke dalam atom a. dalam 1 gol. dari atas ke bawah berkurang. b. dalam 1 periode dari kiri ke kanan bertambah Afinitas electron bertanda negative, artinya ada energi yang dilepaskan ketika electron masuk. Atom mudah menjadi ion negative Afinitas electron bertanda positif artinya ada energi yang dibutuhkan ketika electron masuk. Atom sukar menjadi ion negative
11. Sifat-sifat keelektronegatifan: Keelektronegatifan adalah kemampuan atom untuk menarik pasangan electron kearahnya dalam ikatan kimia. Dinyatakan dalam bilangan dari 0 – 4. a. dalam 1 gol. dari atas ke bawah berkurang. b. dalam 1 periode dari kiri ke kanan bertambah
Briliant Private www.briliantprivate.co.cc