klasifikasi tabel periodik unsur
-
Upload
ririn-alchin -
Category
Documents
-
view
2.078 -
download
23
Transcript of klasifikasi tabel periodik unsur
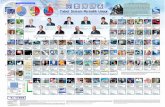
KLASIFIKASI UNSUR- UNSUR DALAM TABEL PERIODIK UNSUR I.PENDAHULUAN Beberapa unsur telah sejak lama menjadi bagian kehidupan manusia. Dalam ilmu kimia kita mempelajari lebih dari 100 unsur di alam. Setiap unsur memiliki sifat-sifat yang khas, disamping itu terdapat pula unsur-unsur yang memiliki kemiripan-kemiripan. Oleh karena jumlah unsur cukup banyak, maka perlu diklasifikasikan kedalam golongan-golongan berdasarkan persamaan sifat-sifatnya. Sifat-sifat unsur yang beragam misalnya wujud unsur dalam suhu kamar ada yang padat, cair dan gas. Pengelompokkan unsur-unsur ini sangat membantu kita dalam memahami kemiripan dan perbedaan diantara unsur-unsur, sehingga memudahkan kita untuk mempelajari mekanisme dan sifat-sifat yang ditunjukkan ketika suatu unsur bergabung dengan unsur lain. II.RUMUSAN MASALAH a. Bagaimana sistem klasifikasi unsur-unsur dalam tabel periodik unsur? 1. Klasifikasi unsur-unsur berdasarkan sifat logam dan nonlogam 2. Klasifikasi unsur-unsur berdasarkan Hukum Triade 3. Klasifikasi unsur-unsur berdasarkan Hukum Oktaf 4. Klasifikasi unsur-unsur berdasarkan Hukum Mendeleyev 5. Klasifikasi unsur-unsur berdasarkan sistem periodik Modern 6. Klasifikasi unsur-unsur berdasarkan struktur elektron b. Bagaimana hubungan sistem periodik dengan konfigurasi electron III.PEMBAHASAN A. Sistem klasifikasi unsur-unsur dalam Tabel Periodik Unsur Sistem periodik unsur adalah sistem pengelompokkan unsur berdasarkan hukum periodik, mencakup periode dan golongan yang keduanya saling berhubungan dan menentukan keperiodikkan sifat unsur, disajikan ke dalam bentuk tabel yang disebut Tabel Periodik Unsur.1 Unsur-unsur dapat1 Mulyono, Ham, Kamus Kimia, (Jakarta : Bumi Aksara, 2007), Hlm. 387
1
diklasifikasikan menurut banyak cara. Cara yang paling tegas ialah berdasarkan wujud pada keadaan SATP (Standard Ambient Temperature and Pressure). Atas dasar ini unsur-unsur dibedakan dalam wujud gas (11 unsur), wujud cair (2 unsur), dan sisanya wujud padat.2 Adapun model pengelompokan unsur-unsur dalam TPU secara umum dibedakan sebagai berikut: 1. Klasifikasi Unsur-Unsur berdasarkan sifat logam dan nonlogam Pengelompokan dengan dasar sifat logam dan nonlogam merupakan metode pengelompokkan yang paling sederhana. Unsur ada yag berrsifat logam, nonlogam dan diantara keduanya (metaloid). Ciri-ciri unsur logam dan nonlogam Logam Kerapatan tinggi Keras, padat Bersifat konduktor Mengkilap elektropositif Oksidanya bersifat basa Nonlogam Kerapatan rendah Rapuh Bersifat isolator Tidak mengkilap elektronegatif Oksidanya bersifat asam
Lebih dari 70% unsur-unsur adalah logam. Logam mempunyai sifat yang sama dalam kemampuannya mengubah bentuk tanpa pecah jika ditempa dengan pemukul atau ditarik untuk meluruskannya. Unsur yang termasuk golongan logam diantaranya Aluminium, Magnesium, Perak, Tembaga, Seng. a. Nonlogam Kebanyakan unsur nonlogam jarang dijumpai dalam bentuk unsurnya yang murni, dalam kehidupan sehari-hari, yang sering dijumpai ialah dalam bentuk senyawa kimia. Unsur yang termasuk golongan nonlogam yaitu Karbon, Belerang, Fosfor, Nitrogen, Oksigen, Hidrogen,2 Kristian, sugiyanto, Kimia Anorganik, (jogjakarta : JICA,2004 ), Hlm. 46
2
Fluor, Brom, Iodium. b. Metaloid Metaloid disebut juga semimetal yaitu unsur yang mempunyai sifat antara logam dan nonlogam. Contohnya : Boron, Silikon, Arsen, Germanium,dll.3 2. Klasifikasi unsur-unsur berdasarkan Hukum Triade Dobereiner J.W Dobereiner merupakan orang pertama yang mengelompokkan unsur-unsur berdasarkan sifat khas atom dan massa atomnya. Dari hasil pengamatannya menunjukkan bahwa tiap tiga unsur yang mempunyai persamaan sifat, jika disusun dalam satu kelompok yang disebut Triade, ternyata massa atom relatif unsur ditengah mendekati setengah jumlah massa atom relatif unsur pertama dan ketiga.4 Contoh : Li Na 6,94 K 23,02 39,10
Ar unsur-unsur yang ditengah menurut Triade
Sistem ini dinilai kurang efisien karena ternyata ada beberapa unsur lain yang tidak termasuk dalam satu Triade, tetapi mempunyai sifatsifat yang mirip dengan Triade tersebut. 3. Klasifikasi usur-unsur berdasarkan Hukum Oktaf Newlands John Newlands menemukan hubungan antara sifat unsur dengan massa atom relatifnya. Jadi unsur ke delapan mempunyai sifat yang sama dengan unsur pertama atau dengan kata lain sifat unsur yang pertama akan terulang secara periodik pada urutan ke delapan. Penemuan John Newlands dikenal3 James Brady. Kimia Universitas Asas & Struktur jilid 1, (jakarta: Binarupa Akasa), hlm.143146 4 Nurchasanah,dkk. Kimia untuk SMA / MA kelas X, (Semarang : Aneka ilmu, 2006), hlm.8
3
dengan hukum oktaf.5 Tabel Pengelompokkan unsur-unsur berdasarkan hukum oktaf NewlandsUnsur H Li Be B C N O No. Atom 1 2 3 4 5 6 7 Unsur F Na Mg Al Si P S No. Atom 8 9 10 11 12 131 14 Unsur Cl K Ca Sr Ti Mn Fe No. Atom 15 16 17 18 19 20 21
Sistem ini hanya berlaku untuk unsur-unsur ringan yang memiliki massa taom relatif (Ar) rendah. Namun demikian, hukum oktaf John Newlands telah menuju usaha yang tepat untuk menyusun diagram unsur. 4. Tabel periodik unsur Mendeleyev Pada tahun 1869, guru kimia Dimitri Mendeleyef menyusun daftar unsur-unsur berdasarkan sifat-sifat fisika dan kimia dan diurutkan menurut massa relatifnya,hukum periodik Mendeleyef berbunyi6 :
Dengan daftar sistem periodik unsur Mendeleyev ini dapat diketahui : a. Perubahan sifat-sifat yang teratur dari unsur-unsur dalam satu golongan5 Sri juari santoso, dkk.Kimia Untuk kelas X, (klaten : PT. Intan Pariwara, 2005), Hlm.37 6 Gatot Luhbandjono, Kimia Dasar 1, (Semarang: UPT UNNES Press, 2004), hlm.49
4
ke golongan lain b. Hubungan antara valensi tertinggi unsur dengan nomor golongannya. c. Ramalan sifat-sifat unsur yang belum diketahui pada saat itu d. Daftar ini tidak banyak berubah walaupun unsur-unsur gas mulia telah ditemukan Daftar Mendeleyef ini mempunyai keterbatasan-keterbatasan diantaranya: a. Panjang periodenya tidak sama b. Beberapaa unsur ada yang terbalik c. Selisih massa atom relatif yang tidak berurutan tidak teratur d. Perubahan sifat unsur ini lambat dari elektromegatif menjadi elektropositif e. Unsur-unsur dari lanthanida dimasukkan kedalam satu golongan f. Besarnya valensi unsur yang lebih dari satu macam valensi sukar diramal kedudukannya dalam sistem periodik g. Sifat anomali unsur pertama setiap golongan tidak ada hubungannya dengan massa atom relatifh.
Jika daftar disusun berdasarkan massa atom relatif,maka isotop unsur yang sama harus ditempatkan pada golongan yang berbeda, sedangkan isobar seperti: 40Ar, 40K, 40Ca harus dimasukkan dalam satu golongan.7
5. Sistem Periodik Modern Daftar asli Mendeleyev mengalami banyak perubahan, namun masih terlihat pada sistem periodik modern. Ada berbagai macam sistem periodik, tetapi yang lebih sering digunakan adalah sistem periodik panjang. Daftar ini disusun berdasarkan konfigurasi elektron dari atom unsur-unsur. Unsur-unsur dengan konfigurasi elektron yang mirip7 http://eddysyahrizal.blogspot.com/2008/08/sejarah-sistem-periodik-unsur.html
5
mempunyai sifat-sifat kimia yang mirip. Jadi sifat unsur ini ada hubungannya dengan konfigurasi elektron.hubungan ini dapat disimpulkan sebagai berikut: 1. Elektron-elektron tersusun dalam orbital 2. Hanya dua elektron saja yang dapat mengisi setiap orbital 3. Orbital-orbital dikelompokkan dalam kulit 4. .Hanya n2 orbital yang dapat mengisi kulit ke-n 5. Ada berbagai macam orbital dengan bentuk yang berbeda. a.Orbital-s,satu orbital setiap kulit b.Orbital p,tiga orbital setiap kulit c.Orbital-d,lima orbital setiap kulitnya d.Orbital f,tujuh orbital setiap kulitnya 6. Elektron terluar yang paling menentukan sifat kimianya,yang disebut dengan elektron valensi. 7. Unsur elektron dalam satu golongan yang sama mempunyai sehingga
valensi
mempunyai sifat yang mirip 8. Satu golongan unsur berubah secaraa teratur 9. Unsur dalam satu perioda mempunyai sifat yang berubah secara teratur Dari penguraian diatas dapat disimpulkan sebagai berikut,bahwa: 1.Sifat unsur merupakan fungsi berkala dari nomor atom
6
2.Sifat unsur bergantung pada konfigurasi elektron.
6. Klasifikasi unsur-unsur berdasarkan struktur elektron Unsur-unsur diklasifikasikan 4 kelompok : a. Kelompok unsur-unsur inert atau gas mulia Unsur-unsur inert disebut juga sebagai unsur gas mulia (noble gas) terdiri atas 2He, 10Ne, 18Ar, 36Kr, 54Xe, dan 86Rn. Unsur-unsur ini dikenal sebagai unsur yang sangat stabil. Hal ini dikarenakan konfigurasi elektronnya penuh untuk setiap orbital dan dengan elektron valensi ns2 np4 (kecuali He, mempunyai konfigurasi penuh 1s2), karena konfigurasi elektronik unsur-unsur gas mulia dianggap sudah penuh, maka unsurunsur ini dipakai sebagai standar untuk menyatakan penuh atau tidak penuhnya konfigurasi elektron kelompok unsur-unsur lain. b. Kelompok unsur-unsur utama atau representative Unsur-unsur ini ditandai dengan konfigurasi elektronik tidak penuh pada satu kulit terluar, ns1-ns2 np(0-5). Seperti unsur-unsur :30 48 80
Zn = (15Ar) 3d104s2 Cd = (36Kr) 4d105s2 Hg = (54Xe) 4f145d106s2
Unsur-unsur di atas dapat membentuk ion M2+ seperti golongan M2 (Be, Mg, Ca, dll) dengan beberapa kemiripan, namun dengan beberapa perbedaan. Salah satu perbedaannya adalah unsur-unsur Zn dan Cd mempunyai sifat kecenderungan lebih besar untuk membentuk senyawasenyawa kompleks dengan NH3, ion-ion X- dan CN-. Hal ini disebabkan adanya perbedaan konfigurasi elektronik terluar yaitu 18 elektron ion M2+ untuk kelompok ini.8 c. Kelompok unsur-unsur transisi dan transisi dalam (inner transisi) Unsur-unsur keluarga A sering disebut sebagai unsur-unsur8 Kristian H. Sugiyanto, Op. Cit., hlm. 47
7
golongan utama dan unsur-unsur dalam keluarga B sebagai unsur deret transisi dan deret transisi dalam ke-58 unsur dalam dan deret terakhir ini, semuanya adalah logam. Unsur-unsur transisi adalah unsur-unsur keluarga B dalam periode 4,5,6, dan 7. Sedangkan deret lantanida dalam periode ke enam dan deret aktinida dalam periode ke-7 disebut unsur-unsur transisi dalam umumnya unsur-unsur transisi dapat di tempat, liat dan pengantar panas dan listrik yang baik, dan memiliki kilap logam, golongan transisi meliputi keluarga stanium, vanadium, krom, magan, besi, platinum, tembaga, zink, dan skondium.9
B. Hubungan Sistem Periodik dengan Konfigurasi Elektron Penyusunan unsur-unsur dalam sistem periodik panjang dapat dihubungkan dalam konfigurasi elektron dalam orbital atom. Sesuatu hal ini, hukum berkala dapat diungkapkan secara lain yaitu sifat-sifat unsur berhubungan langsung dengan konfigurasi elektron dalam atom unsur tersebut. Unsur-unsur dalam sistem periodik dapat dikelompokkan dalam jalur vertikal yang disebut golongan dan jalur horisontal disebut periode.10 a. Periode Nama periode dari atas ke bawah menunjukkan bilangan kuantum utama terbesar yang dapat dimiliki oleh atom dari unsur-unsur yang terdapat dalam periode tersebut. Ada tujuh periode dalam sistem peiode panjang masing-masing periode tersebut adalah: a) Perioda 1 terdiri atas 2 unsur konfigurasi menyangkut orbital s.9 Keenan, dkk, 1978, Kimia Untuk Universitas, Jilid 2, Jakarta : Erlangga hlm. 150-151 10 Collins, Gem, Kamus Saku Kimia, (jakarta : Erlangga, 2008), Hlm.88&143
diantaranya
8
b) Perioda 2 terdiri atas 8 unsur konfigurasi diantaranya menyangkut orbital s, p. c) Perioda 3 terdiri atas 8 unsur konfigurasi diantaranya menyangkut orbital s, p. d) Perioda 4 terdiri atas 18 unsur konfigurasi diantaranya menyangkut orbital s, p, d. e) Perioda 5 terdiri atas 18 unsur konfigurasi diantaranya menyangkut orbital s, p, d. f) Perioda 6 terdiri atas 32 unsur konfigurasi diantaranya menyangkut orbital s, p, d, f. g) Perioda 7 terdiri atas 8 unsur konfigurasi diantaranya menyangkut orbital s, p, d, f. Dari perioda tersebut, perioda 2 dikenal dengan perioda pendek pertama. Perioda ketiga dikenal sebagai perioda pendek kedua. seterusnya. b. Golongan Unsur-unsur dengan konfigurasi elektron mirip mempunyai sifat yang mirip karena bergantung pada konfigurasi elektron. Elektron yang paling menentukan sifat kimia unsur adalah elektron terluar Mulai perioda keempat dikenal sebagai perioda panjang pertama, kedua dan
9
(elektron valensi). Elektron valensi adalah elektron terluar yang tidak terikat kuat yang mempunyai peranan dalam pembentukan ikatan kimia. Berdasarkan konfigurasi elektron, unsur-unsur dalam sistem periodik dibagi menjadi 4 blok, yaitu : a) Unsur-unsur blok s, konfigurasi elektronnya = ns1-2 b) Unsur-unsur blok p, konfigurasi elektronnya = np1-6 c) Unsur-unsur blok d, konfigurasi elektronnya = (n-1)s2 (n-1)p2 (n1)d1-10ns2 d) Unsur-unsur blok f konfigurasi elektronnya = (n-2)f 1-14 (n-1)s2 (n1)p2 (n-1)d1-10ns2 Oleh karena unsur-unsur golongan gas mulia dahulu diduga tidak dapat bereaksi maka unsur-unsur ini biasanya disebut golongan 0(nol). SPU dibagi atas 8 golongan. Setiap golongan dibagi atas golongan utama(A) dan golongan transisi (B). Penomoran golongan dilakukan berdasarkan elektron valensi yang dimiliki oleh suatu unsur. Jika konfigurasi elektron berakhir di blok s dan p maka pasti menempati golangan A. Jika konfigurasi elektron berakhir di blok d maka menempati golongan B Jika konfigurasi elektron berakhir di blok f maka pasti menempati golongan B (Lantanida n=6 dan Aktinida n=7(golongan radio aktif)) 10
Contoh 11Na = 1s2 2s2 2p6 3s1 Dapat diketahui bahwa elektron terakhir pada n=3 memiliki elektron valensi 1, berarti golongan 1 serta berakhir di subkulit s berarti golongan A. Sehingga letak unsur tersebut dalam TPU adalah golongan 1A periode 3.
IV.KESIMPULAN 1. Sistem periodik unsur dapat diklasifikasikan berdasarkan: Sifat logam dan non logam Hukum triade Hukum Oktaf Hukum Mendeleyev Sistem Periodik Modern Elektron
2. Penyusunan unsur-unsur dalam sistem periodik panjang dapat dihubungkan dalam konfigurasi elektron dalam orbital atom. Sesuatu hal ini, hukum berkala dapat diungkapkan secara lain yaitu sifat-sifat unsur berhubungan langsung dengan konfigurasi elektron dalam atom unsur tersebut. Unsur-unsur dalam sistem periodik dapat dikelompokkan dalam jalur vertikal yang disebut golongan dan jalur horisontal disebut periode. 3. Unsur-unsur dengan konfigurasi elektron yang mirip
mempunyai sifat-sifat kimia yang mirip. Jadi sifat unsur ini ada hubungannya dengan konfigurasi elektron.
11
V.PENUTUP Demikian makalah ini kami buat, dalam pembuatan makalah ini tentunya masih jauh dari kesempurnaan. Oleh karena itu, kritik dan saran yang konstruktif senantiasa kami harapkan demi perbaikan makalah selanjutnya. Semoga makalah ini bermanfaat bagi pembaca.
DAFTAR PUSTAKA Brady, Jaames. Kimia Universitas Asas dan Struktur Jilid 1, Jakarta : Bina rupa Aksara Gem, Collins. 2008. Kamus Saku Kimia. Jakarta : Erlangga H. Sugiyanto, Kristian,2004, Kimia Anorganik. Yogyakarta : JICA
12
Ham, Mulyono. 2007. Kamus Kimia. Jakarta : Bumi Aksara Juari Santosa, Sri, dkk. 2005. Kimia kelas X. Klaten : PT. Intan Pariwara Keenan, dkk, 1978, Kimia Untuk Universitas, Jilid 2, Jakarta : Erlangga Luhbandjono,Gatot, 2004, Kimia Dasar 1, Semarang: UPT UNNES Press Nurchasanah, dkk. 2006. Kimia untuk SMA/MA Kelas X. Semarang : Aneka Ilmu Sukarna, I Made. 2003. Kimia Dasar 1. Yogyakarta : JICA http://eddysyahrizal.blogspot.com/2008/08/sejarah-sistem-periodik unsur.html
KLASIFIKASI UNSUR-UNSUR DALAM TABEL PERIODIK UNSUR Makalah Disusun Guna Memenuhi Tugas Mata Kuliah : Kimia Anorganik 13
Dosen Pengampu : Atik Rahmawati, S.Pd. M.Si
Oleh : Agustina Novitasari Dwi kusuma W Mita Widyawati Ririn Isnawati (083711002)
(083711007) (083711013) (083711033)
FAKULTAS TARBIYAH INSTITUT AGAMA ISLAM NEGERI WALISONGO SEMARANG 2010
14