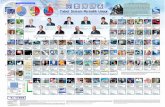
Struktur a tom dan sistem periodik unsur (1)
-
Upload
hasfassong-jin -
Category
Documents
-
view
336 -
download
0
Transcript of Struktur a tom dan sistem periodik unsur (1)

STRUKTUR ATOM DAN SISTEM PERIODIK
UNSUR

A. Perkembangan Teori Atom
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom Thomson
Model Atom Dalton
Model Atom Niels Bohr
Macam-macam model atom

John Dalton pada tahun 1808 mengungkapkan
sebagai berikut.
a. Semua materi mempunyai bagian terkecil yang
disebut atom.
b. Atom tidak dapat dibagi-bagi lagi menjadi bagian
yang lebih kecil.
c. Atom-atom suatu unsur sama dalam segala hal, tetapi
berbeda dengan atom-atom unsur lain.
d. Pada pembentukan senyawa terjadi ikatan antara
penyusun senyawa tersebut.
e. Atom-atom bergabung dengan perbandingan yang
sederhana
Model Atom Dalton
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Kekurangan teori atom Dalton
a. Tidak dapat menjelaskan sifat listrik materi
b. Tidak dapat menjelaskan gaya gabung unsur-
unsur. Misalnya, mengapa dalam
pembentukan air (H2O) satu atom oksigen
mengikat dua atom hidrogen
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Sir J.J. Thomson tahun 1897
memperlihatkan elektron dengan teorinya
sebagai berikut.
a. Atom merupakan bola yang bermuatan
positif, pada tempat-tempat tertentu
ada elektron yang bermuatan negatif.
b. Jumlah muatan positif sama dengan
muatan negatif.
Teori atom Thomson ini dikenal dengan
nama teori atom Roti Kismis.
Model Atom Thomson
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr

Ernest Rutherford tahun 1911 mengungkapkan
model inti untuk suatu atom. Pada model inti
digambarkan atom sebagai ruangan kosong dengan
inti yang padat mengandung muatan positif terletak
di pusat dan elektron beredar mengelilingi inti. Teori
atom Rutherford menerangkan sebagai berikut.
a. Massa atom terpusat pada inti atom
b. Elektron beredar mengelilingi inti pada
orbitnya atau kulitnya.
c. Ukuran atom sekitar 10–8 cm dan inti atom
10–13 cm.
Model Atom
Rutherford
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Kelemahan teori atom Rutherford
a.Tidak dapat menjelaskan bahwa atom
bersifat stabil.
b.Tidak dapat menjelaskan bahwa spektrum
atom hidrogen berupa spektrum garis
(diskrit/diskontinu).
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Niels Bohr tahun 1913 bekerja dengan
Rutherford memodifikasi model atom dengan
menambahkan bahwa elektron mengelilingi inti pada
tingkat-tingkat energi yang berbeda.
Bohr mengungkapkan sebagai berikut.
a. Elektron mengelilingi inti atom pada tingkat
tingkat energi tertentu yang disebut kulit elektron.
b. Elektron dapat pindah dari tingkat energi yang satu
ke yang lain dengan melepaskan atau menyerap
energi.
Model Atom Niels Bohr
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Kelemahan teori atom Bohr:
a. Hanya mampu menjelaskan spektrum atom hidrogen
tetapi tidak mampu menjelaskan spektrum atom yang
lebih kompleks (dengan jumlah elektron yang lebih
banyak).
b. Orbit/kulit elektron mengelilingi inti atom bukan
berbentuk lingkaran melainkan berbentuk elips.
c. Bohr menganggap elektron hanya sebagai partikel
bukan sebagai partikel dan gelombang, sehingga
kedudukan elektron dalam atom merupakan
kebolehjadian.
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Model atom mekanika kuantum didasarkan pada:
1. Elektron bersifat gelombang dan partikel, oleh
Louis de Broglie (1923);
2. Persamaan gelombang elektron dalam atom,
oleh Erwin Schrodinger; (1926)
3. Asas ketidakpastian, oleh Werner Heisenberg
(1927).
Model Atom Mekanika Kuantum
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

Menurut teori atom mekanika kuantum, elektron tidak bergerakpada lintasan tertentu. Berdasarkan hal tersebut maka model atommekanika kuantum adalah sebagai berikut:
a. Atom terdiri atas inti atom yang mengandung proton dan neutron,
dan elektronelektron mengelilingi inti atom berada pada orbital-
orbital tertentu yang membentuk kulit atom, hal ini disebut dengan
konsep orbital.
b. Dengan memadukan asas ketidakpastian dari Werner Heisenberg dan
mekanika gelombang dari Louis de Broglie, Erwin Schrodinger
merumuskan konsep orbital sebagai suatu ruang tempat peluang
elektron dapat ditemukan.
c. Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan
bilangan kuantum.
Model Atom Rutherford
Model Atom Mekanika Kuantum
Model Atom ThomsonModel Atom
Dalton
Model Atom Niels Bohr
1 2

B. Sistem Periodik Unsur
Sistem periodik unsur
Sifat Periodik Unsur
Konfigurasi Elektron
Perkembangan Sistem
Periodik Unsur

Untuk mempermudah mempelajari sifat suatu unsur, para ilmuwan
mengembangkan sistem periodik :
Sistem Periodik Unsur
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur

1. Perkembangan Sistem
Periodik Unsur
1 2
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
34 56789 1011

Sistem periodik unsur-unsur yangdikembangkannya didasarkan pada nomormassa atom. Menurut Dobereiner, jika nomormassa atom unsur A ditambah nomor massaatom unsur B, kemudian dirataratakan makaakan dihasilkan nomor massa atom unsur C.Ketiga unsur ini akan memiliki sifat yang mirip.Kelompok unsur tersebut oleh Dobereinerdinamakan triade.
J. Dobereiner
Sistem periodik
unsurSifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

Jika unsur-unsur dalam satu triadetersebut disusun menurut kenaikan massaatom-atomnya, ternyata massa atom maupunsifat-sifat unsur yang kedua merupakan rata-ratadari massa atom unsur pertama dan ketiga.Penemuan ini memperlihatkan adanyahubungan antara massa atom dengan sifat-sifatunsur.
Kelemahan pengelompokan ini terletak pada kenyataan bahwa jumlah unsur yang memiliki kemiripan sifat tidak hanya 3 buah
Sistem periodik
unsur
Sifat Periodik
Unsur
Konfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

John Newland menemukan hubungan antarasifat unsur dan massa atom menurut pola tertentu.Jika unsur-unsur dideretkan menurut kenaikannomor massa atom maka unsur kedelapan memilikisifat mirip dengan unsur pertama. Pola inidinamakan Hukum Oktaf. Namun, padaperkembangan selanjutnya ditemukan beberapaunsur yang tidak sesuai dengan Hukum Oktaf,misalnya: Cr tidak mirip dengan Al; Mn tidak miripdengan P; Fe tidak mirip dengan S; dan yang lainnya
J. Newlands
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

Tahun 1869, sarjana bangsa Rusia Dmitri IvanovichMendeleyev berdasarkan pengamatannya terhadap 63unsur yang sudah dikenal saat itu, menyimpulkan bahwasifat-sifat unsur fungsi periodik dari massa atomrelatifnya. Hal itu berarti jika unsur-unsur disusunmenurut kenaikan massa atom relatifnya, sifat-sifattertentu akan berulang secara periodik.
Mendeleyev juga membuat suatu daftar periodikunsur. Unsur-unsur yang mempunyai persamaan sifat ditempatkan dalam satu lajur vertikal yang disebutgolongan
Mendeleev
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

Penempatan unsur yang tidak sesuai dengan kenaikan massa atom relatifnya karena mempertahankan kemiripan sifat unsur dalam satu golongannya.
Masih banyak unsur yang belum dikenal pada masa itu sehingga dalam tabel terdapat banyak tempat kosong.
Kelemahan Tabel Periodik Mendeleyev
Sistem periodik
unsur Sifat Periodik
Unsur
Konfigurasi
ElektronPerkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

Tahun 1914, Henry G. J. Moseleymenemukan bahwa urutan unsurdalam tabelperiodik sesuai kenaikan nomor atom. Tabelperiodik modern yang disebut juga tabelperiodik bentuk panjang, disusun menurutkenaikan nomor atom dan kemiripan sifat. Tabelperiodik modern ini dapat dikatakan sebagaipenyempurnaan Tabel Periodik Mendeleyev.
Tabel Periodik Modern
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

a. Golongan
Golongan adalah susunan unsur-unsur
dalam SPU ke arah tegak (vertikal). Secara
garis besar unsur- unsur dalam Tabel Periodik
Modern dibagi dalam 2 golongan, yaitu:
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

1) Golongan Utama (A), meliputi:a) golongan IA disebut golongan alkali;b) golongan IIA disebut golongan alkali tanah;c) golongan IIIA disebut golongan boron/aluminium; d) golongan IVA disebut golongan karbon/silikon;e) golongan VA disebut golongan nitrogen/fosfor;f) golongan VIA disebut golongan oksigen/sulfur;g) golongan VIIA disebut golongan halogen;h) golongan VIIIA/O disebut golongan gas mulia/gas
inert.2) Golongan Transisi (B), meliputi:
Golongan IB sampai dengan VIIIB. Khusus golonganB akan dibahas di kelas XI.
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

b. Periode
Periode adalah susunan unsur-unsur
dalam SPU arah mendatar (horizontal).
Periode dibagi 2 yaitu:
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

1) periode pendek, meliputi:a) periode 1 terdiri atas 2 unsur;b) periode 2 terdiri atas 8 unsur;c) periode 3 terdiri atas 8 unsur.
2) periode panjang, meliputi:a) periode 4 terdiri atas 18 unsu;b) periode 5 terdiri atas 18 unsur;c) periode 6 terdiri atas 32 unsur.d) periode 7 belum lengkap
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 2 34 56789 1011

Konfigurasi elektron merupakan susunanelektronelektron dalam kulit-kulit atau subkulit-subkulit. Pengisian elektron pada tingkatsubkulit akan dibahas di kelas XI. Konfigurasielektron yang akan dibahas pada bab ini hanyauntuk memudahkan dalam penentuan periodedan golongan, khususnya golongan utama (A).
Konfigurasi elektron
1 3
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
2

1. Konfigurasi elektron pada kation dan anion
Kation adalah ion positif, terjadi kalau
atom unsur melepas elektron.
Anion adalah ion negatif, terjadi jika atom
netral menangkap elektron.
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32

2. Elektron valensi
Elektron valensi adalah banyaknya elektron pada
kulit terluar.
3. Penentuan golongan A dan periode
Penentuan golongan A unsur dalam Tabel Periodik
dapat dilakukan dengan cara menetapkan elektron
valensi. Konfigurasi elektron per kulit seperti di atas
hanya berlaku untuk golongan utama (A), sedangkan
golongan transisi (B) menggunakan konfigurasi
elektron per subkulit.
Sistem periodik
unsur
Sifat Periodik
Unsur
Konfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32

Sifat periodik unsur merupakan sifat unsuryang berhubungan dengan letak unsur dalamtabel periodik (periode dan golongan). Sifatperiodik yang akan dibahas di sini meliputi sifatatom yang berhubungan langsung denganstruktur atomnya, mencakup jari-jariatom, energi ionisasi, afinitas elektron, dankeelektronegatifan. Sifat fisis yang meliputikerapatan, titik leleh, titik didih, dan daya hantarlistrik tidak dibahas.
Sifat Periodik Unsur
1 3
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
2 54 76 8

1. Jari-jari atom
Jari-jari atom adalah jarak antara inti atom
dan elektron terluar.
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32 54 76 8

Kecenderungan jari-jari atom:
a. Dalam satu golongan jari-jari atom dari atas ke bawah
makin besar. Karena jumlah kulit dari atas ke bawah
makin banyak meskipun muatan inti bertambah positif,
maka gaya tarik inti terhadap elektron terluar makin
lemah.
b. Dalam satu periode jari-jari atom dari kiri ke kanan
makin kecil. Meskipun jumlah elektron dari kiri ke
kanan bertambah tetapi masih menempati kulit yang
sama. Bertambahnya muatan positif dalam inti
menyebabkan gaya tarik inti terhadap elektron makin
kuat. Akibatnya jari-jari atom makin kecil.
Sistem periodik
unsur
Sifat Periodik
Unsur
Konfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32 54 76 8

2. Energi ionisasi
Energi ionisasi adalah energi minimal yang dibutuhkan untuk
melepaskan 1 elektron terluar dari atom berwujud gas pada keadaan
dasarnya.
Kecenderungan energi ionisasi:
a. Dalam satu golongan energi ionisasi dari atas ke bawah makin kecil,
karena jari-jari atom bertambah besar. Meskipun jumlah muatan
positif dalam inti bertambah tetapi gaya tarik inti terhadap elektron
terluar makin lemah karena jari-jari makin panjang. Akibatnya energi
ionisasi makin berkurang.
b. Dalam satu periode energi ionisasi unsur dari kiri ke kanan makin
besar. Bertambahnya jumlah muatan positif dalam inti dan jumlah
kulit tetap menyebabkan gaya tarik inti makin kuat. Akibatnya energi
ionisasi makin bertambah.
Sistem periodik
unsur
Konfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
Sistem periodik
unsur
Sifat Periodik
Unsur
Konfigurasi
Elektron
1 32 54 76 8

3. Afinitas elektron
Afinitas elektron adalah energi yang terlibat (dilepas ataudiserap) ketika satu elektron diterima oleh atom suatu unsur dalamkeadaan gas.
Afinitas elektron suatu unsur:
a. Dalam satu golongan afinitas elektron unsur dari atas kebawah makin berkurang. Muatan inti bertambah positif, jari-jari atom makin besar, dan gaya tarik inti terhadap elektronyang ditangkap makin lemah. Akibatnya afinitas elektronberkurang.
b. Dalam satu periode afinitas elektron unsur dari kiri kekanan
cenderung bertambah. Muatan inti bertambah positif sedang
jumlah kulit tetap menyebabkan gaya tarik inti terhadap
elektron yang ditangkap makin kuat. Akibatnya afinitas
elektron cenderung bertambah.
Sistem periodik
unsurSifat Periodik
Unsur
Konfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32 54 76 8

4. Keelektronegatifan
Keelektronegatifan adalah kecenderungan/kemampuan atom untuk
menarik elektron dalam suatu ikatan kimia. Semakin besar keelektronegatifan
suatu atom berarti dalam ikatan kimia atom tersebut cenderung menarik
elektron dari atom yang lain.
Keelektronegatifan suatu unsur:
a. Dalam satu golongan keelektronegatifan unsur dari atas ke bawah makin
berkurang. Jumlah muatan inti bertambah positif jumlah kulit bertambah
maka kemampuan inti untuk menarik elektron menjadi lemah. Akibatnya
keelektronegatifan unsur makin lemah.
b. Dalam satu periode keelektronegatifan unsur dari kiri ke kanan cenderung
naik. Muatan inti bertambah positif jumlah kulit tetap, menyebabkan gaya
tarik inti terhadap elektron makin kuat. Akibatnya kemampuan atom untuk
menarik elektron makin besar.
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32 54 76 8

5. Sifat logam
Unsur-unsur dalam sistem periodik dibagi menjadi unsur logam, semilogam (metalloid), dan nonlogam. Unsur logam mempunyai energi ionisasi kecil sehingga mudah melepas elektron membentuk ion positif. Unsur nonlogam mempunyai afinitas elektron besar sehingga mudah menarik elektron membentuk ion negatif.
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32 54 76 8

Sifat logam unsur:
a. Dalam satu golongan sifat logam unsur bertambah dari atas ke bawah. Dari
atas ke bawah energi ionisasi unsur berkurang sehingga makin mudah
melepas elektron, sifat logam bertambah. Demikian juga nilai afinitas
elektron makin berkurang sehingga makin sulit bagi unsur untuk menangkap
elektron. Sifat nonlogam berkurang.
b. Dalam satu periode sifat logam berkurang dari kiri ke kanan. Energi ionisasi
unsur bertambah dari kiri ke kanan, sehingga makin sulit bagi unsur untuk
melepas elektron. Berarti sifat logam makin berkurang. Nilai afinitas
elektron bertambah dari kiri ke kanan, sehingga makin mudah bagi unsur
untuk menarik elektron. Akibatnya sifat nonlogam makin berkurang.
Kecenderungan ini tidak berlaku bagi unsur-unsur transisi.
Sistem periodik
unsur
Sifat Periodik
UnsurKonfigurasi
Elektron
Perkembangan
Sistem Periodik
Unsur
1 32 54 76 8