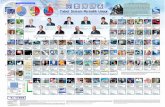
Sistem periodik unsur (sederhana)
-
Upload
the-national-science-and-social-olympiads-2013-smp-se-derajat-sma-darul-ulum-2-bppt-cis-id-113 -
Category
Education
-
view
163 -
download
9
description
Transcript of Sistem periodik unsur (sederhana)

SMA DARUL ‘ULUM 2 UNGGULAN BPP-T CAMBRIDGE INTERNATIONAL SCOOL (CIS)
ID 113


Sistem periodik modern disusun berdasarkan kenaikan nomor atom dan kemiripan sifat.
a. Periode Periode adalah lajur-lajur horosontal dalam sistem periodik. b. Golongan kolom-kolom vertikal dalam unsur periodik
c. Unsur transisi dan transisi dalam 1. unsur transisi adalah unsur-unsur yang terletak pada golongan B. 2. unsur transisi dalam adalah dua baris unsur yang ditempatkan dibagian bawah tabel periodik.
d. Hubungan konfigurasi elektron dengan sistem periodik Sistem periodik disusun berdasarkan pengamatan terhadap sifat-sifat unsur. Selama puluhan tahun, keperiodiakn sifat-sifat unsur merupakan suatu hal yang belum dapat dijelaskan.

Upaya pengelompokan unsur-unsur sudah dilakukan sejak lama, yaitu sejak unsur yang dikenal sudah cukup banyak .pengelompokan yang baik akn membantu kita dalam mempelajari sifat-sifat unsur tersebu. 1. Pengelompokan atas logam dan nonlogam penggolongan unsur yang pertama dilakukan oleh lavoiser . Penggolongan yang dilakukan lavoiser dapa disimpulkan bahwa pengelomokan atas logam dan logam masih sangat sederhana, sebab antara sesama logam pun masih terdapat banyak perbedaan.2. Triad Dobereiner Pada tahun 1829,J.W.Dobereiner, seorang profesor dari jerman berpendapat bahwa unsur-unsur dapat dikelompokkan kedalam kelompok-kelompok tiga unsur yang disebut triad. sayang, dobeiner tidak berhasil menunjukkan cukup banyak tiad sehigga aturan tersebut bermanfaat.3. Hukum Okaf Newland Pada tahun 1864, seorang ahli kimia dari inggris bernama A.R.Newland mengemukakan penemuannya yang disebut hukum oktaf. Newland menyusun berdasarkan kenaikan atom relatifnya. Tenyata unsuryang berselisih satu menunjukkan kemiripan sifat.4. Sistem Periodik Mendeleev pada tahun 1869, seorang sarjana asal rusia bernama D.I.mendeleev, berdasarkan pengamatan terhadap 63 unsur yang sudah dikenal ketika itu. Dapat disimpulkan bahwa sifat-sifat unsur merupakan fungsi periodik dari masa atom relatifnya.5. Sistem Periodik Modern Dari H.G.Moseley Pada awal abad 20, setelah penemuan nomor atom, H. Moseley menunjukkan bahwa urutan-urutan unsur dalam sistem periodik Mendeleev sesuai dengan kenaikan nomor atomnya.

Sifat periodik adalah sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom, yaitu dari kiri ke kanan dalam satu periode, atau dari atas ke bawah dalam satu golongan. 1. Jari-jari atom Jari-jari atom adalah jarak dari inti hingga kulit elektron terluar
2. Jari-jari ion Jari-jari atom dan jari-jari ion. Ion yang lebih kecil dari pada jari-jari atom netralnya, sebelumnya jati-jari ion negatif lebih besar dari pada jari-jari atom netralya .
3. Energi ionisai Energi ionisai bertambah dari kri ke kanan, dan berkurang dari atas ke bawah.
4. Afinitas Elektron Afinitas Elektron adalah Energi yang menyertai penambahan 1 elektron dalam satu atom netral dalam wujud gas membentuk ion bermuatan -1.
5. Keelektronegatifan Kecenderungan unsurmenarik elektron, tetapi tidak dilakukan dengan pembentukan ion positif atau ion negatif.
6. Sifat Logam Dan Nonlogam Kencenderungan atom melepas elektron membentuk ion positif. Jadi, sifat logam bergantung pada energi ionisasi.
7. Kereaktifan Kereakifan suatu unsr bergantung pada kecenderungan melepas atau menarik elektron. Jadi unsur logam yag paling reaktif adalah golongan IA (Logam Alkali), sedangkan nonlogam yang paling reaktif adalah golongan VIIA (Halogen).

Pengelompokan unsur dalam satu golongandapat dibanding kan dengan pengelompokan makhluk hidup.1. Golongan VIIA (Gas Mulia ) Unsur-unsur golongan VIIIA, yaitu helium, neon, argon, kripton, xenon, dan radon disebut gas mulia karena semuanya berupa gas yang sangat stabil, sangat sukar sekali bereaksi dengan unsur lain. 2.Golongan VIIA (Halogen) Unsur-unsur golongan VIIA merupakan kelompok unsur nonlogam yang sangat relatif. 3. Golongan IA (Logam Alkali) Unsur-unsur golongan IA, kecuali hidrogen, diseut logam alkali karena unsur tersebut membentuk basa yang larut dalam air.4. Golongan IIA (Logam Alkali Tanah) Unsur-unsur Golongan IIA disebut logam alkali anah karena dapat membentuk basa, tetapi senyawa-seyawanya kurang larut dalam air.5. Unsur-unsur Transisi Unsur-unsur transisi adalah unsur-unsur yang terdapat dibagian tengah sistem periodik, yaitu unsur-unsur gologan tambahan (Golongan B)