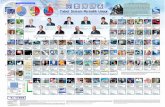
Sistem Periodik Unsur
-
Upload
fandy-akbar -
Category
Documents
-
view
813 -
download
231
description
Transcript of Sistem Periodik Unsur

WELCOME TO

SISTEM PERIODIK UNSURBy
RAHMATUL HUDA

Pengelompokan Berdasarkan Sifat Logam dan Non Logam Pengelompokan Berdasarkan Hukum Triad Dobereiner Pengelompokan Berdasarkan Hukum Oktaf Newland Sistem Periodik Mendeleev Sistem Periodik Modern ( Sistem Periodik Bentuk Panjang)
PERKEMBANGAN SISTEM PERIODIK

Pengelompokan Berdasarkan Sifat Logam dan Non Logam
Penggolongan unsur yang pertama dilakukan oleh Lavoisier kedalam 2 kelompok unsur yaitu logam dan non logam
berdasarkan perbedaan sifat - sifatnya :
NO LOGAM NON LOGAM
1. Penghatar listrik & panas yang baik Penghantar listrik yang tidak baik
2. Mengkilap jika digosok Tidak mengkilap walau digosok, kecuali intan
3. Dapat ditempa dan direnggangkan Tidak dapat ditempa, rapuh dan sukar direnggangkan
4. Umumnya padat pada suhu kamar, kecuali raksa
Dapat berupa padat, cair dan gas pada suhu kamar (25oC)
5. Contoh : emas, perak, timah, tembaga, natrium, kalium dan magnesium
Contoh : hidrogen, oksigen, nitrogen, karbon, belerang, fosfor, klorin dan iodin

Pengelompokan Berdasarkan Hukum Triad Dobereiner
Johan Wolfgang Dobereiner (1829) merupakan orang yang pertama kali mengelompokkan unsur-unsur berdasarkan sifat khas atom dan massa atomnya
Dobereiner menyatakan bahwa pada unsur-unsur yang memiliki sifat yang mirip,massa atom unsur kedua merupakan setengah dari jumlah massa atom unsur pertama dan ketiga

Dobereiner membagi unsur-unsur yang sifatnya mirip tersebut kedalam kelompok-kelompok yang terdiri dari tiga unsur yang disebut Triade.
Pengelompokan Berdasarkan Hukum Triad Dobereiner

Look at this !
Li
7
Na
23
K
39
Ca
40
Sr
88,5
Ba
137
Cl
35
Br
81
I
127

Pengelompokan Berdasarkan Hukum Oktaf Newland
Pada tahun 1864, ahli kimia Inggris John Alexander Reina Newlands mengemukakan bahwa ketika unsur-unsur disusun berdasarkan kenaikan massa atomnya, maka setiap pengulangan delapan unsur akan terdapat kemiripan sifat-sifat. Hal ini berarti bahwa unsur pertama mirip dengan unsur kedelapan, unsur kedua mirip dengan unsur kesembilan dan seterusnya
Newlands menyebut pengulangan ini sebagai hukum Oktaf.

Look at the Newland’s Arranged Elements in Octaves!!

Sistem Periodik Mendeleev
Pada tahun 1869, ahli kimia Rusia Dmitri Ivanovich mendeleev dan ahli kimia Jerman Julius Lothar Meyer secara terpisah mengusulkan pengelompokkan unsur-unsur yang lebih luas yaitu ketika unsur-unsur disusun berdasarkan kenaikan massa atomnya, sifat-sifatnya akan terulang secara periodik.
Hukum ini dikenal dengan hukum Periodik

Dua kelebihan Tabel sistem periodik unsur Mendeleev dibanding tabel periodik Newlands
– Pengelompokan unsur-unsurnya memiliki massa atom dan sifat-sifat yang lebih akurat.
– Pengelompokan unsur-unsurnya memungkinkan untuk memprediksi sifat-sifat beberapa unsur yang belum ditemukan hingga saat ini.

Sistem Periodik Modern ( Sistem Periodik Bentuk Panjang)
Pada tahun 1913, seorang ahli fisika Inggris Henry Gwyn-Jeffreys Moseley menemukan bahwa nomor atom meningkat seiring dengan meningkatnya massa atom.
Atas penemuan tersebut maka Henry Moseley menyusun tabel periodik berdasarkan kenaikan nomor atom dan sifat atom berdasarkan kenyataan bahwa unsur-unsur yang sama (dengan sifat yang sama pula) dapat memilki massa atom berbeda atau isotop.

Tabel periodik unsur Henry Moseley disusun dalam bentuk panjang dan disebut sebagai Sistem Periodik Modern yang kita kenal hingga sekarang.

GOLONGAN DAN
PERIODE

GOLONGAN
Dalam Tabel Sistem Periodik Unsur Modern, golongan suatu unsur disusun berdasarkan pada jumlah elektron valensi dan sifat kimia yang sama dalam satu golongan yang ditempatkan dalam lajur dari arah atas ke bawah (vertikal)/kolom

Pada Tabel Sistem Periodik Unsur Modern, penamaan golongan dibagi menjadi dua cara
Sistem 8 golongan berdasarkan aturan Amerika
Sistem 18 golongan berdasarkan aturan IUPAC

SISTEM 8 GOLONGAN
Yaitu golongan A (golongan utama) dan golongan B (golongan transisi), di mana nomor golongan ditulis dengan angka Romawi.
Golongan A terdiri atas golongan IA, IIA, IIIA, IVA, VA, VIA, VIIA dan VIIIA

Golongan IIIA disebut golongan boronGolongan IV A disebut golongan karbonGolongan V A disebut golongan nitrogenGolongan VI A disebut golongan oksigen
Beberapa golongan diberi nama khusus, misalnya :• Golongan IA disebut dengan golongan alkali
• Golongan IIA disebut dengan golongan alkali tanah• Golongan VIA disebut dengan golongan khalkogen
• Golongan VIIA disebut dengan golongan halogen• Golongan VIIIA disebut dengan golongan gas mulia
Golongan IIIA, IVA, VA, dan VIA disebut sesuai dengan unsur yang terdapat dalam golongan tersebut.
GOLONGAN UTAMA

GOLONGAN B (TRANSISI)
Golongan transisi dapat dibagi 2:
Golongan transisi luar I B – VIII B Golongan transisi dalam terdiri dari
lantanida dan aktinida
Golongan transisi dapat dibagi 2:
Golongan transisi luar I B – VIII B Golongan transisi dalam terdiri dari
lantanida dan aktinida

SISTEM 18 GOLONGAN
berdasarkan aturan IUPAC
Di mana golongan dibagi dalam 18 golongan yaitu golongan 1 – 18, dimulai dari kolom paling kiri
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
IA
IIA
IIIB
IVB
VB
VIB
VIIB
VIIIB
VIIIB
VIIIB
IB
IIB
IIIA
IVA
VA
VIA
VIIA
VIIIA

PERIODE Periode/perioda
merupakan lajur mendatar dari kiri ke kanan/horizontal dalam sistem periodik bentuk panjang yang jumlahnya ada 7 periode
Dituliskan dengan huruf latin serta menunjukkan banyaknya jumlah kulit yang ditempati oleh elektron dalam masing-masing unsur
Perioda Nama Perioda Jumlah Unsur
1 Perioda sangat pendek 2
2 Perioda pendek 8
3 Perioda pendek 8
4 Periode panjang 18
5 Perioda panjang 18
6 Perioda sangat panjang 32
7 Perioda sangat panjang 29