Perkembangan Model Atom Dalton Thomson Rutherford Niels Bohr
Perkembangan Model Atom
-
Upload
daniel-moses -
Category
Education
-
view
69 -
download
1
Transcript of Perkembangan Model Atom

Kelompok 3Perkembangan
Model AtomAhmad Naufal G, Daniel Moses, Dinny Tania A, Ester Oktaviani

PERKEMBANGAN MODEL ATOM
Atom a = tidak tomos = dibagi Jadi, atom adalah bagian terkecil dari suatu unsur
yang tidak dapat dibagi-bagi lagi
Atom dilambangkan dengan Z x A dimana Z adalah jumlah proton + elektron A adalah jumlah proton + neutron

1. TEORI ATOM JOHN DALTON
1. Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
2. Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda
3. Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
4. Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.

• Hipotesa Dalton digambarkan dengan model atom sebagai bola pejal seperti pada tolak peluru.

• KELEMAHAN :1. Atom bukanlah sesuatu yang tak terbagi,
melainkan terdiri dari berbagai partikel subatom.2. Meski mempunyai sifat-sifat yang sama, atom-
atom dari unsur yang sama dapat mempunyai massa yang berbeda.
3. Melalui reaksi nuklir, atom dari suatu unsur dapat diubah menjadi atom unsur lain.
4. Beberapa unsur tidak terdiri atas atom-atom melainkan molekul-molekul. Molekul unsur terbentuk dari atom-atom sejenis dengan jumlah tertentu
• KELEBIHAN : 1. Dapat menerangkan Hukum Kekekalan Massa dan
Hukum Kekekalan Tetap

2. TEORI ATOM J. J. THOMSON• Teori Atom Thomson yang menyatakan bahwa:
“Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”• Model atom ini dapat digambarkan sebagai jambu biji
yang sudah dikelupas kulitnya. biji jambu menggambarkan elektron yang tersebar merata dalam bola daging jambu yang pejal, yang pada model atom Thomson dianalogikan sebagai bola positif yang pejal.

• KELEBIHAN :1. Membuktikan adanya partikel lain
yang bermuatan negatif dalam atom. Berarti atom bukan merupakan bagian terkecil dari suatu unsur.
• KELEMAHAN :1. Tidak dapat menjelaskan susunan
muatan positif dan negatif dalam bola atom tersebut

3. TEORI ATOM RUTHERFORD
• Rutherford dalam teori nya menyatakan bahwa :
• ”atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif.”

• Kelebihan : model atom Rutherford mampu menjelaskan susunan muatan positif dan negatif dalam atom.
• Kelemahan : ketidakmampuan menjelaskan mengapa elektron tidak jatuh ke inti atom akibat gaya tarik elektrostatis inti terhadap elektron. Berdasarkan asas fisika klasik, elektron sebagai partikel bermuatan bila mengitari inti yang bermuatan berlawanan, lintasannya akan berbentuk spiral sehingga akhirnya jatuh ke inti.

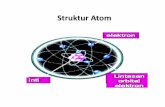
4. TEORI ATOM BOHR• Teori Niels Bohr menyatakan :• “ elektron-elektron mengelilingi inti pada
lintasan-lintasan tertentu yang disebut kulit atom. “
• Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.

• Niels Bohr menerangkan model atomnya berdasarkan teori kuantum untuk menjelaskan spektrum gas hidrogen. Menurut Niels Bohr, spektrum garis menunjunjukkan bahwa elektron hanya menempati tingkat-tingkat energi tertentu.
• Model atom Hidrogen menurut Niels Bohr adalah sebagai berikut :1. Atom terdiri atas inti yang bermuatan positif dan di
sekitarnya beredar elektron-elektron yang bermuatan negatif.
2. Dalam atom, elektron beredar mengelilingi inti atom pada lintasan tertentu yang dikenal sebagai keadaan gerakan stasioner dengan tingkat energi yang dinyatakan dengan n ( n = 1,2,3,. . . .)
3. Sepanjang elektron berada dalam lintasan stasioner energi akan konstan, sehingga tidak ada energi yang diserap atau dipancarkan.
4. Elektron hanya dapat berpindah dari lintasan yang lebih rendah ke lintasan yang lebih tinggi jika menyerap energi. Dan sebaliknya elektron berpindah dari lintasan yang tinggi ke lintasan rendah terjadi pembebasan energy.

• Kelebihan : mampu menjelaskan mengapa elektron tidak jatuh keinti atom akibat gaya tarik elektrostatis inti terhadap elektron.
• Kekurangan : model atom Bohr hanya dapat menerangkan spektrum dari atom atau ion yang mengandung satu elektron namun tidak sesuai dengan spektrum atau ion berelektron bermuatan banyak.

5. TEORI ATOM MODERN• Dikemukakan oleh Max Pranck• Model atom modern didasarkan pada teori
mekanika kuantum (1927), yaitu sebagai berikut:
a. Atom terdiri dari inti atom yang mengandung proton dan neutron, dan elektron yang mengitari inti atom pada oarbital-orbitalnya.b. Dengan memadukan azas ketidakpastian Heisenberg dan mekanika gelombang dari Broglie maka Schodinger merumuskan konsep "Orbital adalah suatu ruangan dimana peluang elektron ditemukan".c. Kedudukan elektron pada orbital-orbital dinyatakan dengan bilangan kuantum.

• Model atom dengan orbital lintasan elektron ini disebut model atom modern atau model atom mekanika kuantum yang berlaku sampai saat ini, seperti terlihat pada gambar berikut ini.