Model atom dan teori atom | KIMIA
-
Upload
kevin-agatha -
Category
Education
-
view
209 -
download
18
Transcript of Model atom dan teori atom | KIMIA


Menurut Democritus, atom
adalah sebuah benda
yang tidak bisa dibagi-bagi
lagi. Belahan sebuah
benda yang tidak bisa
dibagi lagi tersebut
disebut dengan istilah
atomos (A=tidak,
TOMos=dipotong-potong),
yang artinya tidak terlihat.
GAMBAR ATOM

Berdasarkan teori Democritus,
atom yang menyusun setiap
zat berbeda satu sama lain.
Bagan penyusun unsur
menurut Empedokles.
Namun, teori Democritus
ditolak oleh Empedokles.
Menurutnya, unsur
tersusun atas api, air,
tanah, dan udara.

Dalton berpendapat sebagai berikut:
1. Atom adalah bagian terkecil dari suatu zat.
2. Atom berbentuk bola sederhana yang
sangat kecil, tidak dapat dibelah, diciptakan,
maupun dimusnahkan.
3. Unsur yang sama mengandung atom-atom
yang sama.
4. Atom-atom dari unsur yang berbeda dapat
bergabung menyusun senyawa dengan
perbandingan tetap.
5. Atom-atom bergabung membentuk
senyawa dengan angka dan perbandingan
yang bulat dan sederhana.

Thomson melakukan percobaan
menggunakan tabung kaca
dengan udara dalam tabung
bertekanan sangat rendah.
Kedua ujung tabung tersebut
dipasang pelat logam yang
berfungsi sebagai elektrode.
Elektrode terdiri atas anoda dan
katoda. Tabung tersebut
dinamakan tabung sinar katoda.

Sinar katoda yang ditemukan Thomson
disebut elektron. Menurutnya, suatu
atom berbentuk bola yang bermuatan
positif dan elektron tersebar dalam bola
tersbut.
Tabung Sinar Katoda

Berpakah massa yang dimilikielektron? Robert Milikan
menemukan jawabannya.
Milikan melakukan
percobaan tetes minyak
yang menemukan bahwa
muatan tetes minyak (q)
selalu berubah kelipatan
bilangan bulat dari -1,6x10-19
C.
Jadi, massa elektron hasil
perhitungan adalah 9,10 x
10-28 gram atau 0,00054859
sma.

Rutherford memodifikasi tabung sinar katoda
dengan cara mengganti gas helium dengan gas
hidrogen. Sinar yang dihasilkan selalu bermuatan
positif yang besarnya merupakan kelipatan dari
+1,6x10-19 C. Rutherford menyimpulkan bahwa
muatan partikel positif sama dengan muatan ion
positif dari hidrogen, yaitu sebesar +1,6x10-19 C.

Berapakah massa partikel positif? Data dari percobaan menunjukkan bahwa angka
banding ion positif = 9,57 x 104 C g-1.
Dengan demikian, dapat disimpulkan bahwa ion
positif hidrogen merupakan partikel dasar
bermuatan positif dan dikenal dengan sbutan
proton.
Massa proton:
1,0078 sma

Sinar yang bermuatan positif menumbuk
partikel pejal (logam emas) yang juga
bermuatan positif. Partikel yang
muatannya sama akan tolak-menolak.
Partikel pejal tersebut dinamakan inti
atom.

Rutherford membuat kesimpulan
sebagai berikut.
1. Atom terdiri atas inti atom yang
bermuatan positif dan elektron-
elektron bermuatan negatif yang
beredar mengelilingi inti.
2. Atom bersifat netral sehingga jumlah
proton dalam inti sama dengan
jumlah elektron yang mengelilingin
inti.

Chadwick mengamati bahwa berilium yang
ditembak dengan partikel memancarkan suatu
partikel yang mempunyai daya tembus yang
sangat tinggi dan tidak dipengaruhi oleh
medan magnet maupun medan listrik. Partikel
itu diberi nama neutron. Neutron tidak
bermuatan dan dari hasil percobaan diketahui
bahwa neutron memiliki massa yang hampir
sama dengan massa atom, yaitu 1,675 x 10-24
g atau 1,0087 sma.

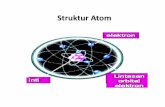
1. Elektron mengelilingi inti atom pada
tingkat-tingkat energi (kulit) tertentu.
2. Elektron dapat berpindah dari tingkat
energi satu ke tingkat energi lain.
a. Apabila dari tingkat energi rendah ketinggi, disebut eksitasi, hal itu dicapaidengan cara menyerap energi.
b. Apabila dari tingkat energi tinggi kerendah, disebut deksitasi, itu dicapaidengan cara pemancaran energi.

Kelemahan teori atom Bohr:
1. Teori Bohr tidak dapat
menerangkan spektrum atom yang
lebih rumit (nomor atom lebih atom
1), dan
2. Teori Bohr tidap dapat
menjelaskan adanya modifikasi
pengaruh medan magnet dalam
atom hidrogen.

Edwin Schrodinger dan
Werner Heisenberg
melahirkan teori atom modern
yang dikenal dengan Teori
Mekanika Kuantum. Teori
mekanika kuantum
digunakan untuk menjelaskan
sifat atom dan molekul.

Berdasarkan teori atom mekanika
kuantum, keberadaan elektron
dalam lintasan tidak dapat
ditentukan dengan pasti, yang
dapat diketahui hanya daerah
kebolehjadian ditemukan elektron.
Teori tersebut dikenal
dengan “Prinsip
Ketidakpastian
Heisenberg.”

Menurut Heisenberg, elektron yang
bergerak menimbulkan perubahan dalam
posisi dan momentum setiap saat
sehingga posisi dan kecepatan elektron
yang sedang bergerak secara bersama-
sama tidak dapat diukur dan dilakukan
secara tepat.