Bab 2 Sistem Periodik Modern
-
Upload
muhammad-mukhtas -
Category
Documents
-
view
12 -
download
0
Transcript of Bab 2 Sistem Periodik Modern
A
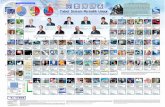
Sistem Periodik Modern dibagi menjadi suatu baris-baris (dari kiri ke kanan) yang disebut periode dan kolom-kolom (dari atas ke bawah) disebut golongan. Unsur yang jumlah kulitnya sama, terletak pada periode yang sama.
Nomor periode = jumlah kulit
Unsur-unsur yang struktur elektron terluarnya (elektron valensi) sama terletak pada golongan yang sama. Karena sifat kimia ditentukan oleh struktur elektron valensi maka unsur-unsur segolongan mempunyai sifat kimia yang mirip.
Untuk menentukan golongan, unsur-unsur dibagi menjadi tiga kelompok, yaitu unsur utama (A), unsur transisi (B) dan unsur transisi dalam.
GOLONGAN UNSUR
Unsur Transisi (B):
Unsur-unsur yang pengisian elektronnya berakhir pada subkulit d (blok d)
Unsur Utama (A):
Unsur-unsur yang pengisian elektonnya berakhir pada subkulit s (blok s) atau subkulit p (blok p).
Unsur Transisi Dalam:
Unsur-unsur yang pengisian elektronnya berakhir pada subkulit f (blok f)
Struktur elektron valensi:
ns np
n = periode
s+p = nomor golongan
Struktur elektron valensi
(n-2)f(n-1)d1ns2
Lantanida : berakhir di 4f
Aktinida : berakhir di 5f
Struktur elektron valensi:
ns (n-1)d
n = periode
s+d = nomor golongan
Perkecualian:
jika s+d=9 golongan VIIIB
jika s+d=10 golongan VIIIB
jika s+d=11 golongan IB
jika s+d=12 golongan IIB
Nomor GolonganNama GolonganElektron
valensiIAAlkalis1IIAAlkali Tanahs2IIIAGol. Borons2 p1IVAGol. Karbons2 p2VAGol. Nitrogens2 p3VIAGol. Oksigens2 p4VIIAHalogens2 p5VIIIAGas Mulias2 p6Perkecualian:
1H : 1s1 : hidrogen tidak mempunyai golongan
2He: 1s2 : helium termasuk gas mulia (VIIIA)
PUSAT KONSULTASI STUDI, BIMBINGAN BELAJAR & PRIVAT LES ____________________________________________________5
_1071364666.unknown