Silabus Kimia XI SMK KESEHATAN
-
Upload
ersa-nurul-yarizsa -
Category
Documents
-
view
670 -
download
141
description
Transcript of Silabus Kimia XI SMK KESEHATAN
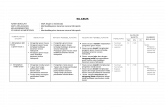
SILABUSNAMA SEKOLAH: SMK KESEHATAN SABILURRAHIMMATA PELAJARAN: KimiaKELAS/SEMESTER: XI / 1STANDAR KOMPETENSI : Memahami konsep larutan elektrolit dan elektrokimiaKODE KOMPETENSI: 1ALOKASI WAKTU: 12 x 45 menit
KOMPETENSI DASARMATERI PEMBELAJARANKEGIATAN PEMBELAJARANINDIKATORPENILAIANALOKASI WAKTUSUMBER BELAJAR
TMPSPI
1. 1 Membedakan larutan elektrolit dan nonelektrolit. Kelarutan Konsentrasi larutan Larutan elektrolit dan non-elektrolit Berdiskusi tentang kelarutan, dan faktor-faktor yang mempengaruhi kelarutan. Melakukan percobaan untuk untuk mengetahui kelarutan suatu zat. Melakukan berbagai perhitungan untuk menyatakan konseptrasi (persen massa (kadar), bagian per juta (bpj), kemolaran, kemolalan (m) dan fraksi mol (X)). Melakukan prosedur membuat larutan dengan kemolaran tertentu. Melakukan percobaan untuk menunjukan hantaran listrik melalui larutan (elektrolit dan non-elektrolit). Berdiskusi tentang teori Ion Savante Arrhenius. Berdiskusi tentang senyawa ion dan senyawa kovalen polar. Berdiskusi tentang elektrolit kuat dan elektrolit lemah. Faktor-faktor yang mempengaruhi kelarutan dan prosesnya disebutkan. Percobaan dilakukan untuk mengetahui kelarutan suatu zat. Persen massa (kadar), persen volume, bagian per juta (bpj), kemolaran, dan pengenceran dihitung secara kuantitatif. Pelarutan zat padat dan pengenceran larutan pekat dilakukan sesuai prosedur. Kemolalan dan fraksi mol (X) dihitung secara kuantitatif. Mampu mengetahui larutan yang bersifat elektrolit dan non-elektrolit pada suatu larutan yang dibuktikan melalui percobaan. Mampu membedakan senyawa ion dengan senyawa kovalen polar. Mampu membedakan larutan yang memiliki elektrolit kuat dan elektrolit lemah, serta zat-zat yang termasuk diantaranya. Tes lisan Tes tertulis Laporan praktikum Tugas kelompok66- Buku pelajaran LKS Alat dan bahan praktikum (gelas kimia, pipet ukur, dll).
1. 2 Mengidentifikasi dan mengklasifikasi berbagai larutan Asam dan basa Konsep pH, pOH, dan pKw Melakukan percobaan untuk menunjukan sifat asam, basa dan netral. Mendiskusikan teori asam basa Arrhenius. Melakukan analisis persamaan reaksi penetralan asam basa (reaksi penggaraman), dan reaksi asam dengan logam dan oksida logam. Melakukan perhitungan untuk menentukan nilai pH suatu larutan. Melakukan perhitungan untuk mengetahui hubungan tingkat keasaman dengan pH, nilai pOH, serta nilai pH air. Perbedaan sifat asam, basa dan netral suatu larutan dibuktikan melalui percobaan. Memahami persamaan reaksi penetralan asam basa (reaksi penggaraman), dan reaksi asam dengan logam dan oksida logam. Nilai pH diketahui melalui perhitungan secara kuantitatif. Hubungan tingkat keasaman dengan pH, nilai pOH, serta nilai pH air diketahui melalui perhitungan secara kuantitatif. Tes lisan Tes tertulis Laporan praktikum Tugas individu Buku pelajaran LKS Alat dan bahan praktikum
NAMA SEKOLAH: SMK KESEHATAN SABILURRAHIMMATA PELAJARAN: KimiaKELAS/SEMESTER: XI / 2STANDAR KOMPETENSI : Memahami konsep kesetimbangan reaksiKODE KOMPETENSI: 2ALOKASI WAKTU: 16 x 45 menit
KOMPETENSI DASARMATERI PEMBELAJARANKEGIATAN PEMBELAJARANINDIKATORPENILAIANALOKASI WAKTUSUMBER BELAJAR
TMPSPI
2. 1 Menguasai reaksi kesetimbangan Keadaan setimbang Tetapan seimbang Berdikusi tentang reaksi reversible dan irreversible, keadaan setibang, serta kesetimbangan homogen dan heterogen. Berdiskusi tentang hukum kesetimbangan. Melakukan perhitungan untuk mengetahui nilai tetapan kesetimbangan (K). Berdiskusi tentang tetapan kesetimbangan tekanan (Kp), dan tetapan kesetimbangan untuk kesetimbangan heterogen. Berdiskusi tentang hubungan Kp dengan Kc, serta matriks kesetimbangan. Memahami persamaan reaksi kimia yang bersifat reversible dan irreversible, serta menuliskannya dengan benar. Keadaan setimbang persamaan reaksi kimia dianalisis. Mampu membedakan kesetimbangan homogen dan heterogen. Hukum kesetimbangan dibuktikan melalui perhitungan untuk mencari nilai tetapan kesetimbangan (K). Tetapan kesetimbangan tekanan (Kp) dihitung secara kuantitatif. Hubungan Kp dengan Kc dipahami melalui perhitungan kuantitatif. Matriks kesetimbangan digunakan dalam menentukan komposisi kesetimbangan. Tes lisan Tes tertulis Tugas individu88- Buku pelajaran LKS Internet
2. 2 Menguasai faktor-faktor yang mempengaruhi pergeseran kesetimbangan Pergeseran kesetimbangan Melakukan percobaan terhadap pengaruh penerapan azas Le Chatelier pada kesetimbangan. Perubahan konsentrasi salah satu komponen dipraktikan untuk mengetahui pengaruhnya terhadap jumlah kesetimbangan. Pengaruh tekanan, suhu, dan katalis terhadap kesetimbangan dianalisis. Tes lisan Tes tertulis Tugas individu/kelompok Laporan praktikum Buku pelajaran LKS Internet Alat dan bahan praktikum
2. 3 Menentukan hubungan kuantitatif antara pereaksi dan hasil reaksi dari suatu kesetimbangan Kesetimbangan dalam industri Berdiskusi tentang pembuatan amonia menurut proses Haber-Bosch. Melakukan percobaan pembuatan asam sulfat melalui proses kontak. Pembuatan amonia dari nitrogen dan hidrogen menurut proses Haber-Bosch dipahami dan dan dianalisis. Pembuatan asam sulfat ditunjukan melalui proses kontak. Tes lisan Tes tertulis Laporan praktikum. Buku pelajaran LKS Internet Alat dan bahan praktikum
NAMA SEKOLAH: SMK KESEHATAN SABILURRAHIMMATA PELAJARAN: KimiaKELAS/SEMESTER: XI / 1STANDAR KOMPETENSI : Menentukan perubahan entalpi berdasarkan konsep termokimiaKODE KOMPETENSI: 3ALOKASI WAKTU: 12 x 45 menit
KOMPETENSI DASARMATERI PEMBELAJARANKEGIATAN PEMBELAJARANINDIKATORPENILAIANALOKASI WAKTUSUMBER BELAJAR
TMPSPI
3. 1 Menjelaskan entalpi dan perubahan entalpi Entalpi dan perubahannya Berdiskusi tentang entalpi (H) dan perubahan entalpi (H). Melakukan percobaan untuk menunjukan reaksi endoterm dan reaksi eksoterm. Berdiskusi tentang persamaan termokimia. Konsep entalpi dan perubahannya dipahami. Reaksi endoterm dan reaksi eksoterm dibedakan melalui percobaan. Menuliskan persamaan termokimia dengan benar. Tes lisan Tes tertulis Laporan praktikum66- Buku pelajaran LKS Alat dan bahan praktikum
3. 2 Menentukan perubahan entalpi reaksi Perubahan entalpi reaksi Melakukan percobaan untuk menentukan perubahan entalpi reaksi. Jumlah kalor diketahui melalui perhitungan secara kuantitatif. Perubahan entalpi reaksi diketahui melalui percobaan. Tes lisan Tes tertulis Laporan praktikum Buku pelajaran LKS Alat dan bahan praktikum
3. 3 Menentukan kalor pembakaran berbagai bahan bakar Kalor reaksi Energi bahan bakar Berdiskusi tentang entalpi pembentukan (Hf = Entalpy of Formation). Melakukan perhitungan untuk menentukan kalor reaksi berdasarkan hukum Hess. Berdiskusi tentang energi bahan bakar. Menentukan entalpi pembentukan dari persamaan termokimia. Hukum Hess digunakan dalam menentukan kalor reaksi. Menyebutkan sumber-sumber bahan bakar. Menuliskan persamaan reaksi pembakaran dengan tepat. Tes lisan Tes tertulis Tugas individu Buku pelajaran LKS Internet
NAMA SEKOLAH: SMK KESEHATAN SABILURRAHIMMATA PELAJARAN: KimiaKELAS/SEMESTER: XI / 1STANDAR KOMPETENSI : Mengidentifikasi faktor-faktor yang mempengaruhi laju reaksiKODE KOMPETENSI: 4ALOKASI WAKTU: 16 x 45 menit
KOMPETENSI DASARMATERI PEMBELAJARANKEGIATAN PEMBELAJARANINDIKATORPENILAIANALOKASI WAKTUSUMBER BELAJAR
TMPSPI
4. 1 Menentukan laju reaksi dan orde reaksi Konsep laju reaksi Menentukan laju reaksi berdasarkan grafik hasil percobaan, dan melalui perhitungan. Laju reaksi diketahui dan dijelaskan berdasarkan grafik hasil percobaan dan perhitungan secara kuantitatif. Tes tertulis Tes lisan Tugas individu66- Buku pelajaran LKS Internet
4. 2 Menjelaskan faktor-faktor yang mempengaruhi laju reaksi Faktor-faktor yang mempengaruhi laju reaksi Persamaan laju reaksi Berdiskusi tentang faktor-faktor yang mempengaruhi laju reaksi. Melakukan percobaan untuk menunjukkan pengaruh berbagai faktor terhadap laju reaksi. Berdiskusi tentang bentuk persamaan laju reaksi dan makna orde reaksi. Menentukan persamaan laju reaksi Menyebutkan faktor-faktor yang mempengaruhi laju reaksi (luas area kontak, konsentrasi pereaksi, tekanan, suhu, dan katalis). Pengaruh luas area kontak terhadap laju reaksi, pengaruh suhu terhadap laju reaksi, dan pengaruh katalis pada laju reaksi dibuktikan melalui percobaan. Mampu membedakan laju reaksi, persamaan reaksi, dan tetapan laju reaksi. Mampu menjelaskan makna orde reaksi (reaksi orde nol, reaksi orde satu, reaksi orde dua, dan orde negatif). Persamaan laju reaksi ditentukan melalui perhitungan kuantitatif. Tes tertulis Tes lisan Tugas individu/kelompok Laporan praktikum Buku pelajaran LKS Alat dan bahan praktikum (gelas kimia, larutan kimia, dll)
NAMA SEKOLAH: SMK KESEHATAN SABILURRAHIMMATA PELAJARAN: KimiaKELAS/SEMESTER: XI / 2STANDAR KOMPETENSI : Memahami konsep larutan elektrolit dan larutan kimiaKODE KOMPETENSI: 1ALOKASI WAKTU: 16 x 45 menit
KOMPETENSI DASARMATERI PEMBELAJARANKEGIATAN PEMBELAJARANINDIKATORPENILAIANALOKASI WAKTUSUMBER BELAJAR
TMPSPI
1. 3 Menerapkan konsep reaksi redoks dalam elektrokimia Bilangan oksidasi Reaksi redoks Penyetaraan reaksi redoks Berdiskusi tentang bilangan oksidasi. Berdiskusi tentang perkembangan konsep oksidasi dan reduksi. Berdiskusi tentang oksidator dan reduktor, serta reaksi disproporsionasi dan komproporsionasi. Melakukan penyetaraan reaksi redoks melalui metode bilangan oksidasi dan metode setengah reaksi (ion-elektron). Bilangan oksidasi ditentukan berdasarkan aturan-aturan yang telah ditentukan. Mampu membedakan oksidasi dan reduksi. Mampu menentukan reaksi redoks dan reaksi bukan redoks. Mampu membedakan oksidator dan reduktor. Memahami reaksi disproporsionasi dan komproporsionasi. Metode bilangan oksidasi dan metode setengah reaksi dilakukan untuk menyetarakan reaksi redoks. Tes lisan Tes tertulis Tugas individu88- Buku pelajaran LKS Internet
1. 4 Menggunakan satuan konsentrasi dalam membuat larutan Sel volta Korosi besi Elektrolisis Melakukan percobaan untuk menunjukan reaksi redoks spontan. Berdiskusi tentang susunan sel volta, dan notasi sel volta. Menentukan potensial ekeltrode standar (Eo). Berdiskusi tentang konsep korosi besi dan melakukan percobaan untuk mempelajari faktor-faktor yang mempengaruhi korosi besi. Berdiskusi tentang susunan sel elektrolisis dan reaksi-reaksi elektrolisis. Berdiskusi tentang hukum-hukum Faraday. Berdiskusi tentang penggunaan elektrolisis dalam indistri. Reaksi redoks spontan dibuktikan melalui percobaan. Susunan dan notasi sel volta dipahami dan dituliskan dengan benar. Potensial standar sel (Eo) ditentukan dengan tepat melalui perhitungan secara kuantitatif. Beberapa sel volta komersial dipahami dan disebutkan. Percobaan dilakukan untuk mengetahui faktor-faktor yang menyebabkan korosi besi. Cara-cara pencegahan korosi besi dipahami dan diterapkan. Anoda dan katoda dipahami sebagai penyusun sel elektrolisis. Reaksi-reaksi elektrolisis dipahami dan dianalisis. Melakukan perhitungan secara kuantitatif untuk menentukan massa zat yang dibebaskan dengan menggunakan hukum Faraday. Penggunaan elektrolisis dalam industri (produksi zat, pemurnian logam, dan penyepuhan) dipahami. Tes lisan Tes tertulis Laporan praktikum Buku pelajaran LKS Internet Alat dan bahan praktikum
TM: Tatap mukaPS: Praktik di Sekolah (2 jam praktIk di sekolah setara dengan 1 jam tatap muka)PI: Praktik di Industri (4 jam praktIk di Du/Di setara dengan 1 jam tatap muka)
KELOMPOK:
SILABUS MATA PELAJARAN KIMIA
Teknologi dan KesehatanHalaman 1 dari 10
SILABUS Kimia SMK SABILURRAHIM