Memeriksa Dan Menginterpretasikan Ukuran Cadangan Ovarium Pendapat Komite
-
Upload
ririn-wahyuni -
Category
Documents
-
view
95 -
download
0
Transcript of Memeriksa Dan Menginterpretasikan Ukuran Cadangan Ovarium Pendapat Komite
Memeriksa dan Menginterpretasikan Ukuran Cadangan Ovarium: Pendapat KomiteSaat ini , tidak ada definisi yang diterima secara merata dari penurunan cadangan ovarium (DOR), karena istilah ini dapat merujuk pada tiga hasil terkait tetapi berbeda: kualitas oosit, jumlah oosit, atau potensi reproduksi. Bukti yang tersedia mengenai kinerja uji cadangan ovarium terbatas oleh ukuran sampel yang kecil, heterogenitas antara desain penelitian, analisis dan hasil, dan kurangnya ukuran hasil yang valid.
Proses penuaan reproduksi berpusat pada prinsip yang berlaku umum bahwa oosit manusia memuncak jumlahnya selama kehidupan janin, yang mengalami atresia sesudahnya, dan tidak- beregenerasi. Meskipun fertilitas wanita menurun seiring dengan usia, sulit untuk memprediksi laju penurunan reproduksi pada setiap wanita. Meskipun demikian, dokter sering dimintai nasihat mengenai potensi fertilitas dan rekomendasi untuk perawatan fertilitas. Dokumen pemerintah ini meninjau bukti yang berkaitan dengan penggunaan klinis dan nilai prediksi pemeriksaan cadangan ovarium. Pengertian akan keterbatasan uji skrining pada umumnya, dan uji cadangan ovarium khususnya, diperlukan untuk menghindari kebingungan dan salah penafsiran, atau penyalahgunaan hasil.
APAKAH YANG DIMAKSUD DENGAN CADANGAN OVARIUM ?
Jelas, wanita dengan usia yang sama dapat memiliki respon yang sangat berbeda terhadap stimulasi ovarium dan memiliki potensi reproduksi yang berbeda. Konsep cadangan ovarium melihat potensi reproduksi sebagai fungsi dari jumlah dan kualitas oosit yang tersisa. Penurunan atau pengurangan cadangan ovarium ( DOR ) menggambarkan wanita usia reproduktif memiliki menstruasi yang teratur yang memiliki penurunan respon terhadap stimulasi ovarium atau kesuburan dibandingkan dengan wanita dengan usia yang sama Penurunan cadangan ovarium berbeda dengan menopause atau kegagalan ovarium prematur, dan juga dapat digambarkan sebagai insufisiensi ovarium primer ( 1 ). Meskipun uji cadangan ovarium melayani telah diterapkan secara luas, perdebatan terus berlangsung atas kemampuan uji yang saat ini digunakan untuk memprediksi tiga hasil terkait, tetapi jelas berbeda: kualitas oosit, jumlah oosit, dan kesuburan.Dalam kebanyakan kasus, penyebab DOR tidak diketahui. Tidak jelas apakah DOR merupakan suatu kondisi patologis akibat atresia abnormal yang cepat dari kumpulan oosit normal, dari atresia normal kumpulan kecil oosit awal abnormal, atau hanya ujung yang ekstrim dari distribusi populasi berbentuk lonceng yang normal dari jumlah oosit pada usia tertentu. Hilangnya oosit dan potensi fertilitas terkait dengan paparan kemoterapi sistemik, radiasi pelvis, dan kelainan genetik (misalnya, 45, mosaicism kromosom X, premutasi FMR1). Penurunan cadangan ovarium tidak terkait dengan prilaku gaya hidup lainnya, dengan kemungkinan pengecualian dari merokok ( 2 ).
MENGAPA MENGUKUR CADANGAN OVARIUM ?
Meskipun jumlah dan kualitas oosit menurun dengan usia, fertilitas bervariasi secara signifikan di kalangan perempuan dengan usia yang sama. Akibatnya, sejumlah uji termasuk ukuran biokimia dan pencitraan ovarium, yang dikenal sebagai uji cadangan ovarium, telah diajukan untuk membantu memprediksi cadangan ovarium dan / atau potensi reproduksi. Pada wanita dengan menstruasi teratur, uji cadangan ovarium tidak memprediksi apakah mereka memasuki masa menopause atau perimenopause atau membedakan apakah mereka mengalami penurunan fertilitas yang patologis atau seperti yang diperkirakan. Ketika merawat pasangan dengan infertilitas, dokter menggunakan faktor-faktor seperti usia dan diagnosis untuk konseling setiap pasien dan menyesuaikan rencana pengobatan. Tujuan dari pemeriksaan cadangan ovarium ini adalah menambahkan informasi yang lebih prognostik pada konseling dan proses perencanaan sehingga dapat membantu pasangan memilih di antara pilihan pengobatan. Namun, penting untuk menekankan bahwa uji cadangan ovarium tidak sempurna dan tidak boleh menjadi satu-satunya kriteria yang digunakan untuk menolak akses pasien ke assisted reproductive technologies (ART) atau terapi lain. Bukti penurunan cadangan ovarium tidak selalu sama dengan ketidakmampuan untuk hamil.
APA UKURAN DARI CADANGAN OVARIUM?
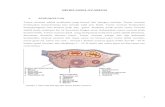
Uji cadangan ovarium meliputi uji biokimia dan pencitraan ultrasonografi dari ovarium. Uji biokimia cadangan ovarium dapat dibagi lebih lanjut menjadi pengukuran basal, termasuk pengukuran follicle-stimulating hormone ( FSH ), estradiol, inhibin B, dan hormon antimullerian ( AMH ), dan uji provokatif seperti clomiphene citrate challenge test ( CCCT ). Pengukuran biokimia dari cadangan ovarium dimaksudkan untuk menyelidiki dan untuk mencerminkan biologi penuaan ovarium, satu komponen dari sistem reproduksi yang paling dekat hubungannya dengan penurunan kesuburan.
Inhibin B dan AMH adalah hormon glikoprotein yang diproduksi oleh folikel ovarium kecil dan oleh karena itu merupakan ukuran langsung dari kumpulan folikel. Sementara AMH terutama disekresi oleh folikel primer, preantral, dan antral, inhibin B disekresikan terutama oleh folikel preantral. Dengan menurunnya jumlah folikel ovarium seiring dengan usia, baik konsentrasi AMH maupun inhibin B fase folikuler awal menurun. Penurunan sekresi inhibin B menurunkan tingkat umpan balik negatif sentral, yang menghasilkan peningkatan sekresi FSH hipofisis dan peningkatan lambat dari konsentrasi FSH folikel luteal dan awal (ukuran ''tidak langsung''). Pada gilirannya, peningkatan sebelumnya dalam kadar FSH merangsang onset awal pertumbuhan folikel baru dan peningkatan konsentrasi estradiol, yang akhirnya mengurangi lamanya fase folikuler dan siklus keseluruhan. Uji cadangan ovarium menilai respon dari aksis hipotalamus - hipofisis - ovarium terhadap stimulus.
Ukuran ultrasonografik dari cadangan ovarium termasuk hitung folikel antral ( AFC ) dan volume ovarium. AFC menggambarkan jumlah total folikel yang berukuran 2-10 milimeter dengan diameter yang diamati selama scan transvaginal fase folikular awal. Jumlah folikel antral berkorelasi dengan ukuran kumpulan folikel yang tersisa dan jumlah oosit diambil setelah stimulasi. Volume ovarium menurun dengan usia dan oleh karena itu dapat menjadi indikator potensial lainnya dari cadangan ovarium .
BAGAIMANA UJI CADANGAN OVARIUM DIGUNAKAN ?
Secara historis, uji cadangan ovarium dimaksudkan untuk digunakan pada skrining pasien sebelum memulai siklus in vitro fertilization ( IVF ) dan untuk mengobati pasien yang berada dalam kisaran normal seperti yang didefinisikan oleh masing-masing pusat. Namun, penelitian yang memeriksa kinerja uji cadangan ovarium telah menggunakan populasi pasien dan hasil yang heterogen, yang sangat mempersulit interpretasi mereka. Sementara beberapa telah menskrining populasi IVF umum, yang lainnya telah menargetkan populasi wanita lanjut usia, yang berusaha untuk membedakan wanita dengan prognosis yang baik dari wanita dengan prognosis yang buruk meskipun usia kronologis mereka serupa.
Ukuran cadangan ovarium telah digunakan untuk memprediksi DOR, tetapi DOR telah didefinisikan dalam berbagai cara, termasuk baik penurunan kesuburan ( kemampuan untuk mencapai kehamilan ) maupun respon ovarium yang buruk terhadap stimulasi gonadotropin. Ukuran respon ovarium seperti jumlah folikel, jumlah oosit yang diambil, jumlah embrio, dan cancelation rate adalah pengganti untuk hasil yang secara klinis penting: kehamilan dan kelahiran hidup. Hasil pengganti ini terkait dengan hasil klinis yang penting, tetapi tidak identik. Heterogenitas dalam populasi penelitian dan paparan dan hasil yang bervariasi telah menghasilkan berbagai karakteristik uji untuk ukuran cadangan ovarium yang dilaporkan dalam literatur. Oleh karena itu, efektivitas uji cadangan ovarium yang dilaporkan sebagai uji skrining bervariasi. Dengan demikian, penting untuk mempertimbangkan desain penelitian secara cermat ketika menerapkan hasil penelitian ini untuk menskrining pasien.
Prinsip Dasar Uji Skrining
Tujuan dari suatu uji skrining adalah untuk mengidentifikasi orang yang beresiko untuk suatu penyakit. Tujuan dari pemeriksaan dengan menggunakan cadangan ovarium sebagai uji skrining adalah untuk mengidentifikasi pasien infertilitas yang berisiko untuk mengalami DOR, yang lebih mungkin untuk menunjukkan respon yang buruk terhadap stimulasi gonadotropin dan memiliki kesempatan yang lebih rendah untuk mencapai kehamilan dengan ART, paling sering IVF . Penting untuk ditekankan bahwa uji skrining tidak mendiagnosis DOR.
Uji skrining memiliki sejumlah karakteristik uji, termasuk sensitivitas, spesifisitas, nilai prediksi positif ( PPV ), dan nilai prediksi negatif ( NPV ), yang semuanya berubah dengan ambang diagnostik, atau cutpoint, yang digunakan untuk mengklasifikasikan individu sebagai beresiko untuk mengalami DOR ( misalnya, FSH 11,4 mIU / mL ) ( 3 ). Uji skrining yang baik memiliki validitas. Sensitivitas dan spesifisitas merupakan dua ukuran uji validitas (Gambar 1). Sebuah uji yang valid dengan benar mengkategorikan orang yang memiliki penyakit sebagai uji positif (sangat sensitif) dan mereka yang tidak memiliki penyakit sebagai uji negatif (sangat spesifik). Dengan kata lain, uji yang sangat sensitif akan menangkap semua pasien yang mengalami penurunan cadangan ovarium. Mengubah cutpoints untuk mengoptimalkan sensitivitas akan meminimalkan jumlah negatif palsu (pasien dengan DOR dikategorikan sebagai normal), namun peningkatan hasil uji positif palsu (pasien dengan cadangan ovarium yang normal dikategorikan memiliki DOR). Sebuah tes yang sangat spesifik akan secara benar mengidentifikasi semua pasien yang tidak mengalami DOR. Mengubah cutpoints untuk mengoptimalkan spesifisitas akan meminimalkan positif palsu, tetapi meningkatkan negatif palsu.
Secara grafis, cutpoints sensitivitas dan spesifisitas yang berbeda dari uji diagnostik dapat diplot dalam kurva receiver operating characteristic ( ROC ). Kurva ini membantu mengidentifikasi cutpoint yang memaksimalkan sensitivitas dan spesivisitas. Namun, ambang diagnostik yang secara optimal menyeimbangkan spesivisitas dan sensitivitas untuk mengidentifikasi pasien yang beresiko mengalami DOR selalu mengorbankan beberapa spesivisitas untuk membuktikan sensitivitas dan dengan demikian mungkin tidak menjadi pilihan terbaik untuk perawatan klinis.Untuk aplikasi klinis, ambang batas untuk mempertimbangkan uji cadangan ovarium sebagai abnormal harus memiliki spesivisitas yang tinggi untuk DOR. Spesivisitas adalah karakteristik uji yang harus dioptimalkan untuk mengurangi positif palsu, atau salah mengkategorikan pasien dengan cadangan ovarium yang normal sebagai mengalami DOR. Untuk dokter, uji yang sangat spesifik membantu untuk menghindari pengobatan over agresif pada pasien dengan cadangan ovarium normal. Selain itu, ia akan menghindari untuk merekomendasikan adopsi atau donasi oosit untuk pasien yang mungkin memiliki potensi untuk memiliki keturunan genetik sendiri. Karena sensitivitas dikorbankan ketika spesivisitas dioptimalkan, uji yang sangat spesifik untuk DOR juga akan menghasilkan lebih banyak wanita yang mencoba hasil IVF yang tidak tahu bahwa prognosisnya buruk.
Nilai prediksi positif dan nilai prediksi negatif merupakan karakteristik uji skrining yang berubah dengan prevalensi penyakit ( DOR ) dalam populasi penelitian. PPV adalah probabilitas dimana seorang wanita yang diuji positif benar-benar mengalami DOR. NPV adalah probabilitas dimana seorang wanita yang diuji negatif memiliki cadangan ovarium yang normal.
Karakteristik uji yang paling penting dari uji cadangan ovarium skrining adalah nilai prediktif daripada sensitivitas atau spesivisitas. Meskipun nilai prediktif ditentukan dengan sensitivitas dan spesivisitas, ia juga tergantung pada prevalensi DOR dalam populasi. Prinsip ini sangat penting dalam menentukan siapa yang harus diskrining. Jika prevalensi atau risiko DOR rendah (misalnya, pada wanita muda), PPV ( probabilitas dimana seorang wanita yang diuji positif benar-benar memiliki DOR ) akan rendah, bahkan jika sensitivitas dan spesivisitasnya tinggi. Jika prevalensi DOR tinggi ( misalnya, pada wanita yang lebih tua ), PPV akan tinggi jika cutpoint uji yang sangat spesifik dipilih. Oleh karena itu, jelas bahwa uji cadangan ovarium paling berguna dalam mengidentifikai DOR pada wanita yang berisiko tinggi untuk mengalami DOR. Idealnya, untuk uji cadangan ovarium yang secara klinis berguna untuk konseling pasien, karakteristik uji dan prevalensi DOR dalam populasi spesifik atau klinik harus diketahui. Beragam nilai yang dilaporkan dalam literatur membuatnya sulit untuk menggunakan ukuran ini secara klinis.
Penggunaan uji skrining untuk DOR dalam suatu populasi dengan risiko rendah untuk kondisi ini menimbulkan beberapa masalah. Yang paling penting, banyak wanita akan dikategorikan sebagai memiliki DOR yang, pada kenyataannya, memiliki cadangan ovarium yang normal. Implikasinya penting ketika menskrining wanita yang belum pernah menerima pengobatan infertilitas dan mereka yang mungkin hanya ingin tahu tentang potensi reproduksi mereka. Uji cadangan ovarium pada wanita berisiko rendah untuk DOR akan menghasilkan jumlah yang lebih besar dari hasil positif palsu (PPV yang lebih rendah) ( 4 ). Masalahnya adalah diperparah dengan penggunaan tes di rumah, di mana profesi medis yang berkualifikasi tidak tersedia untuk menafsirkan dan menjelaskan hasilnya.
FSH BasalKonsentrasi FSH basal serum meningkat pada hari ke-2, 3, atau 4 siklus menstruasi dengan bertambahnya usia reproduksi. Namun, pemeriksaan untuk FSH memiliki variabilitas yang signifikan antar dan intra siklus yang membatasi reliabilitas mereka ( 5-7 ). Korelasi keseluruhan di antara uji FSH yang berbeda sangat baik, tetapi nilai absolut dapat berbeda dari satu dengan uji lain ( 8 ). Suatu perubahan dalam standar referensi, dari standar gonadotropin menopause manusia (International Referrence Preparation [ IRP ] - hMG ) menjadi World Health Organization ( WHO ) Second International Standard ( IRP 78/549 ) mempersulit generalisasi cutpoints FSH. Contoh konversi nilai IRP - hMG menjadi nilai IRP 78/549 adalah sebagai berikut: FSH tinggi 25 mIU / mL ( IRP - hMG ) = 16,7 ( IRP 78/549 ), FSH cukup tinggi 17 mIU / mL ( IRP - hMG ) = 11.4 ( IRP 78/549 ), atau FSH normal < 15 mIU / mL ( IRP - hMG) = < 10 mIU / mL ( IRP 78/549 ) ( 8 ). Dengan demikian, dokter mungkin merasa sulit untuk menggeneralisasi cutpoints FSH yang dilaporkan dalam literatur medis untuk praktek mereka kecuali mereka menggunakan preparat uji dan referensi yang sama ( 7 ).
Meskipun dengan keterbatasannya, FSH umumnya digunakan sebagai ukuran cadangan ovarium, dan nilai yang tinggi dikaitkan dengan, tetapi tidak selalu memprediksi, baik stimulasi ovarium yang buruk maupun kegagalan untuk hamil ( 8 ). Uji standar terhadap WHO Second International Standard menunjukkan spesivisitas yang tinggi (kisaran 83 % -100 %) untuk memprediksi respon yang buruk terhadap stimulasi ( biasanya didefinisikan sebagai folikel < 2-3 atau 4 dari oosit yang diambil ) dengan menggunakan beberapa cutpoints di atas 10 IU / L ( 10-20 IU / L ) ( 8 ). Namun, sensitivitas untuk mengidentifikasi wanita yang akan memiliki respon yang buruk bervariasi ( 10 % -80 % ) dan menurun dengan meningkatkan cutpoints FSH ( 8 ). Dengan menggunakan cutpoints yang serupa, FSH jauh kurang sensitif untuk memprediksi kegagalan untuk mencapai kehamilan. Sebuah penelitian baru-baru ini yang menggunakan kurva efisiensi menunjukkan spesivisitas 100 % untuk kegagalan mencapai kelahiran hidup dengan nilai FSH di atas 18 IU / L ( 9 ) . Cutpoints yang menghasilkan spesivisitas tinggi ( 80 % -100 %) memiliki sensitivitas yang rendah ( 10 % -30 % ) ( 8 ).Sebagai konsekuensinya, sebagian besar wanita yang diuji ( termasuk dengan DOR ) tidak akan memiliki nilai FSH normal. Uji ini masih secara klinis berguna, karena seseorang dapat cukup yakin bahwa wanita yang memiliki nilai FSH abnormal akan memiliki DOR. PPV FSH untuk respon yang buruk terhadap stimulasi ovarium atau kegagalan untuk hamil lebih tinggi pada wanita yang lebih tua.
Kadar FSH yang tinggi belum dikaitkan dengan peningkatan risiko aneuploidi dalam kehamilan yang dihasilkan dari IVF ( 10 , 11 ). Meskipun FSH meningkat dengan meningkatnya usia reproduksi, belum diketahui apakah kadar FSH yang tinggi pada wanita usia reproduksi memprediksi onset dini dari menopause ( 12 ).
Variabilitas dalam kadar FSH sering meminta dokter untuk mengulang pemeriksaan. Sementara peningkatan konsentrasi FSH secara konsisten memberikan prognosis yang buruk ( 13 ), peningkatan tunggal nilai FSH pada wanita < 40 tahun mungkin tidak memprediksi respon yang buruk terhadap stimulasi atau kegagalan untuk mencapai kehamilan ( 13 ). Bukti yang terbatas menunjukkan bahwa wanita dengan kadar FSH yang berfluktuasi tidak harus menunggu untuk siklus yang ideal, dimana konsentrasi FSH adalah normal, untuk menjalani stimulasi IVF (5, 14).
Telah dilaporkan bahwa FSH basal memiliki penggunaan yang terbatas sebagai uji skrining ( 8, 15, 16 ). Pada cutpoints tinggi yang memaksimalkan spesivisitas, sensitivitas moderat untuk respon yang buruk terhadap stimulasi dan sangat rendah untuk kegagalan mencapai kehamilan. Meskipun relatif sedikit wanita dengan DOR yang akan diuji abnormal jika cutpoints tinggi, mereka yang memiliki tes abnormal sangat mungkin untuk memiliki DOR.
Singkatnya, nilai FSH tunggal sangat terbatas reliabilitasnya karena variabilitas antar dan intra - siklus ( terutama jika ia tidak meningkat ). Peningkatan kadar FSH memiliki spesivisitas yang baik, tetapi mungkin merupakan positif palsu terutama bila digunakan dalam populasi berisiko rendah. Mengingat variabilitas antar uji FSH, cutpoint yang dipilih oleh program IVF idealnya harus didasarkan pada data sendiri atau data dari penelitian yang menggunakan uji FSH yang sama ( Tabel 1 ).
EstradiolSebagai uji cadangan ovarium, estradiol basal pada hari ke 2, 3, atau 4 siklus menstruasi memiliki reliabilitas antar - dan intra siklus yang buruk ( 17 ). Sebagian besar penelitian telah menemukan bahwa estradiol basal tidak berbeda antara wanita dengan dan tanpa DOR, terlepas dari apakah hasil yang diukur adalah respon yang buruk terhadap stimulasi ovarium atau kegagalan untuk mencapai kehamilan ( 18-28 ). Estradiol basal saja tidak boleh digunakan untuk skrining DOR. Uji ini hanya memiliki nilai sebagai bantuan untuk interpretasi yang benar dari nilai FSH basal serum yang normal. Seperti dibahas sebelumnya, peningkatan dini dari konsentrasi estradiol serum merupakan karakteristik klasik penuaan reproduksi dan dapat menurunkan kadar FSH basal yang tinggi ke kisaran normal, sehingga menyebabkan salah tafsir uji. Ketika konsentrasi FSH basal normal tetapi kadar estradiol meningkat ( > 60-80 pg / mL ) dalam fase folikuler awal, terdapat bukti yang terbatas mengenai hubungan dengan respon yang buruk, peningkatan cancelation rates, atau angka kehamilan yang lebih rendah ( 28-30 ).
Clomiphene Citrate Challenge Test
CCCT melibatkan pengukuran FSH serum sebelum (hari ke-3 siklus) dan setelah (hari ke-10 siklus) pengobatan dengan clomiphene citrate ( 100 mg setiap hari, hari ke-5-9 siklus ). Sementara meningkatnya inhibin B dan kadar estradiol yang berasal dari kelompok folikel ovarium yang tumbuh akan menekan FSH pada wanita dengan ovarium responsif, kumpulan folikel yang kecil yang dapat direkrut pada wanita dengan DOR akan menghasilkan inhibin B dan estradiol yang lebih sedikit, yang menghasilkan penurunan inhibisi umpan balik negatif dari sekresi FSH dan konsentrasi FSH stimulasi yang lebih tinggi. Peningkatan konsentrasi FSH setelah stimulasi clomiphene menyarankan DOR. Hasil penelitian CCCT telah mengamati variabilitas antar - siklus yang signifikan pada kadar FSH stimulasi dan perbedaan antara dan konsentrasi estradiol dan inhibin B basal dan stimulasi, yang membatasi reliabilitas CCCT ( 6 , 31 , 32 ). Sebuah tinjauan sistematis terbaru yang meneliti kemampuan CCCT untuk memprediksi respon ovarium yang buruk atau kehamilan setelah IVF dalam rentang hari ke- 10 kadar FSH ( 10-22 IU / L ) pada wanita berisiko rendah, moderat, dan tinggi untuk mengalami DOR. Untuk hasil respon ovarium yang buruk, spesivisitas konsentrasi FSH hari ke-10 berkisar antara 47 % hingga 98 % dan sensitivitas bervariasi antara 35 % hingga 93 % ( 33 ). Untuk hasil kegagalan untuk mencapai kehamilan, spesivisitas telah ditemukan berkisar antara 67 % hingga 100 % dan sensitivitas antara 13 % hingga 66 % tergantung pada penelitian ( 33 ). Dengan kata lain, dari 10 wanita yang tidak hamil yang menjalani IVF, antara 1 hingga 7 wanita akan memiliki kadar FSH hari - 10 yang abnormal ( sensitivitas ) dan 10 wanita yang hamil, 7-10 akan memiliki nilai FSH hari ke-10 yang normal. Dalam penelitian yang membandingkan kinerja uji dari nilai FSH basal (hari ke-3 siklus) dan stimulasi (hari ke-10 siklus), kadar FSH stimulasi memiliki sensitivitas yang tinggi tetapi spesivisitas yang lebih rendah daripada konsentrasi FSH basal ( 33 ). Dibandingkan dengan FSH basal dan AFC, kadar FSH hari ke-10 yang distimulasi dengan clomiphene tidak secara jelas meningkatkan akurasi tes untuk memprediksi respon ovarium yang buruk atau kehamilan setelah IVF ( 32-34 ).
Singkatnya, ukuran basal FSH mungkin lebih baik daripada CCCT, kecuali jika ada yang menggunakan uji dengan tujuan meningkatkan sensitivitas ( Tabel 1 ).
Hormon AntimullerianKonsentrasi AMH serum, yang diproduksi oleh sel granulosa folikel awal, adalah independen gonadotropin dan oleh karena itu tetap relatif konsisten di dalam dan antar siklus menstruasi pada wanita muda yang berovulasi secara normal dan pada wanita dengan infertilitas (17, 35-37).
Hormon antimullerian diuji sebelumnya terutama dengan dua perangkat uji yang berbeda ( 38 ). Sebuah perangkat uji yang lebih baru yang didasarkan pada teknologi yang berbeda telah mengganti uji yang lama ( 39 ). Meskipun hasil yang didapatkan dengan dua perangkat uji sangat berkorelasi, kurva standar tidak paralel dan tidak ada faktor konversi yang berlaku secara universal ( 40 ) . Oleh karena itu, cutpoints yang dikembangkan dan dilaporkan untuk satu uji AMH secara komersial tidak digeneralisasikan ke uji komersial lainnya. Ketika menerapkan cutpoints AMH dalam praktek klinis, dokter harus sangat berhati-hati untuk menentukan bahwa uji yang digunakan untuk mengukur AMH adalah sama dengan yang digunakan dalam populasi penelitian referensi. Selain itu, hasil dapat bervariasi antara laboratorium komersial yang berbeda dengan menggunakan uji yang sama.
Penelitian AMH sebagai uji skrining untuk cadangan ovarium telah melibatkan tiga penelitian pada populasi yang berbeda-populasi IVF umum, subpopulasi wanita berisiko rendah untuk DOR, dan sub-populasi wanita berisiko tinggi untuk DOR. Secara keseluruhan, kadar AMH yang rendah telah dikaitkan dengan, tetapi tidak selalu memprediksi, respon buruk untuk stimulasi ovarium, kualitas embrio yang buruk, dan hasil kehamilan yang buruk dengan IVF (41-45). Penelitian yang mengkorelasikan rata-rata kadar AMH yang berbeda dengan hasil IVF tidak menyediakan cutpoints AMH yang berguna untuk perawatan klinis ( 18 , 42 , 43 , 46 ).
Dalam berbagai penelitian dari populasi IVF umum, cutpoints AMH yang rendah ( 0,2-0,7 ng / mL DSL ELISA ) telah ditemukan memiliki sensitivitas berkisar antara 40 % hingga 97 % dan spesivisitas bervariasi dari 78% hingga 92 % untuk < 3 folikel atau 2-4 oosit yang diambil (19, 41, 47, 48). Nilai prediktif positif dari cutpoints ini untuk hasil yang sama bervariasi antara 22 % hingga 88 %. NPV yang tinggi, antara 97 % hingga 100 %, namun cutpoints ini tidak sensitif maupun spesifik untuk memprediksi kehamilan ( 19 , 47 , 48 ). Berbagai karakteristik uji dan prevalensi DOR yang bervariasi dalam penelitian yang berbeda mempersulit penggunaan ukuran-ukuran ini secara klinis. Idealnya, data spesifik lokasi harus digunakan untuk konseling pasien.
Penelitian yang terbatas untuk wanita berisiko rendah untuk mengalami DOR kecil dan kriteria eksklusi yaitu digunakan seperti FSH, usia yang lebih tua, anovulasi , dan faktor laki-laki yang berat (49 , 50). Hasilnya bervariasi dari 5 oosit yang diambil hingga keamilan klinis per pengambilan oosit. Cutpoints 2,5-2,7 ng / mL memiliki sensitivitas 83 %, 82 % spesivisitas, PPV 67% -77 %, dan NPV 61 % -87 % untuk kehamilan klinis ( 20 , 49 ). Dengan kata lain, AMH < 2,7 ng / mL akan secara benar memprediksi wanita yang tidak hamil dalam 6 sampai 8 dari 10 wanita, tetapi akan salah pada 2-4 wanita ( PPV ). Cutpoint 1,4 ng / mL memiliki sensitivitas 76 %, spesivisitas 86 % , dan PPV 67 % untuk 5 oosit yang diambil ( 50 ). Cutpoints AMH yang tinggi ini mengurangi spesivisitas untuk DOR dan, karena prevalensi yang rendah dari penurunan cadangan ovarium, ia menghasilkan PPV yang rendah.
Beberapa penelitian telah membatasi sampel populasi pada wanita berisiko tinggi DOR dengan merekrut wanita yang lebih tua, mereka dengan peningkatan FSH, atau mereka dengan riwayat respon yang buruk ( 21 , 42 ). Dengan menggunakan AMH yang tidak dapat terdeteksi sebagai cutpoint menghasilkan sensitivitas 76 % dan spesivisitas 88 % untuk memprediksi 3 folikel PPV adalah 68 % dan NPV adalah 92 % ( 42 ). Cutpoint AMH yang lebih tinggi dari 1,25 ng / mL menghasilkan sensitivitas 85 %, spesivisitas63 %, PPV 41 %, dan NPV 96 % untuk cancelation cycle ( 3 % folikel ), dan sensitivitas 58 %, spesivisitas 75%, PPV 76 %, dan NPV 57 % untuk respon yang buruk ( 4 oosit atau cancelation rate ) ( 21 ). Keterbatasan penerapan AMH dalam populasi berisiko tinggi adalah bahwa beberapa subyek dengan hasil IVF yang normal memiliki nilai AMH yang rendah. Karena wanita yang normal dan mereka dengan DOR memiliki nilai AMH yang rendah hingga tidak terdeteksi yang tumpang tindih, spesivisitas tidak dapat dioptimalkan sampai 100%, yang mencerminkan keterbatasan ambang uji AMH.Singkatnya, AMH adalah uji skrining yang menjanjikan dan mungkin lebih berguna pada populasi umum atau IVF pada wanita berisiko tinggi untuk DOR dibandingkan pada wanita berisiko rendah untuk DOR. Cutpoints AMH yang rendah cukup spesifik untuk respon ovarium yang buruk, tetapi tidak untuk kehamilan. Penelitian selanjutnya dari AMH sebagai uji skrining harus memasukkan sejumlah besar subyek berisiko tinggi atau populasi umum IVF. Penggunaan AMH sebagai alat skrining rutin untuk DOR pada populasi berisiko rendah tidak direkomendasikan ( Tabel 1 ).
Hitung Folikel Antral
Hitung folikel antral adalah jumlah folikel antral pada kedua ovarium, yang diamati dengan ultrasonografi transvaginal selama fase folikuler awal. Kebanyakan penelitian telah mendefinisikan folikel antral sebagai folikel yang berdiameter rata-rata 2-10 mm dalam bidang 2 - dimensi ( 2 - D ) terbesarl; beberapa telah mendefinisikan folikel antral sebagai folikel yang berdiameter rata-rata 3-8 mm. Hitung folikel antral memiliki reliabilitas antar - siklus maupun antar - pengamat yang baik di pusat-pusat yang berpengalaman ( 21 , 51-54 ). AFC yang rendah (kisaran 3-10 total folikel antral ) telah terkait dengan, tetapi tidak selalu memprediksi, respon yang buruk terhadap stimulasi ovarium dan kegagalan untuk mencapai kehamilan ( 55 ).
Dalam populasi penelitian IVF umum pasien berisiko rendah dan tinggi untuk DOR, cutpoints AFC yang rendah dengan 3-4 total folikel ( gabungan kedua ovarium) sangat spesifik ( 73 % -100 % ) untuk memprediksi respons ovarium yang buruk ( cancelation cycle, < 3-4 folikel atau oosit yang diambil ) ( 21-23 , 52 , 55-58 ), tetapi memiliki sensitivitas yang lebih rendah ( 9 % -73 % ). Cutpoints yang sama cukup spesifik untuk memprediksi kegagalan untuk hamil ( 64 % - 100 % ), tetapi sensitivitasnya secara konsisten rendah ( 8 % -33 % ). PPV dan NPV AFC untuk memprediksi respon yang buruk bervariasi dalam penelitian subyek IVF umum. Spesivisitas yang tinggi dari AFC yang rendah membuat tes berguna untuk memprediksi respon ovarium yang buruk dan kegagalan pengobatan, tetapi penggunaan klinis dibatasi oleh sensitivitas yang rendah. Variabilitas antar dan intra - pengamat juga mungkin terbatas, terutama di pusat-pusat yang kurang memiliki keahlian atau kualitas peralatan USG yang lebih rendah.Singkatnya, penggunaan AFC dapat membantu untuk memprediksi stimulasi dan hasil akhir kehamilan yang buruk tetapi tidak dapat menjadi kriteria tunggal untuk aplikasi ART ( Tabel 1 ).
Inhibin BInhibin B bukan merupakan ukuran yang dapat diandalkan dari cadangan ovarium. Kadar inhibin B meningkat dengan stimulasi GnRH atau FSH ( dasar uji dinamik dari cadangan ovarium ) dan karena itu menunjukkan variabilitas intra - siklus yang tinggi ( 21 , 41 , 43 ). Kadar inhibin B juga bervariasi secara signifikan antara siklus menstruasi ( 21 ).
Dalam populasi IVF umum, inhibin B lebih rendah dalam responder yang buruk dibandingkan pada wanita dengan respon stimulasi ovarium yang normal ( 42 , 59 ). Respon buruk paling umum didefinisikan sebagai < 3-5 folikel yang berkembang, yang menghasilkan cancelation siklus IVF, atau sebagai 4 oosit yang diambil. Cutpoints untuk inhibin B yang rendah bervariasi menurut penelitian ( 40-141 pg / mL ). Cutpoints inhibin B yang rendah dalam kisaran 40-45 pg / mL memiliki spesivisitas antara 64 % hingga 90 % dan sensitivitas antara 40 % hingga 80 %. PPV inhibin B umumnya rendah ( 19 % -22 % ) dan NPV tinggi ( 95 % -97 % ) pada populasi umum IVF ( 41 , 46 ). Dalam populasi berisiko tinggi untuk DOR, PPV dapat setinggi 83% ( 21 ). Sebagian besar penelitian menunjukkan bahwa inhibin B tidak membedakan kehamilan dan kegagalan untuk hamil ( 20 , 21 , 24 , 60 , 61 ).
Singkatnya, penggunaan rutin inhibin B sebagai ukuran cadangan ovarium tidak direkomendasikan ( Tabel 1 ).Volume ovariumVolume ovarium dihitung dengan mengukur setiap ovarium dalam tiga bidang dan menggunakan rumus untuk volume ellips ( D1 x D2 x D3 x 0,52 = volume). Rata-rata volume ovarium yaitu rata-rata volume kedua ovarium pada individu yang sama. Volume ovarium memiliki reliabilitas yang terbatas sebagai uji cadangan ovarium. Beberapa penelitian melaporkan variabilitas antar siklus yang signifikan secara klinis, namun penelitian ini tidak konsisten ( 4 , 21 , 62 ). Ketika volume ovarium diperoleh dan disimpan oleh USG-3D, variabilitas intra dan inter - observer diminimalkan, tetapi peralatan khusus diperlukan ( 63 ). Secara keseluruhan, volume ovarium berkorelasi dengan jumlah folikel dan oosit yang diambil tetapi tidak dengan kehamilan ( 22 , 55 , 64-66 ). Selain itu, penelitian volume ovarium sering mengeksklusikan pasien dengan kelainan ovarium, termasuk mereka dengan sindrom ovarium polikistik, endometrioma, dan kista yang besar (67 , 68 ). Dengan demikian, generalisasi masih terbatas.
Beberapa penelitian telah menunjukkan bahwa volume ovarium yang rendah, biasanya < 3 mL, atau rata-rata diameter yang rendah, < 2 cm , memprediksi respon yang buruk terhadap stimulasi ovarium dengan spesivisitas tinggi ( 80-90 % ) dan berbagai nilai sensitivitas ( 11-80 % ) ( 8 , 21). PPV yang dilaporkan telah mencapai 17 % untuk wanita dengan risiko rendah DOR ( 23 ), dan setinggi 53 % pada wanita berisiko tinggi untuk DOR ( 21 ). Secara umum, volume ovarium menjadi prediktor kehamilan buruk.
Singkatnya, volume ovarium memiliki nilai terbatas untuk deteksi DOR. Hitung folikel antral adalah tes pencitraan yang lebih baik untuk menskrining DOR daripada volume ovarium .
KOMBINASI UJI CADANGAN OVARIUMKarena tidak ada ukuran tunggal untuk cadangan ovarium yang memiliki sensitivitas dan spesivisitas 100 %, pemeriksaan biokimia dan pencitraan telah digabungkan dalam upaya untuk meningkatkan karakteristik uji. Meringkas validitas dan reliabilitas kombinasi uji cadangan ovarium dalam skrining DOR adalah sulit karena heterogenitas dalam cutpoints dan pilihan ukuran dalam penelitian ( 8 ). Gabungan uji cadangan ovarium menimbulkan masalah lain karena uji setiap individu dapat sangat berkorelasi. Akibatnya, memasukkan lebih dari satu ukuran dalam model prediksi tidak meningkatkan uji karakteristik secara konsisten ( 22 , 48 , 59). Selain itu, menggunakan tes kombinasi membutuhkan dokter untuk mendapatkan semua pemeriksaan pada pasien mereka, yang menambah biaya skrining untuk DOR.
Teknik yang berbeda telah digunakan untuk menerjemahkan signifikansi statistik dari hasil yang diperoleh dengan kombinasi penanda untuk signifikansi klinis. Beberapa telah mengembangkan sistem scoring berisiko tinggi ( 39 , 40 ). Penelitian lain menggunakan model regresi multivariabel untuk memprediksi respon yang buruk terhadap stimulasi ovarium maupun jumlah folikel / oosit yang diambil ( 22 , 32 , 58 , 69 ). Namun, persamaan yang rumit sulit untuk diterapkan secara klinis dan tidak memberikan cutpoints yang jelas untuk setiap uji cadangan ovarium yang disertakan. Analisis prospektif kombinasi AMH, inhibin B, dan penilaian tiga dimensi dari AFC dan volume ovarium menyimpulkan bahwa hanya AFC dan AMH yang memprediksi respon ovarium yang buruk, dan prediksi tersebut tidak lebih baik daripada yang berasal dari setiap tes secara sendiri atau dalam kombinasi. Khususnya, tidak ada uji yang memprediksi kegagalan untuk hamil ( 70 ).
Singkatnya, model gabungan uji cadangan ovarium tidak secara konsisten meningkatkan kemampuan prediksi daripada satu uji cadangan ovarium. Sistem scoring berisiko tinggi yang menggabungkan dua atau lebih ukuran mungkin secara klinis bermanfaat, namun memerlukan validasi lebih lanjut.
RINGKASAN
Saat ini, tidak ada definisi yang diterima secara merata dari DOR, karena istilah ini dapat merujuk pada tiga hasil terkait tetapi jelas berbeda: kualitas oosit, jumlah oosit, atau potensi reproduksi. Bukti yang tersedia mengenai kinerja uji cadangan ovarium dibatasi oleh ukuran sampel yang kecil, heterogenitasantara desain penelitian, analisis dan hasil, dan oleh kurangnya hasil yang valid. Rancangan penelitian yang diterbitkanharus diperiksa dengan teliti sebelum menerapkan hasildalam praktek klinis. Sejumlah uji cadangan ovarium yang berbeda telah disarankan sebagai uji skrining untuk membantu memprediksi keberhasilan dengan IVF.Idealnya, uji skrining yang optimal harus dapat direproduksi( variabilitas antar dan intra - siklus rendah) dan menunjukkan spesivisitas yang tinggi untuk meminimalkan risiko salah mengkategorikanwanita dengan cadangan ovarium yang normal ssebagai mengalami penurunancadangan ovarium. Uji skrining itu sendiri tidak dapat mendiagnosis penurunan cadangan ovarium. Secara keseluruhan, FSH adalah uji skrining yang paling umum digunakan untuk DOR, tetapi AFC dan AMH merupakan prediktor yang menjanjikan. Uji cadangan ovarium di rumah memiliki keterbatasan danperangkap serius, termasuk kompleksitas interpretasi uji dandigunakan dalam populasi berisiko rendah untuk penurunan cadangan ovarium,yang mengakibatkan salah tafsir dan menimbulkan kepastian palsu atau kecemasan dan perhatian yang tidak perlu.KESIMPULAN
Terdapat tidak cukup bukti untuk merekomendasikan bahwa setiap uji cadangan ovarium yang sekarang tersedia harus digunakan sebagai satu-satunya kriteria untuk penggunaan ART. Ada bukti yang baik untuk mendukung kesimpulan bahwasejumlah hasil tes positif palsu akan meningkat bila uji skrining untuk penurunan cadangan ovarium digunakan dalampopulasi berisiko rendah. Ada cukup bukti yang menunjukkan bahwa FSH memiliki spesivisitas yang tinggi, tetapi sensitivitas yang rendah, ketika nilai cutpoint yang tinggidigunakan untuk memprediksi respon yang buruk terhadap stimulasi ovariumatau kegagalan untuk hamil. Idealnya, cutpoint FSH yang dipilih harus didasarkan pada data spesifik lokasi atau hasilpenelitian yang menggunakan uji FSH yang sama. Ada cukup bukti untuk membantah anggapan bahwa respon ovarium atau kehamilan akan meningkat dalam siklusdimana konsentrasi FSH normal di antara wanitayang menunjukkan nilai tinggi yang abnormal sebelumnya. Ada cukup bukti terhadap penggunaan konsentrasi estradiol basal sebagai uji skrining tunggal untuk penurunan cadangan ovarium. Ada cukup bukti bahwa konsentrasi estradiol basal membantu interpretasi yang akurat dari konsentrasi FSH basal yang digunakan untuk skrining penurunan cadangan ovarium. Ada bukti adil untuk mengatakan bahwa clomiphene citrateuji tantang telah sedikit meningkat sensitivitas untuk mendeteksicadangan ovarium menurun dibandingkan dengan FSH basalkonsentrasi. Ada banyak bukti yang mendukung penggunaan AMH sebagaiuji skrining untuk respon ovarium yang buruk, tetapi lebih banyak datayang diperlukan. Ada bukti yang muncul yang menunjukkan bahwakadar AMH yang rendah (misalnya, AMH yang tidak terdeteksi) memiliki spesivisitas yang tinggi untuk skrining respon ovarium yang buruk tetapi tidak cukupbukti yang menunjukkan penggunaannya untuk skrining kegagalan untuk hamil. Ada cukup bukti yang mendukung bahwa hitung folikel antral yang rendah ( 3-10 ) memiliki spesivisitas yang moderat hingga tinggi sebagai uji skrining respon ovarium yang buruk dan tidak cukupbukti yang mendukung penggunaan AFC sebagai uji skrining kegagalan untuk hamil. Ada cukup bukti yang melawan penggunaan inhibin B basal sebagai uji skrining untuk DOR. Ada cukup bukti yang melawan penggunaan konsentrasi estradiol basal estradiol sebagai uji skrining tunggal DOR. Ada cukup bukti yang melawan penggunaan volume ovarium sebagaiuji skrining untuk penurunan cadangan ovarium. Ada cukup bukti yang menunjukkan bahwa kombinasihasil beberapa uji skrining untuk penurunan cadangan ovarium lebih berguna daripada satu tes saja.