Kuliah Enzim PSKG 2013
-
Upload
akmalsatibi -
Category
Documents
-
view
30 -
download
0
Transcript of Kuliah Enzim PSKG 2013
LEARNING OBJECTIVE
Setelah mengikuti perkuliahan ini, mahasiswa
mampu memahami :Nomenclature enzimSiafat-sifat enzimKinetics enzimMekanisme Kerja enzim
3
REFERENSI
Harper’s Illustrated Biochemistry. Murray, R.K; D.K. Granner; P.A; Mayes. V.W. Rodwell. 2003. Twenty-Seventh Edition. International Edition. Mcgraw-Hill Companies inc. Lange Medical Publication
PENDAHULUAN
4
METABOLISME :KATABOLISME
MOLEKUL YG LEBIH BESAR MOLEKUL YG LEBIH KECILGLUKOSA CO2 + H2O + ENERGI
ANABOLISME = SINTESISMOLEKUL YG LEBIH KECIL MOLEKUL YG LEBIH BESARGLUKOSA GLIKOGEN
MAKANAN DICERNA dalam saluran pencernaan
DIMETABOLISME dalam sel
ENZIMSEL JARINGAN ORGANISME
tersusun dari molekul2
REAKSI KIMIA
5
LETAK ENZIM DALAM SEL
- ENZIM MITOKONDRIAL : Reaksi pengadaan energi, reaksi oksidasi yang menghasilkan energi- ENZIM RIBOSOMAL : Reaksi biosintesis protein
ENZIM INTI : Berkaitan dengan perangkat genetika ENZIM LISOSIM : .Berkaitan dengan proses digestif intrasellular, .Destruksi hidrolitik bahan yang tak diperlukan sel Enzim mikrosomal : . Reaksi hidroksilasi dalam sintesis hormon steroid .Metabolisme dan inaktivasi obat
6
• LETAK ENZIM DALAM SEL– BERKAITAN DGN FUNGSI ORGANEL Ybs.– E. MITOKONDRIAL REAKSI PENGADAAN ENERGI
Reaksi oksidasi EnergiRantai respirasi dalam mitokondria
– E. RIBOSOMAL SINTESIS PROTEIN• KATALISATOR mempercepat reaksi
– IKUT SERTA DALAM REAKSI KIMIA & MEMPERCEPAT REAKSI KIMIA, TETAPI PD. AKHIR REAKSI AKAN DIDAPAT KEMBALI SEPERTI SEMULA
– DIBUTUHKAN DLM. JUMLAH KECIL
E +S
CELAH AKTIF
KOMPLEKS [ES] E
+P
Enzim merupakan senyawa organik bermolekul besar (komponen utama protein)
yang berfungsi untuk mempercepat jalannya reaksi metabolisme di dalam tubuh
tanpa mempengaruhi keseimbangan reaksi
Enzim tidak ikut bereaksi, struktur enzim tidak berubah baik sebelum dan sesudah
reaksi tetapEnzim sebagai biokatalisator
Bagian enzim yang aktif adalah sisi aktif dari enzim
9
KATALISATOR INORGANIK
1. H+, OH-, Pt2. E. aktivasi 3. -4. -
ENZIM
1. PROTEIN biokatalisator
2. E aktivasi 3. BEREAKSI
SPESIFIK4. TIDAK TAHAN
PANAS
10
Ea
Ea'
Ea''
Perjalananreaksi
E. le
vel
G
E. bebas
kead. transisi
tanpa katalisator
dgn katalisator inorg
dgn enzim
G = PerubahanE. bebas
kead. awal
kead. akhir
KLASIFIKASI & TATANAMA ENZIM
11
TATANAMA ENZIM IUBMB:NAMA ENZIM T.D. 2 BAGIAN:
Bgn. 1 NAMA SUBSTRATBgn. 2 JENIS REAKSI +
ASE
NomenklaturUmumnya nama:Contoh:
PhosphofructokinaseAcetylcholinesteraseDNA Polymerase
Secara Tradisional penamaan enzim ditambahkan. “ase”
Misal :Proteinase (enzim)
substrat Protein
Enzim pengendali glikolisis, memerlukan energi tubuh agar berjalan
Acetylcholinesterase bekerja memecah Acetylcholine menjadi Acetate dan Choline, enzim ini dapat dihambat insektisida maka Acetylcolie tdk pecah akibatnya menumpuk dan menyebabkan kontrakasi otot sampai kejang pada nyamuk mati
KELAS-KELAS ENZIM MENURUT IUBMB
14
ADA 6 KELAS (GOLONGAN) UTAMA :1. OKSIDOREDUKTASE :
MENGKATALISIS REAKSI OKSIDASI – REDUKSI.P.U. : ENZIM2 PD. PROSES OKSIDASI BIOLOGIS
PIRUVAT + NADH + H+ LAKTAT + NAD+
2. TRANSFERASE : MENGKATALISIS REAKSI2 PEMINDAHAN GUGUS FUNGSIONAL
(BUKAN HIDROGEN) MISAL AMINA, KARBOKSIL, METIL, ASIL DLL.S–G + S’ S’–G + S
-D-GLUKOSA+ATP -DGLUKOSA-6-P +ADP
3. HIDROLASE : MENGKATALISIS PEMUTUSAN IKATAN KOVALEN SAMBIL
MENGIKAT AIRContoh : Enzim - Amilase
- Lipase- Karboksi peptidase A
Laktat dehidrogenase
Mg++
HeksokinaseGlukokinase
KELAS-KELAS ENZIM MENURUT IUBMB
15
Reaksi ––– -D-GALAKTOSIDA + H2O = suatu alkohol + D-galaktosa
4. LIASE (LYASE) : MENGKATALISIS REAKSI PEMBENTUKAN ATAU PEMECAHAN IKATAN RANGKAP
DUA, ATAU PEMBELAHAN LAIN YG. MENYANGKUT PENYUSUNAN KEMBALI ELEKTRON (MEMUTUS IKATAN KOVALEN TANPA MENGIKAT AIR)
Contoh : ALDOLASE : KETOSA-I-PALDOSA + DIHIDROKSI ASETON-P FUMARASE :
HO – CH – COOH H – C – COOH | = || + H2O CH2 – COOH HOOC – C – H
MALAT FUMARAT PIRUVAT DEKARBOKSILASE :
O O || ||– OOC – C – CH3 + H+ CO2 + H – C – CH3
PIRUVAT ASETALDEHID
KELAS-KELAS ENZIM MENURUT IUBMB
16
5. ISOMERASE : MENGKATALISIS REAKSI ISOMERISASI.All Trans – retinin 11 – cis – retinin
6. LIGASE : MENGGABUNGKAN 2 MOLEKUL, DISERTAI PEMUTUSAN
IKATAN PIROFOSFAT PD. ATP ATAU SENYAWA SEJENIS (MENGKATALISIS PEMBENTUKAN IKATAN KOVALEN)
Mis : ~ PIRUVAT KARBOKSILASE :
O O || || – OOC – C – CH3 + CO2 – OOC – C – CH2 – COO –ATP ADP+Pi
PIRUVAT OKSALOASETAT
Klasifikasi EnzimDehidrogenase- Oksidasi substrat menggunakan Kofaktors sebagai akseptor atau donor elektron. contoh: Piruvate dehidrogenase)Reductase- : menambah elektrons dari kofaktor reduksi
Contoh: enoyl ACP reduktaseKinase- : phosphorilase substrate. Contoh: hexokinase Hidrolase : menggunakan air untuk memecah Molekul.
Phosphatase : - hidrolisa ester phosphate. Contoh: glucose-6-phosphatase.Esterase (lipase): hidrolisa esters , sedangkan yg bekerja pada ester lipid adalah lipase.
Contoh : lipoprotein lipaseThioesterase : hidrolisa thioestersThiolase : - menggunakan thiol untuk membantu pembentukan thioester. Contoh: β-ketothiolase.Isomerase :- interkonversi dari isomer. contoh: aldose ke ketose; triose phosphate isomerase
19
MEKANISME KERJA ENZIM
ENZIM PROTEIN TERSUSUN DARI ASAM AMINO
ASAM AMINO DALAM LARUTAN SELALU berbentuk ion tergantung pH larutan
R - C - COOH RUMUS UMUM ASAM AMINO I NH2
AKTIVITAS KATALITIK ENZIM ERAT HUBUNGANNYA DENGAN STRUKTUR ENZIM (PROTEIN)
Contoh-contoh aktifitas enzim yang umum
KinaseSerine/Threonine
(rantai samping protein tdk aktif)
TyrosinePhosphatase (Pi
posfat di lepas) Serin pada sisi
aktif H diganti PO4 memerlukan 1 ATP
Susunan enzimKomponen utama enzim adalah protein Protein yang sifatnya fungsional
(bergerak dalam cairan sel), bukan protein struktural(ada dalam jaringan –terikat)
Tidak semua protein bertindak sebagai enzim contoh Albumin,Globulin.
Enzim
Protein Enzim protein sederhana
Protein +Bukan Protein
Protein = apoenzim
Enzim Konjugasi
Bukan protein =Gugus prostetik
Organik =Koenzim
Anorganik = kofaktor
Apoenzim adalah protein yang belum sebagai enzim berfungsi bila ada koenzim (vitamin) atau kofaktor (logam) Mg, Zn, Co dsb.
Heksokinase pada metabolisme Karbohidrat harus ada kofaktor Mg.
Enzim
Katalisator BiologisSpecifik untuk Reaksi Kimia; Tidak habis dipakai
dalam reaksi, jadi setelah reaksi enzim kembali lagi kebentuknya.
Apoenzime: proteinKofaktor: Komponen Nonprotein
Coenzyme: Kofaktor OrganikHoloenzime: Apoenzime + kofaktor
Lock and Key Teori FisherApoenzim tdk cocok dgn substrat dgn adanya koenzim jadi cocok (aktif)
Figure 5.3
Active side of enzyme1. Fisher Theory : Lock and Key
Tanpa koenzim mis Acetylcholine,
E-Ko pakai ko enzim. S2 kofaktor/koenzim msk dari sisi yg jauh dari sisi aktif dan akhirnya sisi aktifnya sesuai substratnya sehingga reaksi berjalan.
2. Induced fit KhoslandAda muatan – perubahan konformasi. Lysin dan metionin pada sisi aktif ketarik. Enzim allosteric (enzimk pengendali jalur reaksi)dipengaruhi dari jauh. Terjadi tarik menarik ion yg berlawanan.
Gugus hidrofobik dan gugus bermuatan (warna biru) sama-sama terlibat dalam pengikatan substrat ( gugus pengikatan )
Gugus fosfoserin (-P) dan residu sistein (-SH) terlibat dalam proses katalisis( gugus katalitik )
Lys dan Met tidak terlibat prosesKeadaan tanpa (S) gugus gugus katalitik dan
gugus pengikatan substrat terpisah dengan jarak beberapa ikatan
Mendekatnya substrat (S) menimbulkan perubahan konformasi protein enzim yang menyusun gugus pengikatan substrat dan katalitik
Pada saat yang sama daerah lain juga berubah, residu Lys dan metionin mendekat
KonezimKonezim Pelopor VitaminPelopor Vitamin FungsiFungsi
Nikotinamide Adenine Di Nukletida (NADNikotinamide Adenine Di Nukletida (NAD++))Nikotinamide Adenine Nukleotida Phosphat Nikotinamide Adenine Nukleotida Phosphat (NADP(NADP++))Flavin Adenine Dinukleotida (FAD)Flavin Adenine Dinukleotida (FAD)Flavin Mononukleotida (FMN)Flavin Mononukleotida (FMN)Asam LipoatAsam LipoatHemeHemeTiamin PiroPhosphat (TPP)Tiamin PiroPhosphat (TPP)Piridoksal Phosphat (Py)Piridoksal Phosphat (Py)
Koenzim A ( Co ASH)Koenzim A ( Co ASH)Asam Tetrahidrofolat (THF)Asam Tetrahidrofolat (THF)BiotinBiotin5'-Deoksiadenosil kobalamine ( Koenzim B 5'-Deoksiadenosil kobalamine ( Koenzim B
1212))
NiasinNiasin NiasinNiasin
RiboflavinRiboflavinRiboflavinRiboflavinTidak adaTidak adaTidak adaTidak adaThiaminThiaminPiridoksinPiridoksin
Asam PantotenatAsam PantotenatAsam FolatAsam Folat
Kobalamin ( B Kobalamin ( B 12)12)
RedoksRedoksRedoksRedoksRedoksRedoksRedoksRedoksRedoksRedoksRedoksRedoksOksidasi Oksidasi dekarboksilasidekarboksilasiTransaminasi-Transaminasi-RasemasiRasemasiTransfer ggs asil.Transfer ggs asil.
Transfer GgsTransfer Ggssatu karbon.satu karbon.Transfer COTransfer CO
22
Transfer ggsTransfer ggsmetilmetil
Oksidasi-reduksiKeadaan tereduksi ATP akan teroksidasi
ADP teroksidasi lanjut AMP Posfat terlepas satu -- > tereduksi
EnzimEnzim dibentuk dalam protoplasma selEnzim beraktifitas di dalam sel tempat
sintesisnya (disebut endoenzim) maupun di tempat yang lain diluar tempat sintesisnya (disebut eksoenzim)
Sebagian besar enzim bersifat endoenzimUmumnya ada dalam sel, kalau ada di luar
sel menunjukkan ada sel yg rusak. Banyak yg rusak patologis (enzim dalam darah meningkat)– SGOT, SGPT meningkat
Enzim pada Diagnosa Patologis
1.Khas Enzim pada Hati yaitu AST (SGOT= Serum Glutamat Oxaloasetat Amino transferase), & ALT (SGPT =Serum Glutamat-piruvate Transminase) SGPT banyak dijumpai di hepatosit.. ;
Normal rasio SGPT/SGOT kurang dari 1
2..LDH ( Lactate Dehydrogenase) bila ada kenaikan dalam 12-24 jam yaitu pada Kelainan Infark Jantung . Lalu kembali normal pada hari ke 5-10.
3..CPK ( Creatine Phosphokinase atau CK) terutama dijumpai pada Otot Jantung, otot Rangka dan juga otak Jadi Pemeriksaan ini baik untuk mengetahui bila ada kelaianan, Pada organ Otot Jantung, otot rangka dan otak. CPK-MB levelnya meningkat pada 3-6 jam serangan Infark jantung dan mencapai puncak 12-24 jam, normal kembali bila tidak ada kerusakan lebih lanjut 12-48 jam.
PENGUKURAN KADAR ENZIM DLM. PLASMA
35
ENZIM PLASMA FUNGSIONAL
(YG. BERFUNGSI DLM. PLASMA)
MIS. : ENZ.2 PROSES PEMBEKUAN
DARAH LIPOPROTEIN LIPASE
KADAR : GANGGUAN PROSES SINTESIS
DI HATI / (-) : KELAINAN GENETIK
DEFISIENSI F VIII : HEMOFILIA
ENZIM PLASMA NON FUNGSIONAL(YG. BERFUNGSI DI JARINGAN
LAIN, TIDAK DLM. PLASMA)
N : PERGANTIAN SEL (SEL MATI DIGANTI SEL BARU)
DIFFUSI PASIF
: SEL MATI RADANG Ca TRAUMA PENYAKIT GENETIK
(CONTOH: DMD)
UNTUK MEMBANTU DIAGNOSIS
GEN : SUATU SEGMEN DNA YG. BERISI INFORMASI/KODEGENETIK SUSUNAN ASAM AMINO, SUATU RANTAI POLI-PEPTIDA/PROTEIN mRNA POLPEPTIDA/PROTEIN
Sifat Enzim1. Enzim bersifat koloid, luas permukaan besar,
bersifat hidrofil2. Dapat bereaksi dengan senyawa asam maupun
basa, kation maupun anion3.
Enzim sangat peka terhadap faktor-faktor yang menyebabkan denaturasi protein misalnya suhu, pH dll
4. Enzim dapat dipacu maupun dihambat aktifitasnya
5. Enzim merupakan biokatalisator yang dalam jumlah sedikit memacu laju reaksi tanpa merubah keseimbangan reaksi
6. Enzim tidak ikut terlibat dalam reaksi, struktur enzim tetap baik sebelum maupun setelah reaksi berlangsung
7. Enzim bermolekul besar8. Enzim bersifat khas/spesifik
Dipacu dinaikkan kons substrat atau temp dinaikkan
Dihambat diberi inhibitorKhas/spesifik hanya satu reaksi yg
spesifik kalau redoks akan bekerja di redoks saja.
Spesifik: hanya cocok untuk satu macam substrat saja atau sekelompok kecil substrat yang susunanya hampir sama dan fungsinya sama
A B C DE1 E2 E3
E4
E5
Enzim
Suhu: optimum 30 C, minimum 0 C, maksimum 40 C
Logam, memacu aktifitas enzim: Mg, Mn, Co, FeLogam berat, menghambat aktivitas enzim: Pb,
Cu,Cd, Ag, Hg (inhibitor)pH, tergantung pada jenis enzimnya (pepsin
aktif kondisi asam, amilase kondisi netral, tripsin kondisi basa)
EnzimKonsentrasi substrat, substrat yang banyak
mula-mula memacu aktifitas enzim, tetapi kemudian menghambat karena: penumpukan produk (feed back effect)
Konsentrasi enzim, peningkatan konsentrasi enzim memacu aktifitasnya
Air, memacu aktifitas enzimVitamin, memacu aktifitas enzim
Faktor mempengaruhi aktifitas Enzim
Enzimes dapat berubah atau rusak oleh tempratur dan pH. Tetramer terurai
Figure 5.6
pH and Temperature Dependence
Enzim masing2 mempunyai pH dan temperature optimumsPikirkan dimana enzim bekerja?Contoh: Pepsin adalah aktif di lambung.
bekerja aktif pada suasana pH asam dan 37°C
Apa yang terjadi pada protein umumnya pada pH/temperature yang ekstrim?
Kinetik Michaelis –Menten (( Kurva Enzim Saturasi)Plot Dari Konsentrasi Substrat versus Reaksi Velocity
Michaelis and Menten, and later Briggs and Haldane used the scheme to drive a matematical expression :
Vmax (S) V = -------------- Km + (S) V : Kecepatan Vmax : Kecepatan max (S) : substrate concentration Km : Michaelis constantKm = 1(s) – V = V max (s)/(s) (s) = ½ V max.Km 6 s – V = 1/6 V max ( substrat boros,
enzim boros dan kecepata rendah.
50
BILA [S] Km , MAKA V BERBANDING LURUS DENGAN (S)
BILA [S] = Km , SEHINGGA V = 1/2 VMAX
BILA [S] Km , MAKA V = VMAX
51
HARGA Km MENUNJUKKAN AFFINITAS (DAYA IKAT)
ENZIM TERHADAP SUBSTRAT APABILA SUATU ENZIM BEKERJA
TERHADAP LEBIH DARI 1 MACAM SUBSTRAT HARGA Km UNTUK MASING-MASING SUBSTRAT BERBEDA, CONTOH : ENZIM HEKSOKINASE
52
ENZIM HEKSOKINASE :SUBSTRAT Km (mM)Glukosa 0,15Fruktosa 1,15
ARTINYA HEKSOKINASE MEMPUNYAI AFFINITAS TERHADAP GLUKOSA LEBIH BESAR DARIPADA TERHADAP FRUKTOSA
Inversion of the Michaelis – Menten Eq as rereciprocals on Lineweaver-Burk plot Fungsi Linier 1 = Km 1 + 1 V Vmax (S) Vmax
Figure LINEWEAVER-BURK PLOTMenggambarkan kalau ada inhibitor
Vmax
1
Vmax
1
1
Vo
(S)
-1
Km
Slope=Km
Lineaer eq.
Enzim Inhibitor dibagi 2 kelompok: 1.Yang menyebabkan tidak aktifnya
enzim Irreversible ( tidak bisa kembali lagi)
Effek inhibitor dapat kembali lagi. Inhibitor biasanya menyebabkan tidak aktifnya modifikasi kovalen dari struktur enzim.
Contohnya: Cyanida sebagai Klasik Enzim ireversible inhibitor, dimana terikat secara
Kovalen pada Cytochrome Oxidase mitokondria. Dimana akan menghambat semua Reaksi yang berhubungan dengan transport elektron.
2.Reversible Inhibitor a.Noncompetitive Inhibitor b.Competive Inhibitor c.Uncompetitive Inhibitor Plot Lineweaver- Burks Enzim
Inhibited (dihambat )
Penghambatan aktifitas fungsional enzim reversibel ada tiga tipe
1. Kompetitif: zat penghambat memp struktur yg mirip dengan substrat sehingga dapat bergabung dgn sisi aktif enzim. Terjadi kompetisi antara substrat dengan
inhibitor untuk bergabung dgn sisi aktif enzim (misal feed back effect)
2. Non kompetitif: zat penghambat menyebabkan struktur enzim rusak sehingga sisi aktifnya tidak cocok lagi dgn substrat
3. Unkompetitif : enzim dan inhibitor masing2 bekerja sendiri2 tetapi dpt mengubah bbrp parameter enzim
Inhibition of enzyme
1. Competitive inhibition (etanol dan metanol
berkompetesi thdp enzim yg sama)
Slope, Km and Vmax ??? ( Parameter2 enzim)( slope dan Km berubah, yg tdk berubah V max)
Vmax
1
Vmax
1
1
Vo
(S)
-1
Km
Slope=Km
Slope increases
2. Noncompetitive Inhibition (Aspirin inhibitor pada enzym Cyclooksigenase (cox 1)
Km, Vmax and Slope decrease or increase ???(Slope dan V max berubah. Km tdk berubah.)
Vmax
1
Vmax
1
1
Vo
(S)
-1
Km
Slope=Km
Slope increases
new line after inhibition
3.Uncompetitive inhibition Slope, Km and Vmax ?? Change/ no change (slope tdk berubah karena sejajar, yg berubah Km dan V max)
Vmax
1
Vmax
1
1
Vo
(S)
-1
Km
Slope=Km
new line after inhibition
Slope no change
Faktor mempengaruhi aktifitas Enzim
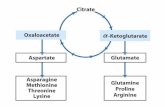
Feedback inhibition
Satu jalur reaksi substrat dan enzim ( 4) ada produk akhir. Produk akhir menghambat enzim diatasnya secara non kompetitif sehingga sisi aktifnya berubah bentuk sehinga jalur tdk
berjalan.Figure 5.8