Hukum Faraday _ Chem-Is-Try.org _ Situs Kimia Indonesia
description
Transcript of Hukum Faraday _ Chem-Is-Try.org _ Situs Kimia Indonesia

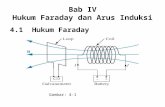
Hukum FaradayKata Kunci: arus listrik, hukum Faraday, mol elektronDitulis oleh Zulfikar pada 31-05-2010
Faraday mengamati peristiwa elektrolisis melalui berbagai percobaan yang dia lakukan. Dalam pengamatannyajika arus listrik searah dialirkan ke dalam suatu larutan elektrolit, mengakibatkan perubahan kimia dalam larutantersebut.
Sehingga Faraday menemukan hubungan antara massa yang dibebaskan atau diendapkan dengan arus listrik.Hubungan ini dikenal dengan Hukum Faraday.
Menurut Faraday
Jumlah berat (massa) zat yang dihasilkan (diendapkan) pada elektroda sebanding dengan jumlah muatanlistrik (Coulumb) yang dialirkan melalui larutan elektrolit tersebut.
1.
Masa zat yang dibebaskan atau diendapkan oleh arus listrik sebanding dengan bobot ekivalen zat-zattersebut.
2.
Dari dua pernyataan diatas, disederhanakan menjadi persamaan :
dimana,
M = massa zat dalam grame = berat ekivalen dalam gram = berat atom: valensii = kuat arus dalam Amperet = waktu dalam detikF = Faraday
Dalam peristiwa elektrolisis terjadi reduksi pada katoda untuk mengambil elektron yang mengalir dan oksidasipada anoda yang memberikan eliran elektron tersebut. Dalam hal ini elektron yang dilepas dan yang diambildalam jumlah yang sama.
Bobot zat yang dipindahkan atau yang tereduksi setara dengan elektron, sehingga masa yang dipindahkanmerupakan gram ekivalen dan sama dengan mol elektron. Faraday menyimpulkan bahwa Satu faraday adalahjumlah listrik yang diperlukan untuk menghasilkan satu ekivalen zat pada elektroda.
Muatan 1 elektron = 1,6 x 10-19 Coulomb1 mol elektron = 6,023 x 1023 elektronMuatan untuk 1 mol elektron = 6,023 . 1023 x 1,6 . 10-19= 96.500 Coulomb= 1 Faraday
Kata Pencarian Artikel ini:
Hukum Faraday | Chem-Is-Try.Org | Situs Kimia Indonesia | http://www.chem-is-try.org/materi_kimia/kimia-kesehatan/reaksi-kimia-...
3 of 6 2/24/2013 7:51 PM