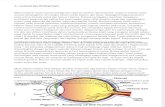
titrasi bner
description
Transcript of titrasi bner
I.Judul Percobaan: Titrasi Asam BasaII.Hari/Tanggal Percobaan: Jumat/ 13 Desember 2013; 10.30 WIBIII.Selesai Percobaan: Jumat/ 13 Desember 2013; 12.50 WIBIV. Tujuan Percobaan : 1.Menentukan konsentrasi larutan NaOH dengan larutan baku asam oksalat 2. Menentukan konsentrasi larutan HCl dengan larutan NaOHV.Tinjauan Pustaka
Titrasi merupakan suatu metoda untuk menentukan kadar suatu zat dengan menggunakan zat lain yang sudah diketahui konsentrasinya. Titrasi biasanya dibedakan berdasarkan jenis reaksi yang terlibat di dalam proses titrasi, sebagai contoh bila melibatan reaksi asam basa maka disebut sebagai titrasi asam basa, titrasi redox untuk titrasi yang melibatkan reaksi reduksi oksidasi, titrasi kompleksometri untuk titrasi yang melibatan pembentukan reaksi kompleks dan lain sebagainya. Zat yang akan ditentukan kadarnya disebut sebagai titrant dan biasanya diletakan di dalam Erlenmeyer, sedangkan zat yang telah diketahui konsentrasinya disebut sebagai titer dan biasanya diletakkan di dalam buret. Baik titer maupun titrant biasanya berupa larutan. Titrasi asam basa disebut juga titrasi adisi alkalimetri. Kadar atau konsentrasi asam basa larutan dapat ditentukan dengan metode volumetri dengan teknik titrasi asam basa. Volumetri adalah teknik analisis kimia kuantitatif untuk menetapkan kadar sampel dengan pengukuran volume larutan yang terlibat reaksi berdasarkan kesetaraan kimia. Kesetaraan kimia ditetapkan melalui titik akhir titrasi yang diketahui dari perubahan warna indicator dan kadar sampel untuk ditetapkan melalui perhitungan berdasarkan persamaan reaksi.Titrasi asam basa merupakan teknik untuk menentukan konsentrasi larutan asam atau basa. Reaksi yang terjadi merupakan reaksi asam basa (netralisasi). Larutan yang kosentrasinya sudah diketahui disebut larutan baku. Titik ekuivalen adalah titik ketika asam dan basa tepat habis bereaksi dengan disertai perubahan warna indikatornya. Titik akhir titrasi adalah saat terjadinya perubahan warna indicator. Titrasi merupakan salah satu cara untuk menentukan konsentrasi larutan suatu zat dengan cara mereaksikan larutan tersebut dengan zat yang diketahui konsentrasinya secara tepat. Prinsip dasar titrasi asam basa didasarkan pada reaksi netralisasi asam basa.Titik ekuivalen pada titrasi asam basa adalah pada saat dimana sejumlah asam dinetralkan oleh sejumlah basa. Selama titrasi berlangsung terjadi perubahan pH. Pada titik ekuivalen ditentukan oleh sejumlah garam yang dihasilkan dari netralisasi asam basa. Indikator yang digunakan pada titrasi asam basa adalah yang memiliki rentang pH dimana titik ekuivalen berada. Pada umumnya titik ekuivalen tersebut sulit diamati, yang mudah diamati adalah titik akhir yang dapat terjadi sebelum atau sesudah titik ekuivalen tercapai. Titrasi harus dihentikan pada saat titik akhir titrasi dicapai yang ditandai dengan perubahan warna indikator. Titik akhir titrasi tidak selalu berimpit dengan titik ekuivalen . Dengan pemilihan indikator yang tepat, kita dapat memperkecil kesalahan titrasi.Jika suatu asam atau basa dititrasi, setia penambahan pereaksi akan mengakibatkan perubahan pH. Grafik yang diperoleh dengan menyalurkan pH terhadap volume pereaksi yang ditambahkan disebut kurva titrasi.Ada empat macam perhitungan jika suatu asam dititrasi dengan suatu basa.-Titik awal, sebelum penambahan basa.-Daerah antara (sebelum titik ekuivalen), larutan mengandung garam dan asam yang berlebih.-Titik ekuivalen, larutan mengandung garam.-Setelah titik ekuivalen, larutan mengandung garam dan basa berlebih.Dalam titrasi, suatu larutan yang harus dinetralkan dimasukkan ke dalam wadah atau tabung. Larutan lain yaitu basa, dimasukkan ke dalam buret lalu dimasukkan ke dalam asam, mula-mula cepat, kemudian tetes demi tetes, sampai titik setara dari titrasi tersebut tercapai. Salah satu usaha untuk mencapai titik setara dalam melalui perubahan warna dari indikator asam basa. Titik pada saat titrasi dimana indikator berubah warna dinamakan titik akhir (end point) dari indikator. Yang diperlukan adalah memadankan titik akhir indikator yang perubahannya terjadi dalam selang pH yang meliputi pH sesuai dengan titik setara.Indikator asam basa adalah asam lemah yang tak terionnya (Hln) mempunyai warna yang berbeda dengan warna anionnya. Jika sedikit indikator dimasukkan dalam larutan, larutan akan berubah warna menjadi warna (1) atau warna (2) tergantung pada apakah kesetimbangan bergerak ke arah bentuk asam atau anion. Arah pergeseran kesetimbangan dalam reaksi berikut tergantung pada [H3O+] atau dengan kata lain pada pH. Dengan persamaan reaksi sebagai berikut.
Hln + H2OH3O++ ln- Seorang analisis mengambil faedah dari perubahan besar dari pH yang terjadi dalam titrasi agar dapat menentukan kapan titik ekivalennya akan tercapai. Ada banyak asam dan basa organik dan basa organik lemah yang bentuk-bentuk tak berdisosiasi dan ionnya menunjukka wrana yang berbeda warna. Molekul-molekul demikian dapat digunakan untuk menentukan kapan cukup titran telah ditambahkan dan disebut indikator visual. Suatu contoh yang sederhana adalah para-nitrofenol, yang merupakan suatu asam lemah da berdisosiasi.Bentuk tak terdisosiasi adalah tak berwarna, tetapi anionnya, yang mempunyai sistem ikatan tunggal dan ikatan rangkap dua yang berganti-ganti (suatu system terkonjugasikan), berwarna kuning. Molekul-molekul atau ion-ion yang mempunyai system terkonjugasikan, menyerap cahaya dengan panjang gelombang yang lebih panjang dibandingkan dengan molekul-molekul sebanding tetapi yang tanpa system terkonjugasikan. Cahaya yang diserap sering ada pada bagian spectrum yang tampak, dan dengan demikian molekul atau ionnya berwarna.Indikator terkenal phenoftalein merupakan asam diprotik dan tak berwarna. Ia mula-mula berdisosiasi menjadi suatu bentuk tak berwarna dan kemudian, dengan kehilangan hidrogen ke dua, menjadi ion dengan system terkonjugasikan, maka dihasilakanlah wrana merah. Metal oranye, indikator lain yang secara luas digunakan, merupakan basa dan berwarna kuning dalam bentuk molekular. Penambahan ion hidrogen menghasilkan suatu kation yang berwarna merah muda.Perubahan minimum dalam pH yang diperlukan untuk suatu perubahan warna disebut jangkau indicator. Pada harga pH antara,warna yang ditunjukkan bukan warna merah atau kuning, tetapi sedikit agak kuning. Pada pH 5,pKadari HIn, kedua bentuk berwarna sama konsentrasinya, yaitu HIn separuh tenetralisasikan. Seringkali kita mendengar terminology seperti suatu indikator yang berubah warna pada pH 5 telah digunakan ini berarti bahwa pKaindicator sebesar 5 dan jangkauannya sebesar pH 4 sampai 6.Pada titrasi asam lemah, pemilihan indikator jauh lebih terbatas untuk suatu asam dengan pKa5 kira-kira kepunnyaan asma asetat, pH lebih tinggi dari 7 pada titik ekivalen, dan perubahan dalam pH relatif kecil. Phenoftalein berubah warna pada kira-kira titik ekivalen dan merupakan indicator yang cocok. Dalam hal asam yang sangat lemah, misalnya pKa= 9, tidak ada perubahan dalam pH yang besar terjadi sekitar titik ekivalen. Jadi volume basa yang lebih besar akan diperlukan untuk merubah warna suatu indikator dan titik ekivalen tidak akan di deteksi dengan ketepatan yang biasa diharapkan.Kelarutan garam dari asam lemah tergantung pada pH larutan. Beberapa contoh yang lebih penting dari garam-garam demikian dalam kimia analitik adalah oksilat sulfida, hidrogsida, karbonat dan fosfat. Ion hidroksida bereaksi dengan anion garam untuk membentuk asam lemah, dengan demikian meningkatkan kelarutan garam.Teori bonsted lowry melukiskan reaksi asam basa dalamperistiwa perpindahan proton, yaitu perbadingan kekuatan asam basa menentukan kearah mana reaksi asam basa akan terjadi., yaitu dari kombinasi asam basa yang lebih kuat ke yang lebih lemah. Teori lewis memnadang reaksi aram basa dari arah pembentukan ikatan kovalen antara zat penerima pasangn electron (asam) dengan pemberi (donor) electron (basa). Gunanya yang paling besar adalah dalam keadaan dimana reaksi terjadi tanpa kehadiran suatu pelarut atau pada saat suatu asam tidak mengandung atom hidrogen.Ada beberapa macam titrasi bergantung pada reaksinya.Salah satunya adalah titrasi asam basa. Titrasi adalah suatu metode untuk menentukan konsentrasi zat didalam larutan. Titrasi dilakukan dengan mereaksikan larutan tersebut dengan larutan yang sudah diketahui konsentrasinya. Reaksi dilakukan secara bertahap (tetes demi tetes) hingga tepat mencapai titik stoikiometri atau titik setara.Titik ekivalen pada titrasi asam basa adalah pada saat dimana sejumlah asam tepat di netralkan oleh sejumlah basa. Selama titrasi berlangsung terjadi perubahan pH. pH pada titik equivalen ditentukan oleh sejumlah garam yang dihasilkan dari netralisaasi asam basa. Indikator yang digunakan pada titrasi asam basa adalah yang memiliki rentang pH dimana titik equivalen berada. Pada umumnya titik equivalen tersebut sulit untuk diamati, yang mudah dimatai adalah titik akhir yaang dapat terjadi sebelum atau sesudah titik equivalen tercapai. Titrasi harus dihentikan pada saat titik akhir titrasi tercapai, yang ditandai dengan perubahan warna indikator. Titik akhir titrasi tidak selalu berimpit dengan titik equivalen. Dengan pemilihan indikator yang tepat, kita dapat memperkecil kesalahan titrasi.Pada titrasi asam kuat dan basa kuat, asam lemah dan basa lemah dalam air akan terurau dengan sempurna. Oleh karena itu ion hidrogen dan ion hidroksida selama titrasi dapat langsung dihitung dari jumlah asam atau basa yang ditambahkan. Pada titik equivalen dari titrasi asam air, yaitu sama dengan 7.Secara umum, asam memiliki sifat sebagai berikut:1.Rasa: masam ketika dilarutkan dalam air.2.Sentuhan: asam terasa menyengat bila disentuh, terutama bila asamnya asam kuat3.Kereaktifan: asam bereaksi hebat dengan kebanyakan logam, yaitu korosif terhadap logam4.Hantaran listrik: asam, walaupun tidak selalu ionik, merupakan elektrolit.5.mengubah lakmus biru menjadi merahSifat-sifat Basa :1.Kaustik2.Rasanya pahit3.Licin seperti sabun4.Nilai pH lebih dari sabun (>7)5.Mengubah warna lakmus merah menjadi biru6.Dapat menghantarkan arus listrik
VI.Alat dan BahanAlat-alat1.Statif dan klem2.Buret3.Gelas/labu Erlenmeyer 100ml (3buah)4.Gelas kimia 250ml (2buah)5.Pipet tetes6.Corong7.Gelas ukur
Bahan-bahan
1. Larutan NaOH 0,1M
2.Larutan HCl yang akan ditentukan konsentrasinya3. Kunyit4. Kertas Saring5. Larutan C2H2O46.Indikator Phenolptalein(PP)
VII.Alur KerjaA.Percobaan 1 Penentuan konsentrasi larutan NaOH denngan larutan C2H2O4 dengan menggunakan indicator Phenolptalein
NaOH
-Dimasukkan ke dalam buret degan menggunakan corong sampai melebihi skala nol
C2H2O4-Diturunkan larutan NaOH sampai tepat skala nol
Dipipet 10 mL menggunakan gelas ukur dan dimasukkan ke dalam Erlenmeyer Ditambahkan 2 tetes indicator Phenolptalein Diteteskan NaOH dari buret ke dalam Erlenmeyer Dicatat keadaan kolom dalam buret Ditunggu sampai terjadi perubahan warna menjadi pink Dicatat volume NaOH yang diperlukan yaitu selisih antara keadan akhir dan keadaan awal yang tertera pada buret WarnaUlangi percobaan minimal 3 kali dan dihitung konsentrasi larutan NaOH
B.Percobaan 2 Penentuan konsentrasi HCl dengan larutan NaOH dengan menggunakan indicator Phenolptalein
NaOH
-Dimasukkan ke dalam buret degan menggunakan corong sampai melebihi skala nol
HCl-Diturunkan larutan NaOH sampai tepat skala nol
Dipipet 10 mL menggunakan gelas ukur dan dimasukkan ke dalam Erlenmeyer Ditambahkan 2 tetes indicator Phenolptalein Diteteskan NaOH dari buret ke dalam Erlenmeyer Dicatat keadaan kolom dalam buret Ditunggu sampai terjadi perubahan warna menjadi pink Dicatat volume NaOH yang diperlukan yaitu selisih antara keadan akhir dan keadaan awal yang tertera pada buret WarnaUlangi percobaan minimal 3 kali dan dihitung konsentrasi larutan HCl
C. Percobaan 3 Penentuan konsentrasi HCl dengan larutan NaOH dengan menggunakan indicator ekstrak tumbuhan(kunyit)
NaOH
-Dimasukkan ke dalam buret degan menggunakan corong sampai melebihi skala nol
HCl-Diturunkan larutan NaOH sampai tepat skala nol
Dipipet 10 mL menggunakan gelas ukur dan dimasukkan ke dalam Erlenmeyer Ditambahkan 2 tetes indicator ekstrak kunyit Diteteskan NaOH dari buret ke dalam Erlenmeyer Dicatat keadaan kolom dalam buret Ditunggu sampai terjadi perubahan warna menjadi orange muda Dicatat volume NaOH yang diperlukan yaitu selisih antara keadan akhir dan keadaan awal yang tertera pada buret WarnaUlangi percobaan minimal 3 kali dan dihitung konsentrasi larutan HCl
VIII.Hasil Pengamatan
NOHasil PengamatanDugaan/ReaksiKesimpulan
SebelumSesudah
1.NaOH:Larutan jernih tak berwarnaC2H2O4: Larutan jernih tak berwarnaV. C2H2O4:10 mL,0,1 MC2H2O4+ PP: Larutan jernih tak berwarnaC2H2O4+ PP+ NaOH: pink(+)V1:10,8 mLV2:10,7 mLV3:10,5 mL
2NaOH(aq)+C2H2O4(aq) Na2C2O4(aq) +2H2O(l)-Konsentrasi NaOH yang didapat 0.093M
-Titik akhir titrasi terjadi pada volume 10,67 mL
2.NaOH:Larutan jernih tak berwarnaHCl: Larutan jernih tak berwarnaHCl+PP: Larutan jernih tak berwarnaHCl+PP+ NaOH: pink(+)V1:11 mLV2:10,7 mLV3:10,5 mL
NaOH (aq)+HCl(aq) NaCl(aq)+H2O(l)-Konsentrasi HCl yang didapat 0.0998M
-Titik akhir titrasi terjadi pada volume 10,73 mL
3.Kunyit:kuningKunyit+5 tetes etanol:kuningNaOH:Larutan jernih tak berwarnaHCl: Larutan jernih tak berwarna
HCl+ekstrak kunyit:kuningHCl+ekstrak kunyit+NaOH:Orange mudaV1:14 mLV2:13 mLV3:12 mL
NaOH (aq)+HCl(aq) NaCl(aq)+H2O(l)-Konsentrasi HCl yang didapat 0.1209 M
-Titik akhir titrasi terjadi pada volume 13 mL
IX.Analisis Data1. Penentuan Konsentrasi Larutan NaOH dengan Larutan C2H2O4 dengan menggunakan indicator phenolptalein. Dari percobaan diatas pada awalnya larutan C2H2O4 jernih,tak berwarna.Setelah penambahan 2 tetes indicator phenoptalein tidak terjadi perubahan warna pada larutan tersebut.Kemudian larutan C2H2O4 + 2 tetes indicator phenoptalein dititrasi dengan larutan NaOH dan diperoleh hasil titrasi yang berupa perubahan warna menjadi berwarna pink (+) pada larutan C2H2O4.Dan diperoleh reaksi sebagai berikut : 2NaOH(aq)+ C2H2O4(aq) Na2C2O4 (aq) + 2H2O(l)Percobaan tersebut dilakukan sebanyak 3 kali, dengan volume C2H2O4 10 mL dan normalitas (N) C2H2O4 0,1 N, Volume akhir titrasi pada percobaan 1, 2,3 sebanyak 10,8 mL, 10,7 mL, 10,5 mL.2. Penentuan Konsentrasi Larutan HCl dengan Larutan NaOH dengan menggunakan Indikator PhenolptaleinDari percobaan diatas, pada awalnya larutan HCl jernih,tak berwarna. Setelah penambahan 2 tetes indicator phenoptalein tidak terjadi perubahan warna pada larutan tersebut.Kemudian larutan HCl + 2 tetes indicator phenoptalein dititrasi dengan larutan NaOH dan diperoleh hasil titrasi berupa perubahan warna menjadi pink (+). Dan diperoleh reaksi sebagai berikut :HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)Percobaan tersebut dilakukan sebanyak 3 kali, volume HCl 10 mL dan normalitas (N) NaOH 0,093 N.Volume akhir titrasi pada percobaan 1, 2,3 sebanyak 11 mL , 10,7 mL, 10,5 mL . 3. Penentuan Konsentrasi Larutan HCl dengan Larutan NaOH dengan Menggunakan Indikator Ekstrak KunyitDari percobaan diatas, pada awalnya larutan HCl jernih,tak berwarna. Setelah penambahan 2 tetes indikator alami yang terbuat dari ekstrak kunyit terjadi perubahan warna yaitu menjadi berwarna kuning pada larutan tersebut. Setelah larutan HCl + 2 tetes indikator alami dititrasi dengan larutan NaOH, dan diperoleh hasil titrasi berupa perubahan warna larutan menjadi orange muda.Dan diperoleh reaksi sebagai berikut : HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)Percobaan tersebut dilakukan sebanyak 3 kali, volume HCl 10 mL dan normalitas (N) NaOH 0,093 N.Volume akhir titrasi pada percobaan 1, 2,3 sebanyak 14 mL,13mL,12mL. X.PembahasanPada percobaan titrasi asam basa yang telah dilakukan,diperoleh data seperti diatas. Percobaan titrasi asam basa yang pertama antara larutan asam oksalat (C2H2O4) yang diletakkan di dalam tabung Erlenmeyer + 2 tetes indicator phenolptalein (PP) dengan larutan NaOH yang ada di dalam buret. Pada saat pencampuran dilakukan dengan cara meneteskan tetes demi tetes larutan NaOH yang belum diketahui konsentrasinya kedalam larutan asam oksalat (C2H2O4) di tabung Erlenmeyer yang telah ditambah indicator phenolptalein (PP), terjadi perubahan warna dari tak berwarna (jernih) menjadi berwarna pink (+) yang menunjukkan bahwa larutan C2H2O4 telah bereaksi dengan NaOH dan menghasilkan senyawa Na2C2O4 dengan pH netral berdasarkan reaksi : 2NaOH(aq)+ C2H2O4(aq)Na2C2O4(aq) + H2O (l)Diperoleh rata-rata konsentrasi NaOH 0,093 M. Indikator phenoptalein merupakan indikator basa, sehingga pada titik akhir titrasi indikator akan bekerja yang ditandai dengan adanya perubahan warna pada hasil titrasi. Titik akhir terjadi pada volume 10,67 mL.
Pada percobaan kedua antara larutan NaOH yang ada di dalam buret dengan larutan HCl yang ada di dalam tabung Erlenmeyer + 2 tetes indikator phenolptalein (PP), terjadi perubahan warna yang sama yaitu dari larutan tak berwarna (jernih) menjadi berwarna pink(+). Hal ini terjadi karena pada saat diteteskan larutan NaOH dari dalam buret kedalam tabung Erlenmeyer dengan isi larutan HCl, terjadi reaksi antara keduanya hingga terbentuk larutan dengan PH netral yang ditunjukkan dengan terjadinya perubahan warna. Persamaan reaksi yang terjadi adalah :HCl(aq) + NaOH(aq)NaCl(aq) + H2O (l)Diperoleh rata-rata konsentrasi NaOH 0,0998 M. Indikator phenoptalein merupakan indikator basa, sehingga pada titik akhir titrasi indikator akan bekerja yang ditandai dengan adanya perubahan warna pada hasil titrasi. Titik akhir terjadi pada volume 10,73 mL.Pada percobaan yang ketiga, melibatkan larutan NaOH dengan HCl yang telah diketahui konsentrasinya, tetapi pada percobaan ini, digunakan indikator ekstrak tumbuhan yaitu ekstrak kunyit.Ekstrak kunyit berwarna kuning.Pada saat dilakukan titrasi dengan meneteskan NaOH tetes demi tetes kedalam larutan HCl yang ada dalam tabung Erlenmeyer, terjadi perubahan warna dari berwarna kuning menjadi orange muda. Hal ini dikarenakan telah terjadi reaksi antara larutan NaOH dan larutan HCl sehingga pH larutan berubah menjadi netral yang ditunjukkan dengan terjadinya perubahan warna diatas. Persamaan reaksinya adalah :HCl(aq) + NaOH(aq)NaCl(aq) + H2O (l)
Titik akhir titrasi ditandai dengan perubahan warna hasil titrasi menjadi orange muda yaitu pada volume 13mL. Indikator asam-basa dari kunyit,akan memberikan warna coklat ketika dilarutkan dalam larutan asam ,memberikan warna jingga didalam larutan basa dan memberikan warna kuning terang pada larutannetral.Kunyit dapat dijadikan indikator alami titrasi asam basa karena prinsip indicator adalah bahan yang memberikan warna berbeda pada lingkungan asam dan basa.Kunyit merupakan bahan yang memiliki warna mencolok, sehingga dapat digunakan sebagai indikator titrasi asam basa.
XI.KesimpulanBerdasarkan hasil percobaan titrasi asam basa yang telah dilakukan, dapat ditarik beberapa kesimpulan sebagai berikut:1. Dengan menggunakan perhitungan N1.V1=N2.V2 didapatkan Normalitas larutan NaOH dengan larutan C2H2O4 0,1 N sebesar 0,093 N. Sedangkan molaritas didapatkan konsentrasi sebesar 0,093 M.2. Percobaan kedua, dengan perhitungan yang sama menggunakan indicator phenolptalein didapatkan Normalitas larutan HCl dengan larutan NaOH 0,093 N sebesar 0,0998N dan molaritas kosentrasinya sebesar 0,0998 M.3. Percobaan ketiga, dengan perhitungan yang sama dengan menggunakan indikator yang berbeda yakni ekstrak kunyit didapatkan Normalitas konsentrasi HCl sebesar 0,1209 N dan molaritas konsentrasinya sebesar 0,1209 M.4. Adanya perubahan warna pada larutan asam oksalat dan asam klorida saat dititrasi dengan NaOH disebabkan oleh terjadinya perubahan pH dalam larutan karena adanya indikator phenolptalein dalam larutan sehingga terjadilah perubahan warna merah muda (+) saat pH larutan di titik akhir.5. Untuk indikator ekstrak tumbuhan (yang dalam percobaan ini menggunakan kunyit), sebelum dititrasi warna larutan adalah kuning yang kemudian saat dititrasi berubah warna menjadi orange muda.
XII.JawabanPertanyaan1. Mengapa pada titrasi larutan NaOH dengan asam oksalat menggunakan indicator phenolptalein?Karena indicator Phenolftalein memiliki trayek pH antara 8.3 10.0 dan merupakan indikator yang paling cocok untuk titrasi asam lemah (asam oksalat) oleh basa kuat (NaOH). Perubahan warna PP pada trayek pH 8.3 10.0 tersebut memudahkan untuk mengindikasi apakah larutan tersebut telah netral dan bereaksi.2. Apa perbedaan titik ekivalen dengan titik akhir? Titik ekuivalen adalah kondisi pada saat larutan asam tepat bereaksi dengan larutan basa. Titik akhir titrasi adalah kondisi pada saat terjadi perubahan warna dari indikator.3. Pada larutan di atas, mana yang berfungsi sebagai larutan baku primer, larutan baku sekunder dan larutan baku tersier? Larutan baku primer adalah larutan yang telah diketahui konsentrasinya dari awal yakni asam oksalat( C2H2O4). Larutan baku sekunder adalah larutan yang telah diketahui konsentrasinya berdasarkan percobaan yang sebelumnya telah dilakukan. Dan yang bertindak sebagai larutan baku sekunder adalah Natrium Hidroksida (NaOH) Karena larutan tersebut telah di ketahui konsentrasinya setelah percobaan awal dilakukan. Larutan baku tersier adalah Asam Klorida ( HCl )XIII.Daftar PustakaBrady,J.E.1999.Kimia Universitas Asas dan Struktur.Jakarta:Binarupa AksaraPetrucci,R.H.1985.Kimia Dasar Prinsip dan Terapan Modern.Jakarta:ErlanggaTim Kimia Dasar.2013.Petunjuk Praktikum Kimia Umum.Universitas Negeri Surabaya: Surabaya
Lampiran :Percobaan 1 : hasil titrasi 3hasil titrasi 1 dan 2
perbandingan ketiga hasil titrasi Percobaan 2 :hasil titrasi 1hasil titrasi 2hasil titrasi 3 volume titrasi perbandingan hasil titrasi ketiganya
Percobaan 3 : hasil titrasi 1 hasil titrasi 2hasil titrasi 3
Perhitungan : Percobaan 1 :1. V NaOH= 10,8 mlV C2H2O4 = 10 ml V1.N1 = V2.N210.0,1 = 10,8.N21 = 10,8 N2N2 = 0,092 NN = M.eM = = = 0,092 M Konsentrasi NaOH 12. V NaOH= 10,7 mlV C2H2O4 = 10 ml V1.N1 = V2.N210.0,1 = 10,7.N21 = 10,7 N2N2 = 0,093 NN = M.eM = = = 0,093 M Konsentrasi NaOH 23. V NaOH = 10,5 ml V C2H2O4 = 10 ml V1.N1 = V2.N210.0,1 = 10,5.N21 = 10,5 N2N2 = 0,095 NN = M.eM = = = 0,095 M Konsentrasi NaOH 3 Rata-rata M NaOH = = =0,093 M
Percobaan 2 :1. V NaOH = 11 mlV HCl = 10 ml V1.N1 = V2.N210. N1= 11.0,09310 = 1,023N1N1 = 0,1023 NN = M.eM = = = 0,1023 M Konsentrasi HCl 12. V NaOH= 10,7 ml V HCl = 10 ml V1.N1 = V2.N210.N1= 10,7.0,09310 = 0,9951 N1N1 = 0,09951 NN = M.eM = = = 0,09951 M Konsentrasi HCl 23. V NaOH = 10,5mlV HCl = 10 ml V1.N1 = V2.N210. N1= 10,5.0,09310 = 0,976N1N1 = 0,0976NN = M.eM = = = 0,0976M Konsentrasi HCl 3 Rata-rata M HCl = = =0,0998 M
Percobaan 3 :1. V NaOH = 14 mlV HCl = 10 ml V1.N1 = V2.N210. N1=14.0,09310 = 1,302 N1N1 = 0,1302 NN = M.eM = = = 0,1302 M Konsentrasi HCl 12. V NaOH= 13mlV1.N1 = V2.N210.N1= 13.0,09310 = 1,209 N1N1 = 0,1209 NN = M.eM = = = 0,1209 M Konsentrasi HCl 23. V NaOH = 12 mlV1.N1 = V2.N210. N1=12.0,09310 = 1,116 N1N1 = 0,1116 NN = M.eM = = = 0,1116 M Konsentrasi HCl 3 Rata-rata M HCl = = 0,1209 M