TABEL PERIODIK UNSUR - · PDF fileTuliskan tujuan praktikum yang akan ... II. PRINSIP Tuliskan...
Transcript of TABEL PERIODIK UNSUR - · PDF fileTuliskan tujuan praktikum yang akan ... II. PRINSIP Tuliskan...

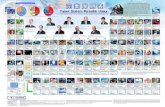
TABEL PERIODIK UNSUR

2
PERCOBAAN I
ANALISIS KUALITATIF SENYAWA KATION GOLONGAN I
A. Latar Belakang Masalah
Kation adalah ion yang bermuatan positif. Ion satu dengan lainnya
dapat dibedakan karena tiap ion mempunyai reaksi kimia spesifik. Kation
merupakan penyusun suatu senyawa, sehingga untuk menentukan jenis
zat atau senyawa tunggal secara sederhana dapat dilakukan dengan
menganalisis jenis kation yang dikandungnya.
Reagensia golongan yang dipakai untuk klasifikasi kation yang
paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida,
dan ammonium karbonat. Klasifikasi ini didasarkan atas apakah suatu
kation bereaksi dengan reagensia-reagensia ini dengan membentuk
endapan atau tidak. Jadi boleh dikatakan, bahwa klasifikasi kation yang
paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida,
dan karbonat dari kation tersebut.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu melakukan metode analisis kation
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menjelaskan ciri-ciri dari Kation Golongan I
2. Mahasiswa dapat mengetahui kation apa saja yang termasuk ke
dalam Kation Golongan I
3. Mahasiswa mengetahui pereaksi apa saja yang dapat digunakan
untuk mengidentifikasi Kation Golongan I
D. Uraian Materi
Kation Golongan I membentuk endapan dengan asam klorida
encer. Ion-ion golongan ini antara lain: (1) Timbel, Pb2+. Timbel

3
merupakan logam yang berwarna abu-abu kebiruan, dengan rapatan
yang tinggi (11,48 g/ml pada suhu kamar); (2) Merkurium (I), Hg+.
Merkurium adalah logam cair yang putih keperakan pada suhu biasa,
dan mempunyai rapatan 13,534 g/ml pada 25 °C. Merkurium tidak
dipengaruhi asam klorida atau asam sulfat encer (2M), tetapi mudah
bereaksi dengan asam nitrat; (3) Perak, Ag+. Perak adalah logam yang
putih, dapat ditempa dan liat. Rapatannya tinggi (10,5 g/ml) dan ia
melebur pada 960,5 °C. Perak tidak larut dalam asam klorida, asam
sulfat encer (1M) atau asam nitrat encer (2M).
Kation Golongan I, membentuk klorida-klorida yang tidak larut.
Namun, timbel klorida sedikit larut dalam air, dan karena itu timbel tidak
pernah mengendap dengan sempurna bila ditambahkan asam klorida
encer kepada suatu cuplikan; ion timbel yang tersisa itu, diendapkan
secara kuantitatif dengan hidrogen sulfida dalam suasana asam
bersama-sama kation golongan kedua.
Nitrat dari kation-kation ini sangat mudah larut. Diantara sulfat-
sulfat, timbel sulfat praktis tidak larut, sedang perak sulfat larut jauh lebih
banyak. Kelarutan merkurium (I) sulfat terletak diantara kedua zat diatas.
Bromida dan iodida juga tidak larut, sedangkan pengendapan timbel
halida tidak sempurna, dan endapan itu mudah sekali melarut dalam air
panas. Sulfida tidak larut. Asetat-asetat lebih mudah larut, meskipun
perak asetat dapat mengendap dari larutan yang agak pekat. Hidroksida
dan karbonat akan diendapkan dengan reagensia yang jumlahnya
ekuivalen, tetapi kalau reagensia berlebihan, ia dapat bertindak dengan
bermacam-macam cara. Juga ada perbedaan dalam sifat zat-zat ini
terhadap amonia.

4
Tabulasi Kation Golongan I
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation

5
E. Alat & Bahan
Alat yang digunakan adalah tabung reaksi, pipet tetes, labu ukur
100 mL, gelas beaker 50 mL.
Bahan yang digunakan adalah Ag+, Hg2+, Pb2+, HCl, amonia,
NaOH, KI, K2CrO4, H2SO4 2 M, alkohol
F. Prosedur Kerja
a. Analisis terhadap ion Ag+
1. Larutan sampel + asam klorida P endapan putih (mudah larut
dalam amonium hidroksida 6 N, tidak larut dalam asam nitrat P).
2. Larutan sampel + 1 tetes amonia endapan putih yang cepat
berubah menjadi coklat.
3. Larutan sampel + NaOH 6 N dan sedikit formaldehida LP,
hangatkan cermin logam perak pada dinding tabung.
4. Larutan sampel + larutan kalium kromat P endapan merah
(larut dalam asam nitrat P)
5. Larutan sampel + larutan KI endapan kuning (praktis tidak
larut dalam amonia, larut dalam natrium thiosulfat).
b. Analisis terhadap ion Hg+
1. Larutan sampel + larutan NaOH 1 N endapan hitam
2. Larutan sampel + asam klorida P endapan putih, amonium
hidroksida 6 N menjadi hitam.
3. Larutan sampel + larutan KIP endapan kuning, diamkan
menjadi hijau.
4. Larutan sampel + larutan natrium karbonat endapan kuning
yang kemudian berubah menjadi abu-abu.
5. Larutan sampel + larutan kalium kromat netral, panaskan endapan
merah.

6
c. Analisis terhadap ion Pb2+
1. Larutan sampel + H2SO4 2 M dan alkohol setetes akan terbentuk
endapan putih (PbSO4).
2. Larutan sampel + KI 0,5 N 2 tetes terbentuk endapan kuning PbI2
yang larut dalam air panas dan bila didinginkan akan terbentuk
kristal kuning emas.
G. Soal
1. Jelaskan ciri-ciri dari Kation Golongan I !
2. Kation apa saja yang termasuk ke dalam Kation Golongan I?
Sebutkan dan jelaskan!
3. Pereaksi apa saja yang dapat digunakan untuk mengidentifikasi
Kation Golongan I? serta tuliskan dan jelaskan hasil reaksinya!
H. Pustaka
Vogel, A.I. 1989. The Textbook of Quantitative Chemical Analysis, 5th Ed. Longman.

7
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. PROSEDUR
Tuliskan dalam bentuk diagram alir
IV. DATA PENGAMATAN
No. Larutan
pereaksi
Hasil
reaksi
Prediksi
sampel
Pereaksi
spesifik
Kesimpulan

8
PERCOBAAN II
ANALISIS KUALITATIF SENYAWA KATION GOLONGAN II
A. Latar Belakang Masalah
Kation adalah ion yang bermuatan positif. Ion satu dengan lainnya
dapat dibedakan karena tiap ion mempunyai reaksi kimia spesifik. Kation
merupakan penyusun suatu senyawa, sehingga untuk menentukan jenis
zat atau senyawa tunggal secara sederhana dapat dilakukan dengan
menganalisis jenis kation yang dikandungnya.
Reagensia golongan yang dipakai untuk klasifikasi kation yang
paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida,
dan ammonium karbonat. Klasifikasi ini didasarkan atas apakah suatu
kation bereaksi dengan reagensia-reagensia ini dengan membentuk
endapan atau tidak. Jadi boleh dikatakan, bahwa klasifikasi kation yang
paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida,
dan karbonat dari kation tersebut.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu melakukan metode analisis kation
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menjelaskan ciri-ciri dari Kation Golongan II.
2. Mahasiswa dapat mengetahui kation apa saja yang termasuk ke
dalam Kation Golongan II.
3. Mahasiswa mengetahui pereaksi apa saja yang dapat digunakan
untuk mengidentifikasi Kation Golongan II.
D. Uraian Materi
Kation Golongan II dibagi menjadi dua sub-golongan yaitu sub-
golongan tembaga (IIa) dan sub-golongan arsenik (IIb). Dasar dari
pembagian ini adalah kelarutan endapan sulfida dalam amonium

9
polisulfida. Sementara sulfida dari sub-golongan tembaga tidak larut
dalam reagensia ini, sulfida dari sub-grup arsenik melarut dengan
membentuk garam tio.
Sub-golongan tembaga terdiri dari: (1) Merkurium (II), Hg2+.
Merkurium adalah logam cair yang putih keperakan pada suhu biasa,
dan mempunyai rapatan 13,534 g/ml pada 25 °C. Merkurium tidak
dipengaruhi asam klorida atau asam sulfat encer (2M), tetapi mudah
bereaksi dengan asam nitrat; (2) Timbel (II), Pb2+. Timbel merupakan
logam yang berwarna abu-abu kebiruan, dengan rapatan yang tinggi
(11,48 g/ml pada suhu kamar); (3) Bismut (III), Bi3+. Bismut adalah
logam putih kemerahan, kristalin, dan getas. Titik leburnya 271,5 °C.
Bismut tidak larut dalam asam klorida disebabkan oleh potensial
standarnya (0,2 V), tetapi melarut dalam asam pengoksid seperti asam
nitrat pekat, air raja atau asam sulfat pekat panas; (4) Tembaga (II),
Cu2+. Tembaga adalah logam merah muda, yang lunak, dapat ditempa
dan liat. Ia melebur pada 1038 °C. Karena potensial elektroda standar
positifnya (+0,34 V untuk pasangan Cu/Cu2+), ia tak larut dalam asam
klorida dan asam sulfat encer, meskipun dengan adanya oksigen ia bisa
larut sedikit; (5) Kadmium (II), Cd2+. Kadmium adalah logam putih
keperakan, yang dapat ditempa dan liat. Ia melebur pada 321 °C. Ia
melarut dengan lambat dalam asam encer dengan melepaskan hidrogen.
Sub-golongan arsenik terdiri dari: (1) Arsenik (III), As3+ ; Arsenik
(V), As5+. Arsenik merupakan zat padat yang berwarna abu-abu seperti
baja, getas dan memiliki kilap logam. Jika dipanaskan, arsenik
bersublimasi dan timbul bau seperti bawang putih yang khas; (2)
Stibium (III), Sb3+ ; Stibium (V), Sb5+. Stibium adalah logam putih
keperakan yang mengkilap, dan melebur pada 630 °C. Stibium tak larut
dalam asam klorida dan dalam asam sulfat encer; (3) Timah (II), Sn2+ ;
Timah (IV), Sn4+. Timah adalah logam putih perak, yang dapat ditempa
dan liat pada suhu biasa, tetapi pada suhu rendah berubah menjadi
getas karena berubah menjadi suatu modifikasi alotropi yang berlainan.

10
Timah meleleh pada 231,8 °C. Ion-ion ini mempunyai sifat amfoter:
oksidanya membentuk garam baik dengan asam maupun dengan basa.
Jadi, arsenik (III) oksida dapat dilarutkan dalam asam klorida (6 M), dan
terbentuk kation arsenik (III).
Kation Golongan II tidak bereaksi dengan asam klorida, tetapi
membentuk endapan dengan hidrogen sulfida dalam suasana asam
mineral encer. Meskipun bagian terbesar ion timbel (II) diendapkan
dengan asam klorida encer bersama ion-ion lain dari Golongan I,
pengendapan ini agak kurang sempurna, disebabkan oleh kelarutan
timbel (II) klorida yang relatif tinggi. Maka dalam pengerjaan analisis
sistematik, ion-ion timbel masih akan tetap ada, ketika bertugas
mengendapkan golongan kation kedua.
Reaksi Golongan II menghasilkan endapan-endapan dengan
berbagai warna: merkurium (II) sulfida, HgS (hitam); timbel (II) sulfida,
PbS (hitam); tembaga (II) sulfida, CuS (hitam); kadmium sulfida, CdS
(kuning); bismut (III) sulfida, Bi2S3 (coklat); arsenik (III) sulfida, As2S3
(kuning); arsenik (V) sulfida (kuning); stibium (III) sulfida, Sb2S3 (jingga);
stibium (V) sulfida, Sb2S5 (jingga); timah (II) sulfida, SnS (coklat); dan
timah (IV) sulfida, SnS2 (kuning).

11
Tabulasi Kation Golongan II A
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation

12
Tabulasi Kation Golongan II B
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation

13
E. Alat & Bahan
Alat yang digunakan adalah tabung reaksi, pipet tetes, labu ukur
100 mL, gelas beaker 50 mL.
Bahan yang digunakan adalah Hg2+, Cu2+, Pb2+, Bi3+, Cd2+, As3+,
Sb3+, HCl, amonia, NaOH, KI, K2CrO4, kalium ferrosianida, NH4-Ac, H2O2
3%, NH4OH 6 M, pereaksi benzidin asetat, pereaksi cinchonin-NO3,
kertas rhodamin, KCl, Na-asetat, Na2S2O2.
F. Prosedur Kerja
a. Analisis terhadap ion Hg2+
1. Larutan sampel + larutan NaOH 1 N endapan kuning.
2. Larutan netral sampel + larutan KIP endapan merah tua
(sangat mudah larut dalam pereaksi berlebih).
3. Larutan sampel + larutan natrium karbonat endapan coklat
merah, didihkan menjadi kuning.
4. Kedalam larutan sampel dicelupkan logam Cu atau Fe
endapan abu-abu.
5. Larutan sampel + larutan kalium kromat netral endapan kuning,
panaskan menjadi merah.
b. Analisis terhadap ion Cu2+
1. Larutan sampel diasamkan dengan HCl P lapisan tipis merah
logam tembaga pada permukaan logam besi yang mengkilap.
2. Larutan sampel + larutan NaOH endapan biru, panaskan
menjadi merah bata.
3. Larutan sampel + sedikit amonia endapan hijau, + amonia
berlebih larut dan larutannya berwarna biru intensif.
4. Larutan sampel + larutan kalium ferrosianida endapan merah
coklat (larut dalam amonia dan larutannya berwarna biru).
5. Larutan sampel + larutan KI endapan putih dan
larutannya agak kuning.

14
c. Analisis terhadap ion Pb2+
1. Sampel larutan + 1 ml NH4-Ac + 2 tetes larutan K2CrO4 terbentuk
endapan kuning.
2. Sampel larutan + 1 ml H2O2 3% + 1 ml NH4OH 6 M kemudian
sentrifus. Filtrat ditambahkan pereaksi benzidin asetat terbentuk
warna biru.
d. Analisis terhadap ion Bi3+
1. Sampel larutan ditambahkan 1 ml pereaksi cinchonin-NO3 1 tetes
dan KI 1 tetes terbentuk endapan jingga.
2. Celupkan kawat tembaga pada larutan, tunggu beberapa menit
akan terbentuk amalgam yang tahan pemanasan.
3. Teteskan sampel larutan pada kertas rhodamin akan terbentuk
noda jingga.
e. Analisis terhadap ion Cd2+
1. Sampel larutan tambahkan air-H2S akan terbentuk endapan
kuning.
2. Larutan sampel + larutan KCl akan terjadi endapan putih. Bila
ditambahkan pereaksi berlebih akan larut kembali kemudian bila
ditambahkan air-H2S akan terbentuk endapan berwarna kuning.
f. Analisis terhadap ion As3+
1. Sampel larutan + pereaksi Gutzeit (bubuk Al dan 10 tetes KOH 6
M). Pada mulut tabung masukkan kapas yang dibasahi dengan Pb
asetat kemudian tutup dengan kertas yang dibasahi dengan HgCl2
atau larutan AgNO3 maka akan terbentuk noda jingga coklat atau
hitam.
2. Sampel larutan + H2O2 1 tetes kemudian panaskan. Tambahkan
HNO3 2 M 1 tetes dan NH4-Molibdat akan terjadi endapan putih.

15
g. Analisis terhadap ion Sb3+
1. Sampel larutan + pereaksi rhodamin + hablur KNO2 akan terbentuk
warna merah ungu.
2. Sampel larutan + Na-asetat + Na2S2O2 kemudian panaskan maka
akan terjadi warna merah.
G. Soal
1. Jelaskan ciri-ciri dari Kation Golongan II !
2. Kation apa saja yang termasuk ke dalam Kation Golongan II?
Sebutkan dan jelaskan!
3. Pereaksi apa saja yang dapat digunakan untuk mengidentifikasi
Kation Golongan II? serta tuliskan dan jelaskan hasil reaksinya!
H. Pustaka
Vogel, A.I. 1989. The Textbook of Quantitative Chemical Analysis, 5th Ed. Longman.

16
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. PROSEDUR
Tuliskan dalam bentuk diagram alir
IV. DATA PENGAMATAN
No. Larutan
pereaksi
Hasil
reaksi
Prediksi
sampel
Pereaksi
spesifik
Kesimpulan

17
PERCOBAAN III
ANALISIS KUALITATIF SENYAWA KATION GOLONGAN III
A. Latar Belakang Masalah
Kation adalah ion yang bermuatan positif. Ion satu dengan lainnya
dapat dibedakan karena tiap ion mempunyai reaksi kimia spesifik. Kation
merupakan penyusun suatu senyawa, sehingga untuk menentukan jenis
zat atau senyawa tunggal secara sederhana dapat dilakukan dengan
menganalisis jenis kation yang dikandungnya.
Reagensia golongan yang dipakai untuk klasifikasi kation yang
paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida,
dan ammonium karbonat. Klasifikasi ini didasarkan atas apakah suatu
kation bereaksi dengan reagensia-reagensia ini dengan membentuk
endapan atau tidak. Jadi boleh dikatakan, bahwa klasifikasi kation yang
paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida,
dan karbonat dari kation tersebut.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu melakukan metode analisis kation
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menjelaskan ciri-ciri dari Kation Golongan III.
2. Mahasiswa dapat mengetahui kation apa saja yang termasuk ke
dalam Kation Golongan III.
3. Mahasiswa mengetahui pereaksi apa saja yang dapat digunakan
untuk mengidentifikasi Kation Golongan III.
D. Uraian Materi
Kation Golongan III dibagi menjadi sub-golongan besi (IIIA) dan
sub-golongan zInk (IIIB). Sub-golongan besi terdiri dari: (1) Besi (II), Fe2+
; Besi (III), Fe3+. Besi yang murni adalah logam berwarna putih-perak,

18
yang kukuh dan liat, serta melebur pada suhu 1535 °C. Asam klorida
encer atau pekat dan asam sulfat encer dapat melarutkan besi; (2)
Aluminium, Al3+. Aluminium merupakan logam putih yang liat dan dapat
ditempa, bubuknya berwarna abu-abu. Aluminium melebur pada 659 °C;
(3) Kromium (III), Cr3+. Kromium adalah logam kristalin yang putih, tak
begitu liat dan dapat ditempa dengan berarti. Kromiun melebur pada
1765 °C. Logam ini larut dalam asam klorida encer atau pekat.
Sedangkan sub-golongan zink terdiri dari: (1) Nikel (II), Ni2+. Nikel
merupakan logam putih perak yang keras. Nikel bersifat liat, dapat
ditempa dan sangat kukuh. Logam ini melebur pada 1455 °C, dan
bersifat sedikit magnetis; (2) Kobalt (II), Co2+. Kobalt adalah logam
berwarna abu-abu seperti baja, dan bersifat sedikit magnetis. Kobalt
melebur pada suhu 1490 °C; (3) Mangan (II), Mn2+. Mangan adalah
logam putih abu-abu yang penampilannya serupa besi-tulang. Mangan
melebur pada suhu kira-kira 1250 °C; (4) Zink, Zn2+. Zink merupakan
logam yang putih-kebiruan. Logam ini cukup mudah ditempa dan liat
pada suhu 110-150 °C. Zink melebur pada 410 °C dan mendidih pada
906 °C.
Kation Golongan III tidak bereaksi dengan asam klorida encer,
ataupun dengan hidrogen sulfida dalam suasana asam mineral encer.
Namun, kation ini membentuk endapan dengan amonium sulfida dalam
suasana netral atau amoniak. Logam-logam ini diendapkan sebagai
sulfida, kecuali aluminium dan kromium, yang diendapkan sebagai
hidroksida, karena hidrolisis yang sempurna dari sulfida dalam larutan
air. Besi, aluminium, dan kromium (sering disertai sedikit mangan) juga
diendapkan sebagai hidroksida oleh larutan amonia dengan adanya
amonium klorida, sedang logam-logam lain dari golongan ini tetap
berada dalam larutan dan dapat diendapkan sebagai sulfida oleh
hidrogen sulfida.
Reaksi Kation Golongan III menghasilkan endapan-endapan
dengan berbagai warna: besi (II) sulfida (hitam), aluminium hidroksida

19
(putih), kromium (III) hidroksida (hijau), nikel sulfida (hitam), kobalt sulfida
(hitam), mangan (II) sulfida (merah jambu), dan zink sulfida (putih).
Tabulasi Kation Golongan III A

20
Tabulasi Kation Golongan III B
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation

21
E. Alat & Bahan
Alat yang digunakan adalah tabung reaksi, pipet tetes, labu ukur
100 mL, gelas beaker 50 mL.
Bahan yang digunakan adalah Al3+, Fe3+, Zn2+, Co2+, Ni2+, Cr3+,
Mn3+, HCl, amonia, NaOH, KI, K2CrO4, K4Fe(CN)6, KNO2, nitroso β
naftol, NH4OH, dimetil glioksim, asam asetat, Pb asetat, H2O2 3%, metil
isobutil keton, HNO3, sebutir Na-bismutat, pereaksi benzidin.
F. Prosedur Kerja
a. Analisis terhadap ion Al3+
1. Larutan sampel + larutan amonia endapan koloidal.
2. Larutan sampel + larutan natrium karbonat endapan putih (larut
dalam pereaksi berlebih).
3. Larutan sampel + larutan natrium fosfat endapan putih
koloidal.
4. Larutan sampel + larutan KOH endapan putih (larut dalam
pereaksi KOH berlebih).
5. Larutan sampel didalam drupelplat + larutan NaOH hingga timbul
endapan putih, + pereaksi alizarin-s warna ungu, + asam
asetat sampai warna ungu tepat hilang + 1 tetes asam asetat
endapan merah.
b. Analisis terhadap ion Fe3+
1. Larutan sampel + larutan NaOH endapan coklat (larut
dalam asam)
2. Larutan sampel + larutan kalium ferrosianida endapan biru.
3. Larutan sampel + larutan kalium asetat coklat, panaskan
endapan.
4. Larutan sampel + larutan natrium fosfat endapan putih
kekuningan (tidak larut dalam asam asetat).
5. Larutan sampel + KSCN warna merah bata.

22
c. Analisis terhadap ion Zn2+
1. Sampel larutan + gas H2S endapan putih.
2. Sampel larutan + K4Fe(CN)6 endapan putih yang tidak larut
dengan HCl 6 M.
d. Analisis terhadap ion Co2+
1. Sampel larutan + larutan KNO2 6 M, panaskan endapan
kuning.
2. Sampel larutan + tiosianat warna biru.
3. Sampel larutan diteteskan pada kertas saring + nitroso β naftol
dalam spiritus 40% akan terbentuk warna merah.
e. Analisis terhadap ion Ni2+
1. Sampel larutan ditambahkan sedikit demi sedikit NH4OH + dimetil
glioksim warna merah.
f. Analisis terhadap ion Cr3+
1. Sampel larutan + asam asetat 6 M + Pb asetat endapan
kuning.
2. Sampel larutan + difenil karbazon dalam CHCl warna ungu.
3. Sampel larutan + H2O2 3% 2 tetes + metil isobutil keton warna
biru pada lapisan organik.
g. Analisis terhadap ion Mn3+
1. Sampel larutan + HNO3 6 M 1 ml + sebutir Na-bismutat warna
ungu.
2. Teteskan sampel larutan pada kertas saring yang telah dibasahi
dengan pereaksi benzidin asetat noda biru.
3. Uapkan sampel larutan di cawan porselin sampai kembali terjadi
warna hijau.

23
G. Soal
1. Jelaskan ciri-ciri dari Kation Golongan III !
2. Kation apa saja yang termasuk ke dalam Kation Golongan III?
Sebutkan dan jelaskan!
3. Pereaksi apa saja yang dapat digunakan untuk mengidentifikasi
Kation Golongan III? serta tuliskan dan jelaskan hasil reaksinya!
H. Pustaka
Vogel, A.I. 1989. The Textbook of Quantitative Chemical Analysis, 5th Ed. Longman.

24
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. PROSEDUR
Tuliskan dalam bentuk diagram alir
IV. DATA PENGAMATAN
No. Larutan
pereaksi
Hasil
reaksi
Prediksi
sampel
Pereaksi
spesifik
Kesimpulan

25
PERCOBAAN IV
ANALISIS KUALITATIF SENYAWA KATION GOLONGAN IV
A. Latar Belakang Masalah
Kation adalah ion yang bermuatan positif. Ion satu dengan lainnya
dapat dibedakan karena tiap ion mempunyai reaksi kimia spesifik. Kation
merupakan penyusun suatu senyawa, sehingga untuk menentukan jenis
zat atau senyawa tunggal secara sederhana dapat dilakukan dengan
menganalisis jenis kation yang dikandungnya.
Reagensia golongan yang dipakai untuk klasifikasi kation yang
paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida,
dan ammonium karbonat. Klasifikasi ini didasarkan atas apakah suatu
kation bereaksi dengan reagensia-reagensia ini dengan membentuk
endapan atau tidak. Jadi boleh dikatakan, bahwa klasifikasi kation yang
paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida,
dan karbonat dari kation tersebut.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu melakukan metode analisis kation
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menjelaskan ciri-ciri dari Kation Golongan IV.
2. Mahasiswa dapat mengetahui kation apa saja yang termasuk ke
dalam Kation Golongan IV.
3. Mahasiswa mengetahui pereaksi apa saja yang dapat digunakan
untuk mengidentifikasi Kation Golongan IV.
D. Uraian Materi
Kation-kation Golongan IV antara lain: (1) Barium, Ba2+. Barium
adalah logam putih perak, dapat ditempa dan liat, yang stabil dalam
udara kering. Barium bereaksi dengan air dalam udara yang lembab,

26
membentuk oksida atau hidroksida. Barium melebur pada 710 °C; (2)
Strontium, Sr+. Strontium merupakan logam putih perak yang dapat
ditempa dan liat. Strontium melebur pada 771 °C. Sifat-sifatnya serupa
dengan sifat-sifat barium; (3) Kalsium, Ca2+. Kalsium adalah logam putih
perak, yang agak lunak. Kalsium melebur pada 845 °C.
Kation Golongan IV tak bereaksi dengan reagensia Golongan I, II,
dan III. Kation-kation ini membentuk endapan dengan amonium karbonat
dengan adanya amonium klorida, dalam suasana netral atau sedikit
asam. Uji ini harus dijalankan dalam larutan netral atau basa. Jika tidak
ada amonia atau ion amonium, magnesium juga akan mengendap.
Endapan-endapan putih yang terbentuk dengan reagensia golongan
adalah barium karbonat BaCO3, strontium karbonat SrCO3, dan kalsium
karbonat CaCO3.
Ketiga logam alkali tanah ini menguraikan air dengan laju yang
berbeda-beda, dengan membentuk hidroksida dan gas hidrogen.
Hidroksidanya merupakan basa kuat, meskipun dengan kelarutan yang
berbeda-beda: barium hidroksida adalah yang paling mudah larut,
sedangkan kalsium hidroksida yang paling sedikit larut diantara ketiga
ini. Klorida dan nitrat dari alkali tanah sangat mudah larut; karbonat,
sulfat, fosfat, dan oksalatnya tidak larut. Sulfidanya dapat dibuat hanya
dalam keadaan kering; semua sulfida terhidrolisis dalam air, membentuk
hidrogen sulfida dan hidroksida.
Karena alkali tanah bersifat hampir serupa satu sama lain dalam
larutan air, sukarlah bagi kita untuk membedakannya dan terutama untuk
memisahkannya. Namun ada perbedaan-perbedaan dalam kelarutan
beberapa garam mereka dalam medium bukan-air. Begitulah, 100 g
etanol yang bebas-air, melarutkan 12,5 g kalium klorida, 0,91 g strontium
klorida, dan hanya 0,012 g barium klorida (semuanya merupakan garam
tak-berhidrat). Seratus gram campuran 1:1 dietil eter dan etanol bebas-
air, melarutkan lebih 40 g kalsium nitrat anhidrat, sedang kelarutan

27
strontium dan barium nitrat anhidrat dalam larutan ini boleh diabaikan.
Perbedaan-perbedaan ini bisa dipakai untuk pemisahan.
Tabulasi Kation Golongan IV
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation
E. Alat & Bahan
Alat yang digunakan adalah tabung reaksi, pipet tetes, labu ukur
100 mL, gelas beaker 50 mL.
Bahan yang digunakan adalah Ca2+, Ba2+, Sr3+, HCl, amonia,
NaOH, KI, K2CrO4, H2SO4, Na2CO3.

28
F. Prosedur Kerja
a. Analisis terhadap ion Ca2+
1. Larutan sampel + larutan amonium karbonat endapan
amorf, didihkan menghablur.
2. Larutan sampel dibuat alkalis dengan NH4OH dan NH4Cl, +
amonium oksalat endapan (tidak larut dalam asam
asetat, larut dalam asam mineral).
3. Larutan sampel yang dibuat sedikit basa + larutan kalium kromat
endapan kekuningan (larut dalam asam mineral encer).
4. Larutan sampel + asam sulfat encer endapan putih.
b. Analisis terhadap ion Ba2+
1. Larutan sampel + asam sulfat encer endapan putih (tidak larut
dalam asam klorida P dan dalam asam nitrat P).
2. Larutan sampel + larutan kalium kromat endapan kuning (larut
dalam asam mineral, tidak larut dalam asam asetat).
3. Larutan sampel + amonium oksalat endapan putih (larut
dalam asam asetat)
4. Larutan sampel + larutan natrium karbonat endapan putih (larut
dalam asam encer).
5. Larutan sampel menimbulkan warna hijau kekuningan dalam
nyala api yang tidak berwarna dan jika dilihat dengan kaca hijau,
nyala berwarna biru.
c. Analisis terhadap ion Sr3+
Sampel larutan + H2SO4 encer akan terbentuk endapan putih.
Endapan tidak larut dalam amonium sulfat bahkan dengan
pendidihan (perbedaan dengan kalsium). Dalam larutan kalsium
sulfat jenuh terbentuk endapan putih secara perlahan-lahan dalam
keadaan dingin dan akan lebih cepat dengan cara pemanasan
(perbedaan dengan barium).

29
G. Soal
1. Jelaskan ciri-ciri dari Kation Golongan IV !
2. Kation apa saja yang termasuk ke dalam Kation Golongan IV?
Sebutkan dan jelaskan!
3. Pereaksi apa saja yang dapat digunakan untuk mengidentifikasi
Kation Golongan IV? serta tuliskan dan jelaskan hasil reaksinya!
H. Pustaka
Vogel, A.I. 1989. The Textbook of Quantitative Chemical Analysis, 5th Ed. Longman.

30
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. PROSEDUR
Tuliskan dalam bentuk diagram alir
IV. DATA PENGAMATAN
No. Larutan
pereaksi
Hasil
reaksi
Prediksi
sampel
Pereaksi
spesifik
Kesimpulan

31
PERCOBAAN V
ANALISIS KUALITATIF SENYAWA KATION GOLONGAN V
A. Latar Belakang Masalah
Kation adalah ion yang bermuatan positif. Ion satu dengan lainnya
dapat dibedakan karena tiap ion mempunyai reaksi kimia spesifik. Kation
merupakan penyusun suatu senyawa, sehingga untuk menentukan jenis
zat atau senyawa tunggal secara sederhana dapat dilakukan dengan
menganalisis jenis kation yang dikandungnya.
Reagensia golongan yang dipakai untuk klasifikasi kation yang
paling umum adalah asam klorida, hidrogen sulfida, ammonium sulfida,
dan ammonium karbonat. Klasifikasi ini didasarkan atas apakah suatu
kation bereaksi dengan reagensia-reagensia ini dengan membentuk
endapan atau tidak. Jadi boleh dikatakan, bahwa klasifikasi kation yang
paling umum didasarkan atas perbedaan kelarutan dari klorida, sulfida,
dan karbonat dari kation tersebut.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu melakukan metode analisis kation
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menjelaskan ciri-ciri dari Kation Golongan V.
2. Mahasiswa dapat mengetahui kation apa saja yang termasuk ke
dalam Kation Golongan V.
3. Mahasiswa mengetahui pereaksi apa saja yang dapat digunakan
untuk mengidentifikasi Kation Golongan V.
D. Uraian Materi
Kation Golongan V meliputi: (1) Magnesium, Mg2+. Magnesium
adalah logam putih, dapat ditempa dan liat. Magnesium melebur pada
650 °C. Logam ini mudah terbakar dalam udara atau oksigen dengan

32
mengeluarkan cahaya putih; (2) Natrium, Na+. Natrium adalah logam
putih perak yang lunak, yang melebur pada 97,5 °C. Natrium teroksidasi
dengan cepat dalam udara lembab, maka harus disimpan terendam
seluruhnya dalam pelarut nafta atau silena; (3) Kalium, K+. Kalium
merupakan logam putih perak yang lunak. Logam ini melebur pada 63,5
°C. Kalium tetap tak berubah dalam udara kering, tetapi dengan cepat
teroksidasi dalam udara lembab, menjadi tertutup dengan suatu lapisan
biru; (4) Amonium, NH4+. Ion-ion amonium diturunkan dari amonia, NH3,
dan ion hidrogen H+. Ciri-ciri khas ion ini adalah serupa dengan ciri-ciri
khas ion logam-logam alkali. Garam-garam amonium umumnya adalah
senyawa-senyawa yang larut dalam air, dengan membentuk larutan yang
tak berwarna.
Kation Golongan V merupakan golongan kation terakhir.
Golongan ini tidak bereaksi dengan reagensia-reagensia golongan
sebelumnya, dan tidak memiliki reagensia umum. Reaksi-reaksi khusus
atau uji-uji nyala dapat dipakai untuk mengidentifikasi ion-ion ini.
Dari kation-kation golongan ini, magnesium memperlihatkan
reaksi-reaksi yang serupa dengan reaksi-reaksi dari kation-kation dalam
Golongan IV. Namun, magnesium karbonat dengan adanya garam
amonium, larut, maka dalam pengerjaan analisis sistematis (pada mana
garam-garam amonium bertambah jumlahnya dengan banyak sekali
dalam larutan), magnesium tidak akan mengendap bersama kation
Golongan IV. Reaksi ion amonium sangat serupa dengan reaksi-reaksi
ion kalium, karena jari-jari ion dari kedua ion ini hampir identik.

33
Tabulasi Kation Golongan V
Sumber: http://www.slideshare.net/lailaninuurshabrina/tabulasi-kation

34
E. Alat & Bahan
Alat yang digunakan adalah tabung reaksi, pipet tetes, labu ukur
100 mL, gelas beaker 50 mL.
Bahan yang digunakan adalah Mg2+, Na+, K+, HCl, amonia, NaOH,
KI, K2CrO4, H2SO4, Na2CO3, Zn uranil asetat, asam perklorat, asam
tartrat, larutan natrium kobalt nitrit.
F. Prosedur Kerja
a. Analisis terhadap ion Mg2+
1. Larutan sampel + larutan NaOH 1 N endapan putih (mudah
larut dalam larutan amonium klorida, tidak larut dalam pereaksi
berlebih).
2. Larutan sampel + larutan natrium karbonat endapan putih
(larut dalam asam).
b. Analisis terhadap ion Na+
1. Larutan sampel menimbulkan warna kuning intensif dalam nyala
api yang tidak berwarna.
2. Larutan sampel + Zn uranil asetat kristal berbentuk intan.
3. Larutan sampel diasamkan dengan asam asetat encer dan
disaring jika perlu, + Zn uranil asetat endapan hablur kuning.
c. Analisis terhadap ion K+
1. Larutan sampel menimbulkan warna ungu dalam nyala api yang
tidak berwarna.
2. Larutan sampel + asam perklorat endapan putih.
3. Larutan sampel + asam tartrat endapan putih.
4. Larutan sampel + larutan natrium kobalt nitrit endapan
kuning.

35
G. Soal
1. Jelaskan ciri-ciri dari Kation Golongan V !
2. Kation apa saja yang termasuk ke dalam Kation Golongan V?
Sebutkan dan jelaskan!
3. Pereaksi apa saja yang dapat digunakan untuk mengidentifikasi
Kation Golongan V? serta tuliskan dan jelaskan hasil reaksinya!
H. Pustaka
Vogel, A.I. 1989. The Textbook of Quantitative Chemical Analysis, 5th Ed. Longman.

36
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. PROSEDUR
Tuliskan dalam bentuk diagram alir
IV. DATA PENGAMATAN
No. Larutan
pereaksi
Hasil
reaksi
Prediksi
sampel
Pereaksi
spesifik
Kesimpulan

37
PERCOBAAN VI
ANALISIS KUALITATIF SENYAWA ANION
A. Latar Belakang Masalah
Anion adalah ion yang bermuatan negatif. Ion satu dengan lainnya
dapat dibedakan karena tiap ion mempunyai reaksi kimia spesifik. Anion
merupakan penyusun suatu senyawa, sehingga untuk menentukan jenis
zat atau senyawa tunggal secara sederhana dapat dilakukan dengan
menganalisis jenis anion yang dikandungnya.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu melakukan metode analisis anion
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menjelaskan ciri-ciri dari anion.
2. Mahasiswa mengetahui pereaksi apa saja yang dapat digunakan
untuk mengidentifikasi anion.
D. Uraian Materi
Metode yang tersedia untuk mendeteksi anion tidaklah
sesistematik metode yang tersedia untuk mendeteksi kation. Akan tetapi
anion tetap bisa dipisahkan ke dalam golongan-golongan utama
berdasarkan pada kelarutan garam peraknya, garam kalsium atau
bariumnya, dan garam zinknya. Pada hakekatnya, proses-proses yang
dipakai dapat dibagi ke dalam dua kelas antara lain Kelas A, yaitu proses
yang melibatkan identifikasi produk-produk yang mudah menguap yang
diperoleh pada pengolahan dengan asam-asam, dan Kelas B, yaitu
proses yang tergantung pada reaksi-reaksi dalam larutan.
Kelas A dibagi ke dalam sub-kelas (i) gas-gas dilepaskan dengan
asam klorida encer atau asam sulfat encer, dan sub-kelas (ii) gas atau
uap dilepaskan dengan asam sulfat pekat. Anion yang termasuk ke

38
dalam sub-kelas (i) antara lain: karbonat, CO32-; hidrogen karbonat,
HCO3-; sulfit, SO3
2-; tiosulfat, S2O32-; sulfida, S2-; nitrit, NO2
-, hipoklorit,
OCl-; sianida, CN-, dan sianat, OCN-. Sedangkan anion yang termasuk
ke dalam sub-kelas (ii) antara lain: fluorida, F-; heksafluorosilikat, [SiF6]2-;
klorida, Cl-; bromida, Br-; iodida, I-; nitrat, NO3-; klorat, ClO3
-; perklorat,
ClO4-; permanganat, MnO4
-; bromat, BrO3-; borat, BO3
3-; heksasianoferat
(II), [Fe(CN)6]4-; heksasianoferat (III), [Fe(CN)6]
3-; tiosianat, SCN-; format,
HCOO-; asetat, CH3COO-; oksalat, (COO)22-; tartrat, C4H4O6
2-; dan sitrat
C6H5O73-.
Kelas B dibagi ke dalam sub-kelas (i) reaksi pengendapan, dan
sub-kelas (ii) oksidasi dan reduksi dalam larutan. Anion yang termasuk
ke dalam sub-kelas (i) antara lain: sulfat, SO42-; peroksodisulfat, S2O8
2-;
fosfit, HPO32-; hipofosfit, H2PO2
-; arsenat, AsO42-; arsenit, AsO3
3-; kromat,
CrO42-; dikromat, Cr2O7
2-; silikat, SiO32-; heksafluorosilikat, [SiF6]
2-;
salisilat, C7H5O3-; suksinat, C4H4O4
2-; dan benzoat, C7H5O2-. Sedangkan
anion yang termasuk ke dalam sub-kelas (ii) antara lain: permanganat,
MnO4-; kromat, CrO4
2-; dan dikromat, Cr2O72-.
Pada analisis anion digunakan zat pada kira-kira 0,2 g. beberapa
anion akan diuraikan oleh asam menjadi gas-gas yang dapat dikenal.
Masukkan zat padat dari garam-garam bersangkutan ke dalam tabung
reaksi dan tambahkan:
I. Asam sulfat encer
II. Asam sulfat pekat
Lakukan dalam keadaan dingin, bila tidak timbul gas dapat
dipanaskan.

39
I. Dengan asan sulfat encer
No Pengamatan Kesimpulan
1. Timbul gas tidak berwarna, tidak
berbau, dan mengeruhkan air kapur
(Ca(OH)2)
CO2 dari karbonat atau
bikarbonat
2. Timbul gas coklat merah dan berbau NO2 dari nitrit
3. Timbul gas hijau kuning berbau
rangsang, memerahkan dan kemudian
memucatkan kertas lakmus biru
Cl2 dari hipoklorit
4. Timbul gas berbau, merubah warna
kertas K2Cr2O7 menjadi hijau,
melunturkan warna fuhsin
SO2 dari sulfit
5. Timbul gas tidak berwarna (spt 4)
disamping itu terjadi endapan S
SO2 dan S dari tiosulfat
6. Timbul gas tidak berwarna, berbau
busuk menghitamkan kertas saring
yang dibasahi dengan timbal asetat,
merubah kertas kadmium asetat
menjadi kuning
H2S dari sulfida
7. Berbau cuka CH3COO dari asetat
II. Dengan asam sulfat pekat
No Pengamatan Kesimpulan
1. Timbul gas tidak berwarna, berbau
dan berasap di udara. Jika gelas
pengaduk dibasahi dengan NH4OH
lalu diletakkan pada mulut tabung
maka timbul kabut NH4Cl.
HCl dari klorida
2. Timbul gas berbau pedas,
berwarna merah membentuk kabut
HBr dan Br2 dari bromida

40
diudara. Jika diberi MnO2 timbul
gas berwarna merah berbau brom
3. Timbul uap ungu disertai dengan
uap asam (SO2 dan H2S)
HI dan I2 dari iodida
4. Timbul gas kadang-kadang
berwarna coklat dari gas NO2. Jika
direaksikan dengan logam Cu
dalam larutan akan berwarna biru
HNO3 dan NO2 dari nitrat
5. Timbul gas kuning dalam keadaan
dingin, berbau, mudah meletus
CIO3 dari klorat
6. Timbul gas tidak berwarna, jika
dibakar nyala berwarna biru
CO dari format
7. Timbul gas tidak berwarna,
mengeruhkan air kapur, jika
dibakar nyala biru
CO dan CO2 dari oksalat
E. Alat & Bahan
Alat yang digunakan adalah tabung reaksi, pipet tetes, labu ukur
100 mL, gelas beaker 50 mL.
Bahan yang digunakan adalah Cl-, Br-, I-, NO2-, CO32-, BO3
2-, NO3-,
CNS-, [Fe(CN)6-3], [Fe(CN)6
-3], larutan perak nitrat, amonium hidroksida,
NaOH, KI, Kloroform, H2SO4, CH3COOH, Na2CO3, HCl, timbal asetat,
F. Prosedur Kerja
a. Analisis terhadap ion Cl-
1. Larutan sampel + larutan perak nitrat endapan putih (tidak
larut dalam asam nitrat P, larut dalam amonium hidroksida 6 N
sedikit berlebih).
2. Larutan sampel + larutan timbal asetat endapan putih.

41
b. Analisis terhadap ion Br-
1. Larutan sampel + larutan perak nitrat endapan putih
kekuningan yang tidak larut dalam asam nitrat P dan sedikit larut
dalam amonium hidroksida 6 N.
2. Larutan sampel + asam sulfat P + kloroform perubahan warna
pada lapisan kloroform.
3. Larutan sampel + asam sulfat encer tidak timbul gas, panaskan
gas coklat kuning.
c. Analisis terhadap ion I-
1. Larutan sampel + larutan perak nitrat endapan kuning (tidak
larut dalam asam nitrat dan dalam amonium hidroksida 6 N).
2. Larutan sampel + air klor setetes demi setetes larutan kuning
hingga merah, kocok dengan kloroform lapisan kloroform
menjadi ungu.
3. Larutan sampel + asam sulfat P + kloroform perubahan warna
pada lapisan kloroform.
d. Analisis terhadap ion NO2-
1. Larutan sampel + asam mineral encer atau asam asetat 6 N
asap merah kecoklatan.
2. Larutan sampel diteteskan pada kertas kanji iodida biru.
3. Larutan sampel + larutan KI, asamkan dengan asam sulfat, +
kloroform lapisan kloroform berwarna ungu.
e. Analisis terhadap ion CO32-
1. Larutan sampel + asam gelembung gas tidak berwarna,
alirkan ke dalam larutan kalsium hidroksida LP endapan putih.
2. Larutan sampel + larutan perak nitrat endapan putih, +
larutan perak nitrat berlebih kuning.

42
3. Larutan dingin sampel + fenolpthalein LP merah, sedangkan
pada larutan dingin bikarbonat tidak terjadi perubahan warna atau
hanya sedikit berwarna.
f. Analisis terhadap ion BO32-
1. Larutan sampel + larutan perak nitrat endapan putih, panaskan
endapan hitam.
2. Larutan sampel + asam sulfat P dan metanol P, bakar nyala api
bertepi hijau.
3. Larutan sampel + barium nitrat jenuh endapan putih.
g. Analisis terhadap ion NO3-
Tes cincin coklat
Beberapa faktor pengganggu yaitu adanya NO2- dan CNS, sehingga
faktor pengganggu tersebut harus dihilangkan. Caranya yaitu: larutan
ekstrak soda diasamkan dengan HCl 2 N, tambahkan butir tiourea,
panaskan hingga semua gas habis keluar. Ion CNS dihilangkan
dengan penambahan AgSO4 0,1 N, pisahkan dendapan yang terjadi,
filtrat dipakai untuk analisis NO3-. Uapkan larutan ekstrak soda
sampai kering, tambahkan serbuk difenilamin, tambahkan lagi H2SO4
pekat 2 tetes akan terbentuk warna biru.
h. Analisis terhadap ion CNS-
1. Asamkan larutan ekstrak soda dengan HCl 2 N + larutan Co(NO2)2
warna biru.
2. Asamkan larutan ekstrak soda dengan HCl 2 N + larutan FeCl3
warna merah daging.
i. Analisis terhadap ion [Fe(CN)6-4]
1. Tambahkan 1 tetes FeCl3 ke dalam tabung reaksi yang berisi 3
tetes larutan ekstrak soda endapan biru berlin.

43
2. Tambahkan 1 tetes larutan FeSO4 (garam ferro) ke dalam tabung
reaksi yang berisi 3 tetes larutan ekstrak soda endapan putih.
j. Analisis terhadap ion [Fe(CN)6-3]
1. Tambahkan 1 tetes FeCl3 ke dalam tabung reaksi yang berisi 3
tetes larutan ekstrak soda endapan coklat.
2. Tambahkan 1 tetes larutan FeSO4 (garam ferro) ke dalam tabung
reaksi yang berisi 3 tetes larutan ekstrak soda endapan biru
trumbel.
G. Soal
1. Jelaskan ciri-ciri dari anion!
2. Jelaskan pereaksi apa saja yang dapat digunakan untuk
mengidentifikasi anion? serta tuliskan dan jelaskan hasil reaksinya!
H. Pustaka
Vogel, A.I. 1989. The Textbook of Quantitative Chemical Analysis, 5th Ed. Longman.

44
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. PROSEDUR
Tuliskan dalam bentuk diagram alir
IV. DATA PENGAMATAN
No. Larutan
pereaksi
Hasil
reaksi
Prediksi
sampel
Pereaksi
spesifik
Kesimpulan

45
PERCOBAAN VII
ANALISA VOLUMETRI
(Penentuan Kadar Asam Cuka dengan Metode Alkalimetri)
A. Latar Belakang Masalah
Analisa volumetri adalah suatu analisa kimia kuantitatif untuk
menentukan banyaknya suatu zat dalam volume tertentu dengan
mengukur banyaknya volume larutan standar yang dapat bereaksi
secara kuantitatif dengan zat yang akan dianalisis. Analisa volumetri juga
dikenal sebagai titrimetri, dimana zat yang akan dianalisis dibiarkan
bereaksi dengan zat lain yang konsentrasinya diketahui dan dialirkan dari
buret dalam bentuk larutan.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami prinsip-prinsip metode analisis volumetri.
C. Tujuan Pembelajaran Khusus
1. Mahasiswa mampu melakukan metode analisis volumetri
2. Mahasiswa mengetahui penetapan kadar asam cuka dengan metode
alkalimetri
D. Uraian Materi
Reaksi penetralan, atau asidimetri dan alkalimetri melibatkan
titrasi basa bebas, atau basa yang terbentuk karena hidrolisis garam
yang berasal dari basa lemah dengan suatu asam standar (asidimetri),
dan titrasi asam bebas, atau asam yang terbentuk dari hidrolisis garam
yang berasal dari basa lemah dengan suatu basa standar (alkalimetri).
Berdasarkan reaksi antar zat yang akan ditentukan dengan larutan
standar, maka dikenal istilah netralisasi. Titrasi ini menggunakan larutan
NaOH sebagai baku standar dan menghasilkan garam natrium asetat
yang berasal dari asam lemah dan basa kuat.

NaOH (aq)
Garam natrium asetat ini akan dihidrolisa dalam larutan sebagai
berikut:
CH
Indikator dalam titrasi netralisasi adalah indikator yang dipakai
pada metode asidi alkalimetri. Indikator ini dinamakan indikator pH,
karena akan berubah warna sesuai dengan perubahan pH. Pada
analisis volumetri, titrasi asam asetat dengan NaOH umumnya
menggunakan indikator fenolftalein, sehingga harus diketahui pH untuk
setiap perubahan reaksi.
E. Alat & Bahan
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas arloji, gelas
Bahan yang
Larutan asam cuka, indikator Fenolftalein (PP), larutan HCl 0,1 N.
F. Uraian Bahan
1. Asam Oksalat
Asam oksalat adalah senyawa kimia yang memiliki rumus
H2C2O4 dengan nama sistematis asam etanadioa
dikarboksilat paling sederhana ini biasa digambarkan dengan rumus
HOOC-COOH.Merupakan asam organik yang relatif kuat, 10.000 kali
lebih kuat daripada asam asetat.
oksalat, juga agen pereduktor.
46
(aq) + CH3COOH NaCH3COOH(aq)
Garam natrium asetat ini akan dihidrolisa dalam larutan sebagai
CH3COONa + H2O CH3COOH + NaOH
Indikator dalam titrasi netralisasi adalah indikator yang dipakai
pada metode asidi alkalimetri. Indikator ini dinamakan indikator pH,
karena akan berubah warna sesuai dengan perubahan pH. Pada
analisis volumetri, titrasi asam asetat dengan NaOH umumnya
enggunakan indikator fenolftalein, sehingga harus diketahui pH untuk
setiap perubahan reaksi.
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas arloji, gelas beaker, pemanas
Bahan yang digunakan adalah asam oksalat, larutan NaOH 0,1 N,
Larutan asam cuka, indikator Fenolftalein (PP), larutan HCl 0,1 N.
Asam Oksalat
Asam oksalat adalah senyawa kimia yang memiliki rumus
dengan nama sistematis asam etanadioa
dikarboksilat paling sederhana ini biasa digambarkan dengan rumus
COOH.Merupakan asam organik yang relatif kuat, 10.000 kali
lebih kuat daripada asam asetat. Di-anionnya, dikenal sebagai
oksalat, juga agen pereduktor. Banyak ion logam yang membentuk
+ H2O
Garam natrium asetat ini akan dihidrolisa dalam larutan sebagai
COOH + NaOH
Indikator dalam titrasi netralisasi adalah indikator yang dipakai
pada metode asidi alkalimetri. Indikator ini dinamakan indikator pH,
karena akan berubah warna sesuai dengan perubahan pH. Pada
analisis volumetri, titrasi asam asetat dengan NaOH umumnya
enggunakan indikator fenolftalein, sehingga harus diketahui pH untuk
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
, pemanas.
digunakan adalah asam oksalat, larutan NaOH 0,1 N,
Larutan asam cuka, indikator Fenolftalein (PP), larutan HCl 0,1 N.
Asam oksalat adalah senyawa kimia yang memiliki rumus
dengan nama sistematis asam etanadioat. Asam
dikarboksilat paling sederhana ini biasa digambarkan dengan rumus
COOH.Merupakan asam organik yang relatif kuat, 10.000 kali
anionnya, dikenal sebagai
Banyak ion logam yang membentuk

endapan tak larut dengan asam oksalat, contoh terbaik adalah
kalsium oksalat
yang sering ditemukan.
Sifat
berupa senyawa kris
dalam alkohol. Asam oksalat membentuk garam netral dengan logam
alkali (NaK), yang larut dalam air (5
logam dari alkali tanah, termasuk Mg atau dengan logam berat,
mempunyai kelaruta
oksalat secara praktis tidak larut dalam air. Berdasarkan sifat tersebut
asam oksalat digunakan untuk menentukan jumlah kalsium. Asam
oksalat ini terionisasi dalam media asam kuat.
Nama lain
RM
Pemerian
Kelarutan
Kegunaan
Penyimpanan
(Depkes RI, 1979: hal 651)
2. Natrium Hidroksida
Natrium hidroksida mengandung tidak
tidak lebih dari 100,3% alkali jumlah, dihitung
mengandung Na
47
endapan tak larut dengan asam oksalat, contoh terbaik adalah
kalsium oksalat (CaOOC-COOCa), penyusun utama jenis batu ginjal
ng sering ditemukan.
umum dari asam oksalat adalah dalam keadaan murni
berupa senyawa kristal, larut dalam air (8% pada 10
dalam alkohol. Asam oksalat membentuk garam netral dengan logam
alkali (NaK), yang larut dalam air (5-25 %), sementara itu dengan
logam dari alkali tanah, termasuk Mg atau dengan logam berat,
mempunyai kelarutan yang sangat kecil dalam air. Jadi kalsium
oksalat secara praktis tidak larut dalam air. Berdasarkan sifat tersebut
asam oksalat digunakan untuk menentukan jumlah kalsium. Asam
oksalat ini terionisasi dalam media asam kuat.
: Asam oksalat
: (CO2H)2.2H2O
: Hablur ,tidak berwarna .
: Larut dalam air dan etanol
: Sebagai zat tambahan
Penyimpanan : Dalam wadah tertutup rapat
(Depkes RI, 1979: hal 651)
Natrium Hidroksida
Natrium hidroksida mengandung tidak kurang dari 95,0% dan
tidak lebih dari 100,3% alkali jumlah, dihitung sebagai NaOH,
ngandung Na2CO3 tidak lebih dari 3%. Pemerian : Putih atau
endapan tak larut dengan asam oksalat, contoh terbaik adalah
COOCa), penyusun utama jenis batu ginjal
dalam keadaan murni
tal, larut dalam air (8% pada 10oC) dan larut
dalam alkohol. Asam oksalat membentuk garam netral dengan logam
25 %), sementara itu dengan
logam dari alkali tanah, termasuk Mg atau dengan logam berat,
n yang sangat kecil dalam air. Jadi kalsium
oksalat secara praktis tidak larut dalam air. Berdasarkan sifat tersebut
asam oksalat digunakan untuk menentukan jumlah kalsium. Asam
kurang dari 95,0% dan
sebagai NaOH,
tidak lebih dari 3%. Pemerian : Putih atau

48
praktis putih, masa melebur, berbentuk pellet, serpihan atau batang
atau bentuk lain. Keras, rapuh dan menjukkan pecahan hablur. Bila
dibiarkan diudara, akan cepat menyerap karbon dioksida dan lembab.
Kelarutan mudah larut dalam air dan dalam etanol (Depkes,1995).
Fungsinya dalam percobaan ini yaitu sebagai larutan standar
untuk mentritrasi asam cuka (titran). Sifat fisikanya : memiliki rumus
molekul (NaOH), densitas dan fase : 2,100 g/cm³ dalam bentuk
cairan, memiliki titik lebur 318 °C dan titik didih 1390 °C, berupa
cairan higroskopis tidak berwarna.
Sifat kimia dari NaOH yaitu sangat mudah menyerap gas
CO2, senyawa ini sangat mudah larut dalam air. NaOH merupakan
larutan basa kuat, bersifat sangat korosif terhadap jaringan organik,
tidak berbau.
Nama resmi : Natrii hydroxydum
Nama lain : Natrium hidroksida
Berat molekul : 40,00 g/mol
Rumus molekul : NaOH
Pemerian : Bentuk batang, butiran, massa hablur atau
keping, kering, rapuh dan mudah meleleh
basah. Sangat alkalis dan korosif. Segera
menyerap CO2
Kelarutan : Sangat mudah larut dalam air dan etanol (95%)
Penyimpanan : Dalam wadah tertutup baik
Khasiat : -
Kegunaan : Sebagai zat tambahan
3. Asam Asetat
Asam asetat, asam etanoat atau asam cuka adalah senyawa
kimia asam organik yang dikenal sebagai pemberi rasa asam dan
aroma dalam makanan. Asam cuka memiliki rumus empiris C2H4O2.
Rumus ini seringkali ditulis dalam bentuk CH3-COOH, CH3COOH,

49
atau CH3CO2H. Asam asetat murni (disebut asam asetat glasial)
adalah cairan higroskopis tak berwarna, dan memiliki titik beku
16.7°C. Asam asetat merupakan salah satu asam karboksilat paling
sederhana, setelah asam format. Larutan asam asetat dalam air
merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian
menjadi ion H+ dan CH3COO-. Asam asetat merupakan pereaksi
kimia dan bahan baku industri yang penting. Asam asetat digunakan
dalam produksi polimer seperti polietilena tereftalat, selulosa asetat,
dan polivinil asetat, maupun berbagai macam serat dan kain. Dalam
industri makanan, asam asetat digunakan sebagai pengatur
keasaman. Di rumah tangga, asam asetat encer juga sering
digunakan sebagai pelunak air.
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam
asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion
H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah
asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya
adalah asetat (CH3COO−). Sebuah larutan 1.0 M asam asetat (kira-
kira sama dengan konsentrasi pada cuka rumah) memiliki pH sekitar
2.4.
Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip
seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang
sedang yaitu 6.2, sehingga dapat melarutkan baik senyawa polar
seperi garam anorganik dan gula maupun senyawa non-polar seperti
minyak dan unsur-unsur seperti sulfur dan iodin. Asam asetat
bercampur dengan mudah dengan pelarut polar atau nonpolar
lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan
kemudahan bercampur dari asam asetat ini membuatnya digunakan
secara luas dalam industri kimia.
Nama resmi : ACIDUM ACETICUM GLACIALE
Nama lain : Asam asetat glacial
Rumus molekul : CH3-COOH

Berat molekul
Pemerian
Kelarutan
Penyimpanan : Dalam wadah tertutup rapat
Kegunaan : Zat tambahan
(Depkes RI, 1979
4. Asam Klorida
Larutan asam klorida atau yang biasa
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
menyengat. HCl termasuk ba
tubuh HCl diproduksi
menghancurkan bahan ma
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
Ketika dikirim ke industri pengguna,
antara 32~34%. Pembatasan
uapnya yang sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan
Pemerian
Penyimpanan
Stabilitas
50
Berat molekul : 60,05 g/mol
: Cairan jernih, tidak berwarna, bau khas, tajam,
jika diencerkan dengan air, rasa asam
Kelarutan : Dapat campur dengan air, dengan etanol (95%)
P dan dengan gliserol P
Penyimpanan : Dalam wadah tertutup rapat
Kegunaan : Zat tambahan
, 1979: hal 42)
Asam Klorida
Larutan asam klorida atau yang biasa dikenal dengan larutan
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
menyengat. HCl termasuk bahan kimia berbahaya atau B3. Di
tubuh HCl diproduksi dalam perut dan secara alami membantu
menghancurkan bahan makanan yang masuk ke dalam usus.
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
ka dikirim ke industri pengguna, HCl dikirim dengan konsentrasi
antara 32~34%. Pembatasan konsentrasi HCl ini karena tekanan
uapnya yang sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan
: Cairan tidak berwarna,
merangsang. Jika diencerkan dengan 2 bagian
air, asap hilang. Bobot jenis kurang 1,8
enyimpanan : Wadah tertutup rapat.
: Bersifat korosif.
erwarna, bau khas, tajam,
jika diencerkan dengan air, rasa asam
engan etanol (95%)
kenal dengan larutan
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
han kimia berbahaya atau B3. Didalam
dalam perut dan secara alami membantu
kanan yang masuk ke dalam usus. Dalam
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
HCl dikirim dengan konsentrasi
konsentrasi HCl ini karena tekanan
uapnya yang sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan.
berasap, bau
merangsang. Jika diencerkan dengan 2 bagian
obot jenis kurang 1,8.

Fungsi
Kelarutan
5. Fenolftalein
Fenolftalein mengandung tidak kurang dari 98.0% dan tidak
lebih dari 101.0% C
dikeringkan.
Pemerian
Rumus Molekul
Bobot Molekul
Kelarutan
(Depkes RI, 1995: hal 662)
51
: Sebagai campuran dapar.
: Dengan basa, alkali karbonat, denga
perak dan garam merkuri
Fenolftalein mengandung tidak kurang dari 98.0% dan tidak
lebih dari 101.0% C20H14O4 dihitung terhadap zat yang telah
: Serbuk hablur, putih atau putih kekuningan
lemah, tidak berbau, stabil di udara
Rumus Molekul : 3,3-Bis(p-hidroksifenil)ftalida atau C
Bobot Molekul : 318.33 g/mol
: Praktis tidak larut dalam air, larut dalam etanol,
agak sukar larut dalam eter. Mudah larut dalam
larutan alkali hidroksida dan dala
alkali karbonat panas, cairan berwarna merah.
Warna larutan hilang dengan penambahan
asam berlebih atau dengan larutan alkali
hidoksida pekat.
(Depkes RI, 1995: hal 662)
engan basa, alkali karbonat, dengan garam
Fenolftalein mengandung tidak kurang dari 98.0% dan tidak
dihitung terhadap zat yang telah
Serbuk hablur, putih atau putih kekuningan
stabil di udara
hidroksifenil)ftalida atau C20H14O4
Praktis tidak larut dalam air, larut dalam etanol,
agak sukar larut dalam eter. Mudah larut dalam
larutan alkali hidroksida dan dalam larutan
alkali karbonat panas, cairan berwarna merah.
Warna larutan hilang dengan penambahan
asam berlebih atau dengan larutan alkali

52
G. Prosedur Kerja
a. Standarisasi Larutan NaOH
1. Timbang seksama 100 mg asam oksalat (H2C2O4.2H2O),
kemudian masukkan kedalam erlenmeyer
2. Tambahkan 50 mL aquadest kedalamnya, kemudian dititrasi
dengan larutan NaOH menggunakan indikator fenolftalein.
3. Hitung Normalitas NaOH dengan rumus:
Normalitas NaOH = Bobot asam oksalat
V NaOH x BM asam oksalat x Valensi
b. Penetapan Kadar Asam Cuka dalam cuka perdagangan
1. Ambil 10 mL asam cuka sampel, kemudian masukkan kedalam
labu ukur 100 mL dan encerkan hingga 100 mL.
2. Ambil 10 mL larutan yang telah diencerkan dan masukkan
kedalam erlenmeyer. Tambahkan 3 tetes indikator fenolftalein.
3. Titrasi larutan tersebut dengan larutan NaOH yang telah
distandarisasi sampai terjadi perubahan warna.
4. Titrasi dilakukan sebanyak 3 kali.
5. Tuliskan reaksi yang terjadi pada proses titrasi tersebut.
Kadar asam cuka dihitung dengan rumus:
Kadar asam cuka = V NaOH x N NaOH x BM asam cuka x Faktor Pengenceran
mL sampel x 100%
G. Soal
1. Mengapa mahasiswa harus melakukan reaksi volumetri?
2. Mengapa asam cuka dalam penetapan kadarnya menggunakan
metode alkalimetri?

53
H. Pustaka
Depkes RI. 1979. Farmakope Indonesia Edisi III. Kementerian Kesehatan RI. Jakarta.
Depkes RI. 1995. Farmakope Indonesia Edisi IV. Kementerian Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

54
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Pembuatan larutan baku primer
Penimbangan baku primer (tuliskan senyawanya) …..
Dilarutkan sampai ……. mL
b. Pembuatan larutan baku sekunder
Penimbangan baku sekunder
Dilarutkan sampai…… mL
c. Pembakuan
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata

55
d. Penetapan kadar sampel
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata
Perhitungan :
a. Penentuan Kadar Baku Primer
Massa baku primer (tuliskan senyawanya) yang ditimbang : ……..g
Mr baku primer : ………
Tuliskan rumus dan lakukan perhitungan
Jadi, kadar baku primer (tuliskan senyawanya) adalah …….. N
b. Pembakuan
Kadar baku primer (tuliskan senyawanya) :….N
Volume titran sebesar ……ml
V1N1 = V2N2
Tuliskan perhitungan
Jadi, kadar baku sekunder (tuliskan senyawanya) adalah …….. N
c. Perhitungan Kadar Sampel
Kadar baku sekunder (tuliskan senyawanya) :….N
Volume titran sebesar ……ml
V1N1 = V2N2
Tuliskan perhitungan
Jadi, kadar sampel (tuliskan senyawanya) adalah …….. N

56
PERCOBAAN VIII
ANALISA VOLUMETRI
(Penentuan Kadar Boraks dengan Metode Asidimetri)
A. Latar Belakang Masalah
Metode titrimetri masih digunakan secara luas karena merupakan
metode yang tahan, murah, dan mampu memberikan ketepatan (presisi)
yang tinggi. Keterbatasan metode ini adalah bahwa metode titrimetri
kurang spesifik. Dalam analisis titrimetri atau analisis volumetri atau
analisis kuantitatif dengan mengukur volume, sejumlah zat yang diselidiki
direaksikan dengan larutan baku (standar) yang kadar (konsentrasi)-nya
telah diketahui secara teliti dan reaksinya berlangsung secara kuantitatif.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami prinsip-prinsip metode analisis volumetri
C. Tujuan Pembelajaran Khusus
1. Mahasiswa mampu melakukan metode analisis volumetri
2. Mahasiswa mengetahui penetapan kadar boraks dengan metode
asidimetri
D. Uraian Materi
Asidimetri merupakan cara penetapan kadar basa dalam suatu
sampel dengan menggunakan larutan baku yang sesuai. Sebaliknya
alkalimetri adalah cara penetapan kadar asam dengan menggunakan
larutan baku basa yang sesuai.
Untuk keperluan asidi-alkalimetri, asam didefinisikan sebagai
suatu molekul atau ion yang dapat memberikan (donor) proton.
Sedangkan basa didefinisikan sebagai suatu molekul atau ion yang
dapat menerima (akseptor) proton. Sebagai contoh molekul asam adalah
H2O, H2S, HCl, dan H2SO4; asam kation adalah H3O+ dan NH4
+; asam

57
anion adalah HSO4-, HPO4
2- dan H2PO4-. Sedangkan contoh molekul
basa adalah NH3; basa kation adalah Ag(NH3)2+; basa anion OH-, S2- dan
SO42-.
Setelah memberi proton, asam akan berubah menjadi basa
konjugat. Setelah menerima proton, basa akan berubah menjadi asam
konjugat. Antara asam dan basa berlaku hubungan sebagai berikut:
Asam H+(proton) + Basa
HCl H+ + Cl-
HCl disini adalah asam konjugat Cl-; Cl- adalah basa konjugat dari HCl.
E. Alat & Bahan
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas arloji, gelas beaker, pemanas.
Bahan yang digunakan adalah natrium karbonat, boraks, Larutan
asam cuka, indikator merah metil, larutan HCl 0,5 N.
F. Uraian Bahan
1. Natrium Karbonat
Natrium karbonat (juga dikenal sebagai soda pencuci dan
soda abu) adalah garam natrium dari asam karbonat yang mudah
larut dalam air. Natrium karbonat murni berwarna putih, bubuk tanpa
warna yang menyerap embun dari udara, punya rasa alkalin/pahit,
dan membentuk larutan alkali yang kuat. Natrium karbonat dapat
menyebabkan iritasi, serta hindari paparan jangka panjang.
Nama resmi : NATRII KARBONAS
Nama lain : Natrium Karbonat
Rumus kimia : Na2CO3
Berat molekul : 106 g/mol
Pemerian : hablur tidak berwarna, atau serbuk hablur putih

58
Kelarutan : mudah larut dalam air, lebih mudah larut dalam
air mendidih
Kegunaan : Sebagai zat tambahan
(Depkes RI, 1979: hal 400)
2. Boraks
Boraks berasal dari bahasa arab yaitu BOURAQ yang berarti
kristal lunak, boraks merupakan suatu kristal lunak yang mengandung
unsur boron, berwarna dan mudah larut dalam air. Boraks memiliki
nama kimia Natrium Tetraborat (Na2.B4O7.10H2O). Boraks dalam air
berubah menjadi natrium hidroksida dan asam borat. Boraks
mempunyai nama lain natrium biborat, natrium piroborat, natrium
tetraborat. Boraks dipasaran terkenal dengan nama pijer, petitet,
bleng, dan gendar yang bertujuan untuk menyamarkan dipasaran.
Pemerian dari boraks adalah serbuk kristal putih, tidak
berbau, larut dalam air, tidak larut dalam alkohol pH 9.5, stabil pada
suhu serta tekanan normal.
Boraks memiliki kegunaan yang beragam dalam kegiatan
industri dan makanan. Dalam industri boraks digunakan untuk bahan
pembuat deterjen, khususnya industri kertas, gelas, pengawet kayu,
keramik, antiseptik dan pembasmi kecoak, dan mengurangi
kesadahan air. Dapat dijumpai dalam bentuk padat dan jika larut
dalam air akan menjadi natrium hidroksida dan asam borat (H3BO3)
atau yang lazim kita kenal dengan nama Bleng. Asam borat (H3BO3)
merupakan asam organik lemah yang sering digunakan sebagai
antiseptik, dan dapat dibuat dengan menambahkan asam sulfat

59
(H2SO4) atau asam khlorida (HCl) pada boraks. Asam borat juga
sering digunakan dalam dunia pengobatan dan kosmetika. Misalnya,
larutan asam borat dalam air (3%) digunakan sebagai obat cuci mata
dan dikenal sebagai boorwater.
3. Asam Asetat
Asam asetat, asam etanoat atau asam cuka adalah senyawa
kimia asam organik yang dikenal sebagai pemberi rasa asam dan
aroma dalam makanan. Asam cuka memiliki rumus empiris C2H4O2.
Rumus ini seringkali ditulis dalam bentuk CH3-COOH, CH3COOH,
atau CH3CO2H. Asam asetat murni (disebut asam asetat glasial)
adalah cairan higroskopis tak berwarna, dan memiliki titik beku
16.7°C. Asam asetat merupakan salah satu asam karboksilat paling
sederhana, setelah asam format. Larutan asam asetat dalam air
merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian
menjadi ion H+ dan CH3COO-. Asam asetat merupakan pereaksi
kimia dan bahan baku industri yang penting. Asam asetat digunakan
dalam produksi polimer seperti polietilena tereftalat, selulosa asetat,
dan polivinil asetat, maupun berbagai macam serat dan kain. Dalam
industri makanan, asam asetat digunakan sebagai pengatur
keasaman. Di rumah tangga, asam asetat encer juga sering
digunakan sebagai pelunak air.
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam
asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion
H+ (proton), sehingga memberikan sifat asam. Asam asetat adalah
asam lemah monoprotik dengan nilai pKa=4.8. Basa konjugasinya
adalah asetat (CH3COO−). Sebuah larutan 1.0 M asam asetat (kira-
kira sama dengan konsentrasi pada cuka rumah) memiliki pH sekitar
2.4.
Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip
seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang

sedang yaitu
seperi garam anorganik dan gula maupun senyawa non
minyak dan unsur
bercampur dengan mudah dengan pelarut polar atau nonpolar
lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan
kemudahan bercampur dari asam asetat ini membuatnya digunakan
secara luas dalam industri kimia.
Nama resmi
Nama lain
Rumus molekul
Berat molekul
Pemerian
Kelarutan
Penyimpanan : Dalam wadah tertutup rapat
Kegunaan : Zat tambahan
(Depkes RI, 1979: hal 42)
4. Merah Metil
Metil Merah (
memiliki rumus kimia C
indikator titrasi asam basa
60
sedang yaitu 6.2, sehingga dapat melarutkan baik senyawa polar
seperi garam anorganik dan gula maupun senyawa non
minyak dan unsur-unsur seperti sulfur dan iodin. Asam asetat
ur dengan mudah dengan pelarut polar atau nonpolar
lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan
kemudahan bercampur dari asam asetat ini membuatnya digunakan
secara luas dalam industri kimia.
Nama resmi : ACIDUM ACETICUM GLACIALE
ama lain : Asam asetat glacial
Rumus molekul : CH3-COOH
Berat molekul : 60,05 g/mol
: Cairan jernih, tidak berwarna, bau khas, tajam,
jika diencerkan dengan air, rasa asam
Kelarutan : Dapat campur dengan air, dengan etanol (95%)
P dan dengan gliserol P
Penyimpanan : Dalam wadah tertutup rapat
Kegunaan : Zat tambahan
(Depkes RI, 1979: hal 42)
Metil Merah (Methyl Red) adalah senyawa organik yang
memiliki rumus kimia C15H15N3O2. Senyawa ini banyak dipakai untuk
indikator titrasi asam basa.
melarutkan baik senyawa polar
seperi garam anorganik dan gula maupun senyawa non-polar seperti
odin. Asam asetat
ur dengan mudah dengan pelarut polar atau nonpolar
lainnya seperti air, kloroform dan heksana. Sifat kelarutan dan
kemudahan bercampur dari asam asetat ini membuatnya digunakan
ACIDUM ACETICUM GLACIALE
: Cairan jernih, tidak berwarna, bau khas, tajam,
jika diencerkan dengan air, rasa asam
engan etanol (95%)
adalah senyawa organik yang
enyawa ini banyak dipakai untuk

Rumus Molekul
Bobot Molekul
Pemerian
Kelarutan
Trayek pH
(Depkes RI, 1995: hal 1208)
5. Asam Klorida
Larutan asam klorida atau yang biasa
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
menyengat. HCl termasuk ba
tubuh HCl diproduksi dalam perut dan secara alami membantu
menghancurkan bahan ma
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
Ketika dikirim ke industri pengguna,
antara 32~34%. Pembatasan konsentrasi HCl ini karena tekanan
uapnya yang
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan
Pemerian
Penyimpanan
61
Rumus Molekul : Asam 2-[(4-dimetilamino)fenil)azo]benzoate
hidroklorida, 2-[4-(CH3)2NC6H4N:N]
C6H4COOH.HCl
Bobot Molekul : 305.76 g/mol
: Serbuk, merah gelap atau hablur lembayung
: Agak sukar larut dalam air, larut dalam etanol
: Antara 4.2 dan 6.2. perubahan warna dari
merah menjadi kuning
(Depkes RI, 1995: hal 1208)
Asam Klorida
Larutan asam klorida atau yang biasa dikenal dengan larutan
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
menyengat. HCl termasuk bahan kimia berbahaya atau B3. Di
tubuh HCl diproduksi dalam perut dan secara alami membantu
urkan bahan makanan yang masuk ke dalam usus.
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
ka dikirim ke industri pengguna, HCl dikirim dengan konsentrasi
antara 32~34%. Pembatasan konsentrasi HCl ini karena tekanan
sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan
: Cairan tidak berwarna,
merangsang. Jika diencerkan denga
air, asap hilang. Bobot jenis kurang 1,8
enyimpanan : Wadah tertutup rapat.
dimetilamino)fenil)azo]benzoate
N:N]
Serbuk, merah gelap atau hablur lembayung
Agak sukar larut dalam air, larut dalam etanol
Antara 4.2 dan 6.2. perubahan warna dari
kenal dengan larutan
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
han kimia berbahaya atau B3. Didalam
tubuh HCl diproduksi dalam perut dan secara alami membantu
kanan yang masuk ke dalam usus. Dalam
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
HCl dikirim dengan konsentrasi
antara 32~34%. Pembatasan konsentrasi HCl ini karena tekanan
sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan.
berasap, bau
merangsang. Jika diencerkan dengan 2 bagian
obot jenis kurang 1,8.

62
Stabilitas : Bersifat korosif.
Fungsi : Sebagai campuran dapar.
Kelarutan : Dengan basa, alkali karbonat, dengan garam
perak dan garam merkuri
G. Prosedur Kerja
a. Pembuatan larutan merah metil
1. Hangatkan 25 mg merah metil dengan 0,95 ml NaOH 0,05 N dan
5 ml etanol 95%; setelah larut sempurna, tambahkan etanol 50%
hingga 250 ml.
2. Larutkan 100 mg merah metil dalam 100 ml etanol 95%, saring
jika perlu.
b. Pembuatan larutan HCl 0,5 N
Larutkan sejumlah HCl pekat dalam air secukupnya hingga tiap 1000
ml larutan mengandung 18,23 gram HCl.
c. Pembakuan larutan HCl 0,5 N
1. Timbang seksama 750 mg Na2CO3 anhidrat yang sebelumnya
telah dipanaskan pada suhu 270oC selama 1 jam.
2. Larutkan dalam 50 ml air dan tambahkan 2 tetes merah metil.
3. Tambahkan HCl perlahan-lahan dari buret sambil diaduk hingga
larutan berwarna merah muda pucat.
4. Panaskan larutan hingga mendidih, dinginkan, dan lanjutkan
titrasi.
5. Panaskan lagi hingga mendidih, dan titrasi lagi, bila perlu hingga
warna merah muda pucat tidak hilang dengan pendidihan lebih
lanjut.
Satu ml HCl 0,5 N setara dengan 26,495 mg Na2CO3 anhidrat.
Reaksi : Na2CO3 + 2HCl 2NaCl + H2O + CO2

63
Perhitungan :
Normalitas HCl = 2 x mg Na2CO3
BM Na2CO3 x ml HCl
d. Penetapan kadar Boraks
1. Timbang seksama 3 gram, larutkan dalam 50 ml air.
2. Tambahkan larutan merah metil.
3. Titrasi dengan HCl 0,5 N (Jika perlu dipanaskan diatas tangas uap
guna menambah kelarutan).
Satu ml HCl 0,5 N setara dengan 95,34 mg Na2B4O7.10H2O
Reaksi : Na2B4O7.10H2O + 2HCl 4H3BO3 +
2NaCl + 5H2O
Perhitungan :
Kadar Boraks = ml HCl x N HCl x 95,34
mg sampel x 0,5 x 100%
G. Soal
1. Mengapa mahasiswa harus melakukan reaksi volumetri?
2. Mengapa penetapan kadar boraks menggunakan metode asidimetri?
H. Pustaka
Depkes RI. 1979. Farmakope Indonesia Edisi III. Kementerian Kesehatan RI. Jakarta.
Depkes RI. 1995. Farmakope Indonesia Edisi IV. Kementerian
Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

64
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Pembuatan larutan baku primer
Penimbangan baku primer (tuliskan senyawanya) …..
Dilarutkan sampai ……. mL
b. Pembuatan larutan baku sekunder
Penimbangan baku sekunder
Dilarutkan sampai…… mL
c. Pembakuan
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata

65
d. Penetapan kadar sampel
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata
Perhitungan :
a. Penentuan Kadar Baku Primer
Massa baku primer (tuliskan senyawanya) yang ditimbang : ……..g
Mr baku primer : ………
Tuliskan rumus dan lakukan perhitungan
Jadi, kadar baku primer (tuliskan senyawanya) adalah …….. N
b. Pembakuan
Kadar baku primer (tuliskan senyawanya) :…. N
Volume titran sebesar ……ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar baku sekunder (tuliskan senyawanya) adalah …….. N
c. Perhitungan Kadar Sampel
Kadar baku sekunder (tuliskan senyawanya) :…. N
Volume titran sebesar ……ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar sampel (tuliskan senyawanya) adalah …….. N

66
PERCOBAAN IX
IODOMETRI
(Penentuan Kadar Vitamin C dengan Metode Iodometri)
A. Latar Belakang Masalah
Iodium merupakan oksidator lemah, sebaliknya ion iodide
merupakan suatu pereaksi reduksi yang cukup kuat. Dalam proses
analitik iodium digunakan sebagai pereaksi oksidasi (iodimetri) dan ion
iodide digunakan sebagai pereaksi reduksi (iodometri). Beberapa zat
merupakan pereaksi reduksi yang cukup kuat untuk dititrasi secara
langsung dengan iodium. Maka jumlah penentuan iodometrik adalah
sedikit. Akan tetapi, banyak pereaksi oksidasi cukup kuat untuk bereaksi
sempurna dengan ion iodide, dan ada banyak penggunaan proses
iodometrik.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami cara penetapan kadar suatu senyawa
secara volumetri
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menetapkan kadar suatu senyawa dengan titrasi
iodometri.
2. Mahasiswa dapat menetapkan kadar vitamin C
3. Mahasiswa mengetahui reaksi penetapan kadar vitamin C
D. Uraian Materi
Iodometri merupakan salah satu titrasi redoks yang melibatkan
iodium. Titrasi iodometri disebut juga titrasi tidak langsung yang dapat
digunakan untuk menetapkan senyawa-senyawa yang mempunyai
potensial oksidasi yang lebih besar daripada sistem iodium-iodida atau
senyawa-senyawa yang bersifat oksidator seperti CuSO4.5H2O. Pada

67
iodometri, sampel yang bersifat oksidator direduksi dengan kalium iodida
berlebihan dan akan menghasilkan iodium yang selanjutnya dititrasi
dengan larutan baku natrium tiosulfat. Banyaknya volume natrium
tiosulfat yang digunakan sebagai titran setara dengan iodium yang
dihasilkan dan setara dengan banyaknya sampel.
Sebagai contoh adalah penentuan kandungan klorin (Cl2) dalam
agen pemutih. Klorin akan mengoksidasi iodida untuk menghasilkan
iodium. Reaksi yang terjadi adalah sebagai berikut:
Cl2 + 2I- 2Cl- + I2
Selanjutnya iodium yang dibebaskan dititrasi dengan larutan baku
natrium tiosulfat menurut reaksi:
2S2O32- + I2 S4O6
2- + 2I-
Pada titrasi iodometri, larutan harus dijaga agar pHnya lebih kecil
dari 8 karena dalam lingkungan yang alkalis iodium bereaksi dengan
hidroksida membentuk iodida dan hipoyodit dan selanjutnya terurai
menjadi iodida dan iodat yang akan mengoksidasi tiosulfat menjadi
sulfat, sehingga reaksi berjalan tidak kuantitatif. Adanya konsentrasi
asam yang kuat dapat menaikkan oksidasi potensial anion yang
mempunyai oksidasi potensial yang lemah sehingga direduksi sempurna
oleh iodida. Dengan pengaturan pH yang tepat dari larutan maka dapat
diatur jalannya reaksi dalam oksidasi atau reduksi dari senyawa.
Indikator yang digunakan dalam titrasi ini adalah kanji. Kanji tidak
mudah larut dalam air serta tidak stabil dalam suspensi dengan air,
membentuk kompleks yang sukar larut dalam air bila bereaksi dengan
iodium, sehingga tidak boleh ditambahkan pada awal titrasi.
Penambahan kanji dilakukan pada saat larutan berwarna kuning pucat
dan dapat menimbulkan titik akhir titrasi yang tiba-tiba. Titik akhir titrasi
ditandai dengan terjadinya hilangnya warna biru dari larutan menjadi
bening.

E. Alat & Bahan
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas a
Bahan yang digunakan adalah Vitamin C, larutan natrium tiosulfat,
larutan iodium, indikator kanji
.
F. Uraian Bahan
1. Vitamin C
Vitamin C atau 2,3
dengan rumus molekul C
Pemerian vitamin C adalah memiliki karakteristik kristal tidak
berwarna atau serbuk kristal putih atau
atau hampir tidak berbau dan berasa asam. Kelarutan vitamin C
dalam air adalah 1:3 sampai 1:3
metanol 1:10, larut dalam aseton, dan praktis tidak larut dalam
kloroform, eter dan petrolatum. Titik lebu
vitamin C memiliki pH 2,2
Vitamin C merupakan asam lemah dengan pKa 4,17 dan
11,57. Vitamin C stabil pada keadaan kering, namun dalam bentuk
larutan mudah teroksidasi, terutama dalam larutan alkali. Oksidasi
dipercepat dengan
berat. Vitamin C inkompatibel dengan garam besi, agen pengoksidasi
dan garam dari logam berat.
68
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas arloji, gelas beaker, pemanas.
Bahan yang digunakan adalah Vitamin C, larutan natrium tiosulfat,
larutan iodium, indikator kanji.
n C atau 2,3-didehydro-L-threo-hexono
dengan rumus molekul C6H8O6 dan berat molekul 176,13 g/mol.
Pemerian vitamin C adalah memiliki karakteristik kristal tidak
berwarna atau serbuk kristal putih atau kuning pucat, tidak berbau
atau hampir tidak berbau dan berasa asam. Kelarutan vitamin C
dalam air adalah 1:3 sampai 1:3.5, dalam alkohol 1:25, dalam
metanol 1:10, larut dalam aseton, dan praktis tidak larut dalam
kloroform, eter dan petrolatum. Titik leburnya 190°C. Larutan 5%
vitamin C memiliki pH 2,2 - 2,5.
Vitamin C merupakan asam lemah dengan pKa 4,17 dan
11,57. Vitamin C stabil pada keadaan kering, namun dalam bentuk
larutan mudah teroksidasi, terutama dalam larutan alkali. Oksidasi
dipercepat dengan adanya panas, cahaya, oksidator dan logam
berat. Vitamin C inkompatibel dengan garam besi, agen pengoksidasi
dan garam dari logam berat.
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
, pemanas.
Bahan yang digunakan adalah Vitamin C, larutan natrium tiosulfat,
hexono-1,4-lactone
ul 176,13 g/mol.
Pemerian vitamin C adalah memiliki karakteristik kristal tidak
kuning pucat, tidak berbau
atau hampir tidak berbau dan berasa asam. Kelarutan vitamin C
5, dalam alkohol 1:25, dalam
metanol 1:10, larut dalam aseton, dan praktis tidak larut dalam
rnya 190°C. Larutan 5%
Vitamin C merupakan asam lemah dengan pKa 4,17 dan
11,57. Vitamin C stabil pada keadaan kering, namun dalam bentuk
larutan mudah teroksidasi, terutama dalam larutan alkali. Oksidasi
adanya panas, cahaya, oksidator dan logam
berat. Vitamin C inkompatibel dengan garam besi, agen pengoksidasi

69
2. Natrium Tiosulfat
Natrium tiosulfat merupakan garam dari tiosulfat yang
termasuk dalam jenis asam polisulfomonosulfat. Selain itu asam ini
juga dikenal dengan vanadisulfanoat. Kedua asam ini merupakan
runtutan dari asam polisulfana (H2Sx). Ion tiosulfat ini memiliki
geometri tetrahedron terdistorsi. Natrium di alam hanya tersedia
dalam wujud besi oksida karbonat, sedangkan sulfida tidak ditemukan
dalam bentuk murninya. Sedangkan natrium yang ada di laut berupa
senyawa NaCl. Pada organisme (hewan), ion natrium sangat
berperan sekali yaitu sebagai konduksi saraf dan dapat juga
digunakan untuk menjaga keseimbangan osmosis dalam darah. Pada
tumbuhan, ion natrium berfungsi sebagai zat yang esensial untuk
pertumbuhan. Natrium tiosulfat merupakan salah satu senyawa dari
natrium, dengan rumus kimianya adalah Na2S2O3.5H2O.
Pembuatan natrium tiosulfat dapat juga dilakukan dengan
menggunakan H2S sebagai bahan baku dan juga SO3. Namun sangat
disayangkan cara ini sangat sulit dilakukan. Dalam bidang kimia
analitik, natrium tiosulfat ini merupakan larutan standar yang
digunakan untuk titrasi iodometri dan hanya terdapat dalam bentuk
pentahidrat, sehingga harus dilakukan standarisasi dengan larutan
standar primer.
Nama resmi : NATRII THIOSULFAS
Nama lain : Natrium tiosulfat

70
Rumus Molekul : Na2S2O3.5H2O
Bobot Molekul : 248,17 g/mol
Pemerian : hablur besar tidak berwarna atau serbuk hablur
kasar. Dalam udara lembab meleleh basah;
dalam hampa udara pada suhu di atas 33oC
merapuh.
Penyimpanan : Dalam wadah tertutup baik
Kegunaan : Sebagai titran
(Depkes RI, 1979: hal 418)
3. Indikator Kanji
Kanji atau pati disebut juga amilum yang terbagi menjadi dua
yaitu Amilosa (1,4) atau disebut b-Amilosa dan Amilopektin (1,4) ;
(1,6) disebut a-Amilosa.
Namun untuk indikator, lebih lazim digunakan larutan kanji,
karena warna biru tua kompleks pati–iod berperan sebagai uji
kepekaan terhadap iod. Kepekaan itu lebih besar dalam larutan
sedikit asam daripada dalam larutan netral dan lebih besar dengan
adanya ion iodida. Molekul iod diukat pada permukaan beta amilosa,
suatu konstituen kanji.
Indikator kanji yang dipakai adalah amilosa, karena jika
dipakai amilopektin, maka akan membentuk kompleks kemerah-
merahan (violet) dengan iodium, yang sulit dihilangkan warnanya
karena rangkaiannya yang panjang dan bercabang dengan Mr=
50.000 – 1.000.000.
G. Prosedur Kerja
a. Pembakuan larutan baku iodium 0,1 N
1. Isi buret dengan larutan Na2S2O3 yang hendak dibakukan.

71
2. Ukur seksama 15 mL larutan I2 baku, masukkan kedalam labu
ukur 100,0 mL, cukupkan volumenya dengan air sampai tanda
batas, kocok.
3. Pipet 25,0 mL hasil pengenceran
4. Titrasi dengan Na2S2O3 yang hendak dibakukan sampai warna
kuning, tambahkan 2 mL indikator kanji, lalu titrasi terus sampai
warna biru tepat hilang, catat volume yang dibutuhkan.
5. Ulangi titrasi sebanyak 2 kali.
6. Hitung normalitas I2 dengan rumus:
V Na2S2O3 x N Na2S2O3 = V I2 x N I2
b. Penetapan Kadar Vitamin C
Timbang seksama lebih kurang 400 mg, larutkan dalam campuran
100 mL air dan 25 mL asam sulfat 2 N, tambahkan 3 mL kanji LP.
Titrasi segera dengan iodium 0,1 N LV.
1 mL iodium 0,1 N setara dengan 8,806 mg C6H8O6
H. Soal
1. Senyawa-senyawa apa saja yang dapat ditetapkan dengan metode
analisis iodometri? Jelaskan!
2. Tuliskan reaksi yang terjadi pada penetapan kadar vitamin C?
Jelaskan proses yang terjadi!
I. Pustaka
Depkes RI. 2004. Farmakope Indonesia Edisi IV. Kementerian Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

72
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Pembuatan larutan baku primer
Penimbangan baku primer (tuliskan senyawanya) …..
Dilarutkan sampai ……. mL
b. Pembuatan larutan baku sekunder
Penimbangan baku sekunder
Dilarutkan sampai…… mL
c. Pembakuan
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata

73
d. Penetapan kadar sampel
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata
Perhitungan :
a. Penentuan Kadar Baku Primer
Massa baku primer (tuliskan senyawanya) yang ditimbang : ……..g
Mr baku primer : ………
Tuliskan rumus dan lakukan perhitungan
Jadi, kadar baku primer (tuliskan senyawanya) adalah …….. N
b. Pembakuan
Kadar baku primer (tuliskan senyawanya) :…. N
Volume titran sebesar ……ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar baku sekunder (tuliskan senyawanya) adalah …….. N
c. Perhitungan Kadar Sampel
Kadar baku sekunder (tuliskan senyawanya) :…. N
Volume titran sebesar ……ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar sampel (tuliskan senyawanya) adalah …….. M

74
PERCOBAAN X
IODIMETRI
(Penentuan Kadar Vitamin C dengan Metode Iodimetri)
A. Latar Belakang Masalah
Metode titrasi iodimetri disebut juga titrasi iodometri langsung,
metode ini mengacu pada titrasi dengan suatu larutan iod standar.
Iodium memberikan warna ungu atau merah lembayung yang kuat
kepada pelarut-pelarut seperti karbon tetraklorida atau kloroform dan
kadang-kadang hal ini digunakan untuk mengetahui titik akhir titrasi,
akan tetapi lebih umum digunakan suatu larutan (disperse koloidal) kanji,
karena warna biru tua dari kompleks kanji-iodium dipakai untuk suatu uji
sangat peka terhadap iodium. Kepekaan lebih besar dalam larutan yang
sedikit asam daripada larutan netral dan lebih besar dengan adanya ion
iodide.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami cara penetapan kadar suatu senyawa
secara volumetri
C. Tujuan Pembelajaran Khusus
1. Mahasiswa dapat menetapkan kadar suatu senyawa dengan titrasi
iodimetri.
2. Mahasiswa dapat menetapkan kadar vitamin C
3. Mahasiswa mengetahui reaksi penetapan kadar vitamin C
D. Uraian Materi
Iodium merupakan oksidator yang relatif kuat dengan nilai
potensial oksidasi sebesar +0,535 V. Pada saat reaksi oksidasi, iodium
akan direduksi menjadi iodida sesuai dengan reaksi:
I2 + 2e 2I-

Iodium akan mengoksidasi senyawa
potensial reduksi yang lebih kecil dibanding iodium. Vitamin C
mempunyai potensial reduksi yang lebih kecil daripada iodium sehingga
dapat dilakukan titrasi langsung dengan iodium.
Larutan baku iodiu
membakukan larutan natrium tiosulfat. Deteksi titik akhir pada iodimetri
ini dilakukan menggunakan indikator amilum yang akan memberikan
warna biru pada saat tercapainya titik akhir.
E. Alat & Bahan
Alat yang dig
buret dan perlengkapannya, gelas a
Bahan yang digunakan adalah Vitamin C, larutan iodium, larutan
H2SO4, indikator kanji, As
F. Uraian Bahan
1. Vitamin C
Vitamin C atau 2,3
dengan rumus molekul C
Pemerian vitamin C adalah memiliki karakteristik kristal tidak
berwarna atau serbuk kristal putih atau kuning pucat, tidak berbau
atau hampir tidak berbau dan berasa asam. Kelarutan vitamin C
dalam air adalah 1:3 sampai 1:3
metanol 1:10, larut dalam aseton, dan praktis tidak larut dalam
kloroform, eter dan petrolatum. Titik leburnya 190°C. Larutan 5%
vitamin C memiliki pH 2,2
75
Iodium akan mengoksidasi senyawa-senyawa yang mempunyai
potensial reduksi yang lebih kecil dibanding iodium. Vitamin C
mempunyai potensial reduksi yang lebih kecil daripada iodium sehingga
dapat dilakukan titrasi langsung dengan iodium.
Larutan baku iodium yang telah dibakukan dapat digunakan untuk
membakukan larutan natrium tiosulfat. Deteksi titik akhir pada iodimetri
ini dilakukan menggunakan indikator amilum yang akan memberikan
warna biru pada saat tercapainya titik akhir.
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas arloji, gelas beaker, pemanas.
Bahan yang digunakan adalah Vitamin C, larutan iodium, larutan
, indikator kanji, As2O3, NaOH, HCl, NaHCO3.
n C atau 2,3-didehydro-L-threo-hexono
dengan rumus molekul C6H8O6 dan berat molekul 176,13 g/mol.
Pemerian vitamin C adalah memiliki karakteristik kristal tidak
berwarna atau serbuk kristal putih atau kuning pucat, tidak berbau
hampir tidak berbau dan berasa asam. Kelarutan vitamin C
dalam air adalah 1:3 sampai 1:3.5, dalam alkohol 1:25, dalam
metanol 1:10, larut dalam aseton, dan praktis tidak larut dalam
kloroform, eter dan petrolatum. Titik leburnya 190°C. Larutan 5%
memiliki pH 2,2 - 2,5.
senyawa yang mempunyai
potensial reduksi yang lebih kecil dibanding iodium. Vitamin C
mempunyai potensial reduksi yang lebih kecil daripada iodium sehingga
m yang telah dibakukan dapat digunakan untuk
membakukan larutan natrium tiosulfat. Deteksi titik akhir pada iodimetri
ini dilakukan menggunakan indikator amilum yang akan memberikan
unakan adalah erlenmeyer, labu takar, pipet ukur,
, pemanas.
Bahan yang digunakan adalah Vitamin C, larutan iodium, larutan
hexono-1,4-lactone
ul 176,13 g/mol.
Pemerian vitamin C adalah memiliki karakteristik kristal tidak
berwarna atau serbuk kristal putih atau kuning pucat, tidak berbau
hampir tidak berbau dan berasa asam. Kelarutan vitamin C
5, dalam alkohol 1:25, dalam
metanol 1:10, larut dalam aseton, dan praktis tidak larut dalam
kloroform, eter dan petrolatum. Titik leburnya 190°C. Larutan 5%

Vitamin C merupakan asam lemah dengan pKa 4,17 dan
11,57. Vitamin C stabil pada keadaan kering, namun dalam bentuk
larutan mudah teroksidasi, terutama dalam larutan alkali. Oksidasi
dipercepat dengan adanya panas, cahaya, oksidator
berat. Vitamin C inkompatibel dengan garam besi, agen pengoksidasi
dan garam dari logam berat.
2. Indikator Kanji
Kanji atau pati disebut juga amilum
yaitu Amilosa (1,4) atau disebut b
(1,6) disebut a
Namun untuk indi
karena warna biru tua kompleks pati
kepekaan terhadap iod. Kepekaan itu lebih be
sedikit asam
adanya ion iodida. Molekul iod diukat pada permukaan beta amilosa,
suatu konstituen kanji.
Indikator kanji yang dipakai adalah amilosa, karena jika
dipakai amilopektin, maka akan membentuk kompleks kemerah
merahan (violet) dengan iodium, yang
karena rangkaiannya yang panjang dan bercabang dengan Mr=
50.000 – 1.000.000.
3. Natrium Hidroksida
Natrium hidroksida mengandung tidak kurang dari 95,0% dan
tidak lebih dari 100,3% alkali jumlah, dihitung
76
Vitamin C merupakan asam lemah dengan pKa 4,17 dan
11,57. Vitamin C stabil pada keadaan kering, namun dalam bentuk
larutan mudah teroksidasi, terutama dalam larutan alkali. Oksidasi
dipercepat dengan adanya panas, cahaya, oksidator
berat. Vitamin C inkompatibel dengan garam besi, agen pengoksidasi
dan garam dari logam berat.
Indikator Kanji
Kanji atau pati disebut juga amilum yang terbagi menjadi dua
Amilosa (1,4) atau disebut b-Amilosa dan Amilopektin (1,4) ;
disebut a-Amilosa.
Namun untuk indikator, lebih lazim digunakan larutan kanji,
na warna biru tua kompleks pati–iod berperan sebagai uji
kepekaan terhadap iod. Kepekaan itu lebih besar dalam larutan
sedikit asam daripada dalam larutan netral dan lebih
adanya ion iodida. Molekul iod diukat pada permukaan beta amilosa,
suatu konstituen kanji.
Indikator kanji yang dipakai adalah amilosa, karena jika
dipakai amilopektin, maka akan membentuk kompleks kemerah
merahan (violet) dengan iodium, yang sulit dihilangkan warnanya
karena rangkaiannya yang panjang dan bercabang dengan Mr=
1.000.000.
Natrium Hidroksida
Natrium hidroksida mengandung tidak kurang dari 95,0% dan
tidak lebih dari 100,3% alkali jumlah, dihitung sebagai NaOH,
Vitamin C merupakan asam lemah dengan pKa 4,17 dan
11,57. Vitamin C stabil pada keadaan kering, namun dalam bentuk
larutan mudah teroksidasi, terutama dalam larutan alkali. Oksidasi
dipercepat dengan adanya panas, cahaya, oksidator dan logam
berat. Vitamin C inkompatibel dengan garam besi, agen pengoksidasi
yang terbagi menjadi dua
Amilosa dan Amilopektin (1,4) ;
ator, lebih lazim digunakan larutan kanji,
iod berperan sebagai uji
sar dalam larutan
daripada dalam larutan netral dan lebih besar dengan
adanya ion iodida. Molekul iod diukat pada permukaan beta amilosa,
Indikator kanji yang dipakai adalah amilosa, karena jika
dipakai amilopektin, maka akan membentuk kompleks kemerah-
sulit dihilangkan warnanya
karena rangkaiannya yang panjang dan bercabang dengan Mr=
Natrium hidroksida mengandung tidak kurang dari 95,0% dan
sebagai NaOH,

77
mengandung Na2CO3 tidak lebih dari 3%. Pemerian : Putih atau
praktis putih, masa melebur, berbentuk pellet, serpihan atau batang
atau bentuk lain. Keras, rapuh dan menjukkan pecahan hablur. Bila
dibiarkan diudara, akan cepat menyerap karbon dioksida dan lembab.
Kelarutan mudah larut dalam air dan dalam etanol (Depkes,1995).
Fungsinya dalam percobaan ini yaitu sebagai larutan standar
untuk mentritrasi asam cuka (titran). Sifat fisikanya : memiliki rumus
molekul (NaOH), densitas dan fase : 2,100 g/cm³ dalam bentuk
cairan, memiliki titik lebur 318 °C dan titik didih 1390 °C, berupa
cairan higroskopis tidak berwarna.
Sifat kimia dari NaOH yaitu sangat mudah menyerap gas
CO2, senyawa ini sangat mudah larut dalam air. NaOH merupakan
larutan basa kuat, bersifat sangat korosif terhadap jaringan organik,
tidak berbau.
Nama resmi : Natrii hydroxydum
Nama lain : Natrium hidroksida
Berat molekul : 40,00 g/mol
Rumus molekul : NaOH
Pemerian : Bentuk batang, butiran, massa hablur atau
keping, kering, rapuh dan mudah meleleh
basah. Sangat alkalis dan korosif. Segera
menyerap CO2
Kelarutan : Sangat mudah larut dalam air dan etanol (95%)
Penyimpanan : Dalam wadah tertutup baik
Khasiat : -
Kegunaan : Sebagai zat tambahan

4. Asam Klorida
Larutan asam klorida atau yang biasa
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
menyengat. HCl termasuk ba
tubuh HCl diproduksi dalam perut dan secara alami membantu
menghancurkan bahan ma
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
Ketika dikirim ke industri pengguna,
antara 32~34%.
uapnya yang sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan
Pemerian
Penyimpanan
Stabilitas
Fungsi
Kelarutan
G. Prosedur Kerja
a. Pembakuan larutan baku iodium 0,1 N
1. Isi buret dengan larutan I
2. Timbang seksama 150 mg As
erlenmeyer.
78
Asam Klorida
Larutan asam klorida atau yang biasa dikenal dengan larutan
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
menyengat. HCl termasuk bahan kimia berbahaya atau B3. Di
diproduksi dalam perut dan secara alami membantu
menghancurkan bahan makanan yang masuk ke dalam usus.
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
ka dikirim ke industri pengguna, HCl dikirim dengan konsentrasi
antara 32~34%. Pembatasan konsentrasi HCl ini karena tekanan
uapnya yang sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan
: Cairan tidak berwarna,
merangsang. Jika diencerkan dengan 2 bagian
air, asap hilang. Bobot jenis kurang 1,8
enyimpanan : Wadah tertutup rapat.
: Bersifat korosif.
: Sebagai campuran dapar.
: Dengan basa, alkali karbonat, denga
perak dan garam merkuri
Pembakuan larutan baku iodium 0,1 N
Isi buret dengan larutan I2 yang hendak dibakukan.
Timbang seksama 150 mg As2O3, dipindahkan kedalam
erlenmeyer.
kenal dengan larutan
HCl dalam air, adalah cairan kimia yang sangat korosif dan berbau
han kimia berbahaya atau B3. Didalam
diproduksi dalam perut dan secara alami membantu
kanan yang masuk ke dalam usus. Dalam
skala industri, HCl biasanya diproduksi dengan konsentrasi 38%.
HCl dikirim dengan konsentrasi
Pembatasan konsentrasi HCl ini karena tekanan
uapnya yang sangat tinggi, sehingga menyebabkan kesulitan ketika
penyimpanan. Asam klorida di dalam laboratorium biasa digunakan
untuk titrasi penentuan kadar basa dalam sebuah larutan.
berasap, bau
merangsang. Jika diencerkan dengan 2 bagian
obot jenis kurang 1,8.
karbonat, dengan garam
yang hendak dibakukan.
, dipindahkan kedalam

79
3. Larutkan dalam 10 mL NaOH 1 N, jika perlu panaskan diatas
pemanas sampai larut.
4. Dinginkan, encerkan dengan 50 mL air dan tambahkan 2 tetes
fenolftalein.
5. Tambahkan HCl 6 N tetes demi tetes, sampai warna merah tepat
hilang, kemudian tambahkan 1 mL HCl 6 N lagi.
6. Tambahkan hati-hati 1-2 gram NaHCO3 padat, dimana pertama
sekali dimasukkan sedikit NaHCO3 untuk mencegah kehilangan I2
bersama CO2.
7. Tambahkan 2 mL indikator kanji, lalu titrasi dengan larutan I2 yang
hendak dibakukan sampai tepat timbul warna biru yang tidak
hilang selama 30 detik atau lebih.
8. Hitung normalitas (N) larutan I2 dengan rumus:
Normalitas I� = 4 x mg As2O3
BM As2O3 x ml iodium
b. Penetapan Kadar Vitamin C
1. Timbang seksama 400 mg sampel asam askorbat, pindahkan
kedalam labu erlenmeyer.
2. Larutkan dalam campuran 20 mL air bebas CO2 dan 5 mL asam
sulfat encer (10% v/v).
3. Tambahkan 2 mL larutan indikator kanji lalu titrasi dengan larutan
baku I2 0,1 N sampai timbul warna biru yang tidak hilang selama
30 detik, teteskan pada tissue (indikator luar).
H. Soal
1. Senyawa-senyawa apa saja yang dapat ditetapkan dengan metode
analisis iodimetri? Jelaskan!
2. Tuliskan reaksi yang terjadi pada penetapan kadar vitamin C?
Jelaskan proses yang terjadi!

80
I. Pustaka
Depkes RI. 2004. Farmakope Indonesia Edisi IV. Kementerian Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

81
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Pembuatan larutan baku primer
Penimbangan baku primer (tuliskan senyawanya) …..
Dilarutkan sampai ……. mL
b. Pembuatan larutan baku sekunder
Penimbangan baku sekunder
Dilarutkan sampai…… mL
c. Pembakuan
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata

82
d. Penetapan kadar sampel
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata
Perhitungan :
a. Penentuan Kadar Baku Primer
Massa baku primer (tuliskan senyawanya) yang ditimbang : ……..g
Mr baku primer : ………
Tuliskan rumus dan lakukan perhitungan
Jadi, kadar baku primer (tuliskan senyawanya) adalah …….. N
b. Pembakuan
Kadar baku primer (tuliskan senyawanya) :…. N
Volume titran sebesar ……ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar baku sekunder (tuliskan senyawanya) adalah …….. N
c. Perhitungan Kadar Sampel
Kadar baku sekunder (tuliskan senyawanya) :…. N
Volume titran sebesar ……ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar sampel (tuliskan senyawanya) adalah …….. N

83
PERCOBAAN XI
PERMANGANOMETRI
(Penentuan Kadar Hidrogen Peroksida dengan Metode
Permanganometri)
A. Latar Belakang Masalah
Selama lebih dari satu abad, kalium permanganat (KMnO4) telah
digunakan sebagai alat pengoksidasi yang penting dalam reaksi redoks.
Reagen ini dapat diperoleh dengan mudah, tidak mahal, dan tidak
membutuhkan indikator terkecuali untuk larutan yang amat encer. Dalam
suasana asam reaksi paro kalium permanganat adalah sebagai berikut:
MnO4- + 8H+ + 5e- Mn2+ + 4H2O
Potensial standar dalam larutan asam ini adalah sebesar (Eo = 1,5
volt). Jadi KMnO4 merupakan oksidator yang sangat kuat. Dari
persamaan reaksi diatas dapat diketahui bahwa berat ekivalen (BE) dari
KMnO4 adalah seperlima dari berat molekulnya (BE = 1/5 BM), karena
tiap mol KMnO4 setara dengan 5 elektron sehingga valensinya 5 dan BE
= BM/5.
Dalam suasana alkalis, permanganat secara kuantitatif direduksi
menjadi mangan dioksida menurut reaksi berikut dengan nilai potensial
standar Eo = 0,59 volt.
MnO4- + 2H2O + 3e- MnO2 + 4OH-
Dari uraian diatas, maka untuk membuat larutan baku KMnO4
harus dijaga faktor-faktor yang dapat menyebabkan penurunan yang
besar dari kekuatan larutan baku tersebut, antara lain dengan
pemanasan dan penyaringan untuk menghilangkan zat-zat yang mudah
dioksidasi.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami prinsip permanganometri.

84
C. Tujuan Pembelajaran Khusus
1. Mahasiswa mampu mengetahui senyawa reduktor apa saja yang
dapat dianalisis menggunakan metode permanganometri.
2. Mahasiswa mampu menentukan kadar senyawa reduktor dengan
metode permanganometri.
3. Mahasiswa mampu menetapkan kadar hidrogen peroksida.
D. Uraian Materi
Permanganometri adalah salah satu bagian dari titrasi redoks
(reduksi-oksidasi). Reaksinya merupakan serah terima elektron yaitu
elektron diberikan oleh pereduksi (proses oksidasi) dan diterima oleh
pengoksidasi (proses reduksi). Oksidasi adalah pelepasan elektron oleh
suatu zat, sedangkan reduksi adalah pengambilan elektron oleh suatu
zat. Reaksi oksidasi ditandai dengan bertambahnya bilangan oksidasi
sedangkan reduksi sebaliknya.
Titrasi permanganometri dilakukan berdasarkan reaksi
oleh kalium permanganat (KMnO4). Reaksi ini difokuskan pada
reaksi oksidasi dan reduksi yang terjadi antara KMnO4 dengan bahan
baku tertentu. Kebanyakan titrasi dilakukan dengan cara langsung atas
alat yang dapat dioksidasi seperti Fe+, asam atau garam oksalat yang
dapat larut dan sebagainya. Beberapa ion logam yang tidak dioksidasi
dapat dititrasi secara tidak langsung dengan permanganometri seperti:
1. Ion-ion Ca, Ba, Sr, Pb, Zn, dan Hg (I) yang dapat diendapkan sebagai
oksalat. Setelah endapan disaring dan dicuci, dilarutkan dalam H2SO4
berlebih sehingga terbentuk asam oksalat secara kuantitatif. Asam
oksalat inilah yang akhirnya dititrasi dan hasil titrasi dapat dihitung
banyaknya ion logam yang bersangkutan.
2. Ion-ion Ba dan Pb dapat pula diendapkan sebagai garam kromat.
Setelah disaring, dicuci, dan dilarutkan dengan asam, ditambahkan
pula larutan baku FeSO4 berlebih. Sebagian Fe2+ dioksidasi oleh

85
kromat tersebut dan sisanya dapat ditentukan banyaknya dengan
menitrasinya dengan KMnO4.
KMnO4 secara luas digunakan sebagai larutan standar oksidimetri
dan ia dapat bertindak sebagai indikatornya sendiri (autoindikator). Perlu
diketahui bahwa larutan KMnO4 sebelum digunakan dalam proses
permanganometri harus distandarisasi terlebih dahulu, untuk
menstandarisasi KMnO4 dapat digunakan zat reduktor seperti asam
oksalat, natrium oksalat, kalium tetra oksalat, dan lain-lain.
Larutan KMnO4 yang telah distandarkan dapat dipergunakan dalam
3 jenis titrasi, yaitu:
a. Dipergunakan dalam suasana asam untuk titrasi langsung kation-
kation atau ion-ion yang dapat dioksidasi. Zat-zat tersebut antara lain
adalah: Fe2+, Sn2+, Vo2+, C2O42-, SO3, H2O2, Mo3+,Ti3+, As3+.
Dalam suasana asam reaksi paro kalium permanganat adalah sebagai
berikut:
MnO4 + 8 H + 5 e « Mn2+ + 4H2O
potensial standar dalam larutan asam ini adalah sebesar (E0 = 1,51
volt). Jadi KMnO4 merupakan oksidator yang sangat kuat. Dari
persamaan reaksi di atas dapat diketahui bahwa berat ekivalen (BE)
dari KMnO4 adalah 1/5 dari berat molekulnya, karena tiap mol KMnO4
setara dengan 5 elektron sehingga valensinya 5 dan BE=1/5 BM.
b. Dipergunakan dalam suasana asam untuk titrasi tidak langsung zat-zat
yang dapat direduksi (oksidator). Di dalam tiap-tiap penentuan,
sejumlah tertentu reduktor ditambahkan dengan larutan oksidator yang
akan dianalisa, setelah reduksi sempurna, kelebihan reduktor dititrasi
dengan larutan KMnO4 standar, beberapa zat yang dapat digunakan
dengan cara ini antara lain: MnO4, Cr2O7, MnO2, Mn3O4, PbO2, PbO3,
PbO4, Ce4+.

86
c. Digunakan dalam suasana netral atau basa untuk titrasi beberapa zat.
Dalam hal ini permanganat direduksi menjadi MnO2 yang berbentuk
endapan. Beberapa zat yang dapat ditentukan dengan cara ini adalah:
Mn2+, HCOOH.
Asam Sulfat merupakan asam yang paling cocok digunakan
sebagai pelarutnya karena jika digunakan asam klorida maka
kemungkinan akan terjadi reaksi seperti di bawah ini:
2 MnO4- + 16 H+ + 10 Cl- « 2 Mn + 5Cl2 + 8 H2O
dengan demikian, sebagian permanganatnya digunakan untuk
pembentukan klorin. Reaksi ini terutama terjadi dengan garam-garam
besi. Adanya mangan dioksida dapat mempercepat peruraian
permanganat karena mangan dioksida tersebut memperbanyak
pembentukan mangan dioksida sehingga peruraian bertambah cepat.
Ion-ion mangan juga dapat beraksi dengan permanganat membentuk
mangan dioksida menurut reaksi:
2 MnO4- + 2H2O « 4MnO2 + 3 O2 + 4 OH
dan sebagaimana dijelaskan diatas, reaksi ini dikatalisis oleh MnO2
padat.
KMnO4 jika digunakan sebagai oksidator dalam larutan alkalis
kuat, maka ada 2 kemungkinan reaksi, yaitu pertama: reaksi yang
berjalan relatif cepat:
MnO4- + e- « MnO42-
dan reaksi kedua yang berlangsung relatif lambat:
MnO42- + 2H2O + e- « MnO2 + 4 OH
potensial standar reaksi yang pertama E0 = 0,56 volt, sedangkan pada
reaksi kedua sebesar E0 = 0,60 volt. Dengan mengatur suasana sebaik-
baiknya (misalnya menambah ion barium yang dapat membentuk
endapan barium manganat) maka reaksi pertama dapat berjalan baik
sekali.

87
Dalam membuat larutan baku KMnO4 harus dijaga faktor-faktor
yang dapat menyebabkan penurunan yang besar dari kekuatan larutan
baku tersebut, antara lain dengan pemanasan dan penyaringan untuk
menghilangkan zat-zat yang mudah dioksidasi.
Sumber-sumber kesalahan pada titrasi permanganometri, antara
lain terletak pada larutan pentiter KMnO4 pada buret. Apabila percobaan
dilakukan dalam waktu yang lama, larutan KMnO4 pada buret yang
terkena sinar akan terurai menjadi MnO2 sehingga pada titik akhir titrasi
akan diperoleh pembentukan presipitat coklat yang seharusnya adalah
larutan berwarna merah muda.
E. Alat & Bahan
Alat yang digunakan adalah erlenmeyer, labu takar, pipet ukur,
buret dan perlengkapannya, gelas arloji, gelas beaker, pemanas.
Bahan yang digunakan adalah Hidrogen peroksida, larutan asam
sulfat 2 N, larutan kalium permanganat, aquadest.
F. Prosedur Kerja
Timbang seksama lebih kurang 1 mL hidrogen peroksida dalam
labu terukur (labu takar) yang telah ditara sebelumnya dan encerkan
dengan air secukupnya hingga 100 mL. Pada 20,0 mL larutan ini
ditambahkan 20 mL asam sulfat 2 N, titrasi dengan kalium permanganat
0,1 N sampai terbentuk warna pink permanen pertama kali.
Tiap 1 mL larutan kalium permanganat 0,1 N setara dengan 1,701
mg hidrogen peroksida.
G. Soal
1. Senyawa reduktor seperti apa yang dapat dilakukan analisis
menggunakan metode permanganometri? Sebutkan minimal 3 (tiga)
senyawa reduktor tersebut!

88
2. Jelaskan bagaimana menentukan kadar senyawa reduktor dengan
metode permanganometri!
3. Mengapa harus diketahui kadar dari hidrogen peroksida dalam suatu
sampel? Jelaskan alasannya!
H. Pustaka
Depkes RI. 2004. Farmakope Indonesia Edisi IV. Kementerian Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

89
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Pembuatan larutan baku primer
Penimbangan baku primer (tuliskan senyawanya) …..
Dilarutkan sampai ……. mL
b. Pembuatan larutan baku sekunder
Penimbangan baku sekunder
Dilarutkan sampai…… mL
c. Pembakuan
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata

90
d. Penetapan kadar sampel
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata
Perhitungan :
a. Penentuan Kadar Baku Primer
Massa baku primer (tuliskan senyawanya) yang ditimbang : ……..g
Mr baku primer : ………
Tuliskan rumus dan lakukan perhitungan
Jadi, kadar baku primer (tuliskan senyawanya) adalah …….. N
b. Pembakuan
Kadar baku primer (tuliskan senyawanya) :…. N
Volume titran sebesar …… ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar baku sekunder (tuliskan senyawanya) adalah …….. N
c. Perhitungan Kadar Sampel
Kadar baku sekunder (tuliskan senyawanya) :…. N
Volume titran sebesar …… ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar sampel (tuliskan senyawanya) adalah …….. N

91
PERCOBAAN XII
ARGENTOMETRI
(Penentuan Kadar Aminofillin dengan Metode Argentometri)
A. Latar Belakang Masalah
Istilah Argentometri diturunkan dari bahasa latin Argentum, yang
berarti perak. Jadi, Argentometri merupakan salah satu cara untuk
menentukan kadar zat dalam suatu larutan yang dilakukan dengan titrasi
berdasarkan pada pembentukan endapan dengan ion Ag+. Pada titrasi
argentometri, zat pemeriksaan yang telah dibubuhi indikator dicampur
dengan larutan standar garam perak nitrat (AgNO3). Dengan mengukur
volume larutan standar yang digunakan sehingga seluruh ion Ag+ dapat
tepat diendapkan, kadar garam dalam larutan pemeriksaan dapat
ditentukan.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami prinsip argentometri
C. Tujuan Pembelajaran Khusus
1. Mahasiswa mengetahui metode titrasi argentometri.
2. Mahasiswa mampu menentukan kadar halogen atau pseudo halogen
pada suatu campuran dengan metode argentometri.
3. Mahasiswa mampu menetapkan kadar aminofilin.
4. Mahasiswa mengetahui metode pembakuan untuk AgNO3 dan
NH4SCN.
D. Uraian Materi
Argentometri merupakan metode umum untuk menetapkan kadar
halogenida dan senyawa-senyawa lain yang membentuk endapan
dengan perak nitrat (AgNO3) pada suasana tertentu. Metode
argentometri disebut juga dengan metode pengendapan karena pada

92
argentometri memerlukan pembentukan senyawa yang relatif tidak larut
atau endapan. Reaksi yang mendasari titrasi argentometri adalah:
AgNO3 + Cl- AgCl(s) + NO3-
Sebagai indikator, dapat digunakan kalium kromat yang
menghasilkan warna merah dengan adanya kelebihan ion Ag+.
Metode argentometri yang lebih luas lagi digunakan adalah
metode titrasi kembali. AgNO3 berlebihan ditambahkan ke sampel yang
mengandung ion klorida atau bromide. Sisa AgNO3, selanjutnya dititrasi
kembali dengan ammonium tiosianat menggunakan indikator besi (III)
ammonium sulfat.
Titrasi Argentometri terbagi menjadi beberapa metode penetapan
disesuaikan dengan indikator yang diperlukan dalam penetapan kadar.
Metode tersebut antara lain:
1. Metode Mohr : Metode ini dapat digunakan untuk menetapkan kadar
klorida dan bromide dalam suasana netral dengan larutan baku AgNO3
dengan penambahan larutan kalium kromat sebagai indikator. Pada
permulaan titrasi akan terjadi endapan perak nitrat klorida dan setelah
mencapai titik ekuivalen, maka penambahan sedikit perak nitrat akan
bereaksi dengan kromat dengan membentuk endapan dengan kromat
yang berwarna merah.
2. Metode Volhard : Perak dapat ditetapkan secara teliti dalam suasana
asam dalam larutan baku kalium atau ammonium tiosianat, kelebihan
tiosianat dapat ditetapkan secara jelas dengan garam besi (III) nitrat
atau besi (III) ammonium sulfat sebagai indikator yang membentuk
warna merah dari kompleks besi(III) tiosianat dalam lingkungan asam
nitrat 0,5 – 1,5 N. Titrasi ini harus dilakukan dalam suasana asam,
sebab ion besi (III) akan diendapkan menjadi Fe(OH)3
jika suasananya
basa, sehingga titik akhir tidak dapat ditunjukkan.

93
3. Metode K. Fajans : Pada metode ini digunakan indikator adsorbsi,
sebagai kenyataan bahwa pada titik ekuivalen indikator teradsorbsi
oleh endapan. Indikator ini tidak memberikan perubahan warna kepada
larutan, tetapi pada permukaan endapan. Endapan harus dijaga
sedapat mungkin dalam bentuk koloid.
4. Metode Liebig : Pada metode ini titik akhir titrasinya tidak ditentukan
dengan indikator, akan tetapi ditunjukkan dengan terjadinya kekeruhan.
Ketika larutan perak nitrat ditambahkan kepada larutan alkali sianida
akan terbentuk endapan putih, tetapi pada penggojokan larut kembali
karena terbentuk kompleks sianida yang stabil. Jika reaksi telah
sempurna, penambahan larutan perak nitrat lebih lanjut akan
menghasilkan endapan perak sianida. Titik akhir ditunjukkan oleh
terjadinya kekeruhan yang tetap. Kesukaran dalam memperoleh titik
akhir yang jelas disebabkan karena sangat lambatnya endapan melarut
pada saat mendekati titik akhir.
E. Alat & Bahan
Alat yang digunakan adalah erlenmeyer, labu takar, pipet tetes,
pipet ukur, buret dan perlengkapannya, gelas arloji, gelas beaker,
pemanas.
Bahan yang digunakan adalah aminofillin, larutan AgNO3, larutan
amonium tiosianat 0,1 N, HNO3 pekat, indikator besi (III) amonium
hidroksida 6 N, aquadest.
F. Uraian Bahan
1. Aminofillin

94
Nama Resmi : Aminophyllinum
Sinonim : Aminofilina / Teofilina Etilendiamina
Rumus Molekul : C16H24N10O4
Bobot Molekul : 420,43 gr/mol
Pemerian : Butir atau serbuk, putih atau agak kekuningan,
bau lemah mirip amoniak, rasa pahit
Kelarutan : Larut dalam lebih kurang 5 bagian air, jika
dibiarkan mungkin menjadi keruh, praktis tidak
larut dalam etanol (95%) P dan dalam eter P
Penyimpanan : Dalam wadah tertutup rapat, terlindung dari
cahaya
Khasiat : Bronkodilator, antispasmodikum, diuretikum
2. Amonium Tiosianat
Sifat dari ammonium tiosianat adalah larut dalam air dan
etanol, dilarutkan dalam metanol dan aseton, praktis tidak larut dalam
kloroform dan etil asetat. Dosis mematikan minimum melalui uji tikus
secara per oral adalah 330mg/kg.
Penampilan tak berwarna monoklinik serpihan mengkilat atau
kolumnar kristal. Menunjukkan reaksi endotermik bila dilarutkan
dalam air. Larutan berwarna merah dibawah sinar matahari.
G. Prosedur Kerja
a. Pembakuan larutan AgNO3
1. Menimbang 250 mg NaCl dan menambahkan 50 mL aquadest
serta 3 tetes K2Cr2O7.
2. Menitrasi dengan AgNO3 hingga menghasilkan warna yang
tadinya berwarna kuning susu berubah menjadi merah coklat.

95
b. Pembakuan larutan NH4SCN 0,1 N
1. Mengambil 30 mL AgNO3 dan mengencerkan dengan 50 mL
aquadest.
2. Menambahkan 2 mL HNO3 pekat dan 3 tetes indikator besi (III)
amonium sulfat yang menghasilkan warna putih
3. Menitrasi dengan amonium tiosianat yang kemudian
menghasilkan warna merah.
c. Penetapan kadar Aminofilin
1. Menimbang 250 mg Aminofillin, menambahkan 8 mL amonium
encer dan 20 mL AgNO3 masukkan dalam erlenmeyer.
2. Mendidihkan selama 15 menit, kemudian mendinginkan selama
20 menit, menyaring dan mengambil endapannya.
3. Mencuci endapan dengan aquadest hingga 3 kali.
4. Menghitung volume air.
5. Menyimpan air cucian ditambah dengan filtrat yang sudah ada
sebelumnya.
6. Hasil kumpulannya ditambahkan dengan asam nitrat dan 3 mL
asam sitrat dan 2 mL besi (III) amonium sulfat.
7. Menitrasi dengan NH4SCN, catat volume hasil titrasi dan hitung
kadarnya.
H. Soal
1. Sebutkan 3 (tiga) metode dalam titrasi argentometri? Jelaskan
masing-masing perbedaannya!
2. Metode argentometri apa yang sesuai untuk penentuan kadar
halogen atau pseudo halogen pada suatu campuran? Jelaskan!
3. Mengapa harus dilakukan pembakuan untuk AgNO3 dan NH4SCN?
Jelaskan!
4. Jelaskan bagaimana cara menetapkan kadar aminofilin dengan
metode argentometri!

96
I. Pustaka
Depkes RI. 2004. Farmakope Indonesia Edisi IV. Kementerian Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

97
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Pembuatan larutan baku primer
Penimbangan baku primer (tuliskan senyawanya) …..
Dilarutkan sampai ……. mL
b. Pembuatan larutan baku sekunder
Penimbangan baku sekunder
Dilarutkan sampai…… mL
c. Pembakuan
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata

98
d. Penetapan kadar sampel
Titrasi ke Volume baku sekunder (ml)
1
2
3
Rata-rata
Perhitungan :
a. Penentuan Kadar Baku Primer
Massa baku primer (tuliskan senyawanya) yang ditimbang : ……..g
Mr baku primer : ………
Tuliskan rumus dan lakukan perhitungan
Jadi, kadar baku primer (tuliskan senyawanya) adalah …….. N
b. Pembakuan
Kadar baku primer (tuliskan senyawanya) :…. N
Volume titran sebesar …… ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar baku sekunder (tuliskan senyawanya) adalah …….. N
c. Perhitungan Kadar Sampel
Kadar baku sekunder (tuliskan senyawanya) :…. N
Volume titran sebesar …… ml
V1 x N1 = V2 x N2
Tuliskan perhitungan
Jadi, kadar sampel (tuliskan senyawanya) adalah …….. M

99
PERCOBAAN XIII
GRAVIMETRI
(Penentuan Kadar Air Garam Dapur dengan Metode Gravimetri)
A. Latar Belakang Masalah
Gravimetri merupakan cara pemeriksaan jumlah zat yang paling
tua dan yang paling sederhana dibandingkan dengan cara pemeriksaan
kimia lainnya.
Kelebihan cara analisis gravimetri dibanding volumetri adalah
bahwa penyusun yang dicari dapat diketahui pengotornya jika ada; dan
bila diperlukan dapat dilakuakan pembetulan (koreksi). Kekurangan atau
kejelekan dari metode gravimetri adalah cara ini sangat memakan waktu
(time comsuming).
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami metode analisis gravimetri.
C. Tujuan Pembelajaran Khusus
1. Mahasiswa mengetahui pengertian dan perhitungan berat konstan
pada metode analisis gravimetri.
2. Mahasiswa mampu menetapkan kadar air garam dapur.
3. Mahasiswa mampu menyelesaikan perhitungan-perhitungan
gravimetri.
D. Uraian Materi
Analisis gravimetri adalah cara analisis kuantitatif berdasarkan
berat tetap (berat konsisten)-nya. Dalam analisis ini, unsur atau senyawa
yang dianalisis dipisahkan dari sejumlah bahan yang dianalisis. Bagian
terbesar analisis gravimetri menyangkut perubahan unsur atau gugus dari
senyawa yang dianalisis menjadi senyawa lain yang murni dan mantap
(stabil), sehingga dapat diketahui berat tetapnya. Berat unsur atau gugus

100
yang dianalisis selanjutnya dihitung dari rumus senyawa serta berat atom
penyusunnya.
Pekerjaan analisis secara gravimetri dapat dibagi dalam beberapa
langkah sebagai berikut: 1. Pengendapan; 2. Penyaringan; 3. Pencucian
endapan; dan 4. Pengeringan, pemanasan/pemijaran dan penimbangan
endapan hingga konstan.
Gravimetri dapat digunakan untuk menentukan hampir semua
kation dan anion anorganik serta zat-zat netral seperti air, belerang
dioksida, karbon dioksida, dan iodium. Selain itu, berbagai jenis zat
organik dapat ditetapkan dengan teknik gravimetri ini. Contoh-contohnya
antara lain: penetapan kadar laktosa dalam susu, salisilat dalam sediaan
obat, fenolftalein dalam obat pencahar, nikotin dalam pestisida, kolesterol
dalam biji-bijian, dan benzaldehid dalam buah tertentu.
E. Alat & Bahan
Alat yang digunakan adalah gelas beaker, cawan porselen,
desikator, corong, lampu spiritus, neraca massa digital, penjepit tabung,
kertas saring, oven.
Bahan yang digunakan adalah NaCl, larutan AgNO3 0,1 M, HNO3
pekat, aquadest.
F. Prosedur Kerja
1. Menimbang sampel yang mengandung ion klorida sebanyak 0,2 gram
NaCl dan memasukkan ke dalam gelas beaker 250 mL.
2. Menambahkan aquadest 150 mL, aduk hingga larut, lalu
menambahkan 0,5 mL HNO3 pekat.
3. Secara perlahan menambahkan larutan AgNO3 0,1 M sambil terus
diaduk.
4. Memanaskan pada suhu 80 °C sambil diaduk, dinginkan dan simpan
di tempat yang gelap biarkan 15-30 menit sebelum disaring.
5. Menyaring endapan melalui filter crucible dengan vakum.

101
6. Mengumpulkan endapan dalam krus penyaring kemudian cuci 2-3
kali dengan masing-masing 10 mL HNO3 encer sampai cairan
pencuci bebas dari ion Ag+.
7. Mengeringkan krus berisi endapan dalam oven pada suhu 130-150
°C selama 1 jam, dinginkan dalam desikator, dan timbang sampai
mendapat berat bobot konstan.
G. Soal
1. Apa yang dimaksud dengan berat konstan pada metode gravimetri?
Jelaskan!
2. Bagaimana cara menghitung berat konstan pada metode gravimetri?
3. Mengapa garam perlu ditentukan nilai kadar airnya? Jelaskan!
H. Pustaka
Depkes RI. 2004. Farmakope Indonesia Edisi IV. Kementerian Kesehatan RI. Jakarta.
Gandjar, I.G dan Rohman, A. 2012. Kimia Farmasi Analisis. Pustaka Pelajar. Yogyakarta.

102
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN DAN PERHITUNGAN
Pengamatan :
a. Penimbangan Sampel Sebelum dikeringkan
Sampel ke Bobot Sampel (gram)
1
2
3
Rata-rata
b. Penimbangan Sampel Setelah Dikeringkan
Sampel ke Bobot Sampel (gram)
1
2
3
Rata-rata

103
e. Penetapan Kadar Air Sampel
Sampel ke Kadar Air (%)
1
2
3
Rata-rata
Perhitungan:
Kadar air (%) = Bobot sampel setelah dikeringkan
Bobot sampel sebelum dikeringkan x 100%

104
PERCOBAAN XIV
IDENTIFIKASI MERKURI (Hg) PADA KOSMETIKA
A. Latar Belakang
Merkuri atau air raksa (Hg) merupakan golongan logam berat
dengan nomor atom 80 dan berat atom 200,6. Merkuri merupakan unsur
yang sangat jarang dalam kerak bumi, dan relatif terkonsentrasi pada
beberapa daerah vulkanik dan endapan-endapan mineral biji dari logam-
logam berat. Merkuri digunakan pada berbagai aplikasi seperti amalgam
gigi, sebagai fungisida, dan beberapa penggunaan industri termasuk
untuk proses penambangan emas. Dari kegiatan penambangan tersebut
menyebabkan tingginya konsentrasi merkuri dalam air tanah dan air
permukaan pada daerah pertambangan. Elemen air raksa relatif tidak
berbahaya kecuali kalau menguap dan terhirup secara langsung pada
paru-paru.
Walau tidak seburuk efek merkuri yang tertelan (dari makanan
ikan yang tercemar), tetap menimbulkan efek buruk pada tubuh. Kendati
cuma dioleskan ke permukaan kulit, merkuri mudah diserap masuk ke
dalam darah, lalu ,memasuki sistem saraf tubuh. Manifestasi gejala
keracunan merkuri akibat pemakaian krim kulit muncul sebagai
gangguan sistem saraf, seperti tremor (gemetar), insomnia (tidak bisa
tidur), pikun, gangguan penglihatan, ataxia (gerakan tangan tak normal),
gangguan emosi, depresi, dan lain-lain.
Oleh karena umumnya tak terduga kalau itu penyakitnya, kasus
keracunan merkuri sering didiagnosis sebagai kasus Alzheimer,
Parkinson, atau penyakit gangguan otak. Setelah sekian lama, kosmetik
tersebut akan diserap melalui kulit dan dialirkan melalui darah ke
seluruh tubuh, akhirnya merkuri itu akan mengendap di dalam ginjal,
sehingga menyebabkan gagal ginjal yang sangat parah bagi
pemakainya.

105
Produk kosmetika yang dipakai tersebut akan menyebabkan iritasi
parah pada kulit, yakni berupa kulit yang kemerah-merahan dan
menyebabkan kulit menjadi mengkilap secara tidak normal. Kondisi
tersebut telah banyak dikeluhkan oleh para konsumen yang sudah
terlanjur menggunakan produk-produk kosmetika ilegal tersebut.
B. Tujuan Pembelajaran Umum
Mahasiswa mampu memahami prinsip identifikasi logam berat merkuri.
C. Tujuan Pembelajaran Khusus
1. Mahasiswa mengetahui fungsi identifikasi merkuri pada krim
kosmetika.
2. Mahasiswa mengetahui batas kandungan merkuri pada krim
kosmetika.
3. Mahasiswa mampu melakukan ekstraksi logam berat merkuri dalam
sampel kosmetika.
4. Mahasiswa mampu melakukan uji identifikasi logam merkuri dengan
metode reaksi warna, pengendapan serta pembentukan amalgam.
D. Uraian Materi
Merkuri termasuk logam berat berbahaya, yang dalam konsentrasi
kecil pun dapat bersifat racun. Pemakaian merkuri dalam kosmetika
dapat menimbulkan berbagai hal, mulai dari perubahan warna kulit yang
pada akhirnya dapat menyebabkan bintik-bintik hitam pada kulit, alergi,
iritasi kulit, serta pemakaian dengan dosis tinggi dapat menyebabkan
kerusakan permanen otak, ginjal, dan gangguan perkembangan janin
bahkan paparan jangka pendek dalam dosis tinggi juga dapat
menyebabkan muntah-muntah, diare, dan kerusakan paru-paru, serta
merupakan zat karsinogenik (dapat menyebabkan kanker) pada
manusia.

106
Beberapa sampel kosmetika dapat diuji kandungan logam berat
merkuri di dalamnya dengan menggunakan reagensia tertentu yang
dapat mendeteksi merkuri. Bila kosmetika tersebut mengalami
perubahan warna ataupun mengendap dengan reagensia tersebut,
berarti kosmetika mengandung logam berat merkuri.
E. Alat dan Bahan
Alat-alat yang digunakan adalah erlenmeyer, gelas ukur, batang
pengaduk, tabung reaksi, pipet tetes, batang tembaga.
Bahan-bahan yang digunakan adalah eter, HCl 25 % dan HCl 1 N,
HNO3, larutan KI 0,5 N, larutan campuran Na-Sulfat-KI, larutan Cu (II)
sulfat.
F. Cara Kerja
a. Preparasi Sampel
1. Timbang 5 gram sampel krim kosmetika
2. Ekstraksi dengan 25 ml eter
3. Buang fase eter
4. Ulangi proses ektraksi sebangyak 3 kali
5. Tambahkan HCl 25% : HNO3 (3:1) kemudian uapkan diatas
penangas air sampai hampir kering
6. Ulangi prosedur diatas
7. Sisa penguapan ditambah 10 mL air
8. Didihkan sebentar, dinginkan dalam suhu kamar kemudian saring.
b. Pengujian
1. Batang tembaga (sudah diamplas hingga mengkilap) dicelupkan
dalam larutan uji terbentuk Warna abu-abu mengkilap
2. Larutan uji ditambah 2 tetes larutan KI 0,5 N secara perlahan
terbentuk endapan merah jingga

107
3. Larutan uji ditambah 2 tetes larutan Na2SO4-KI secara perlahan
kemudian ditambah larutan Cu (II) sulfat dan ditambah dengan 3
tetes HCl 1 N terbentuk endapan merah jingga.
G. Soal
1. Apa fungsi dilakukannya identifikasi merkuri (Hg) pada krim
kosmetika? Jelaskan!
2. Berapa batas diperbolehkan adanya kandungan merkuri (Hg) pada
krim kosmetika? Apabila kadar merkuri melebihi batas, sebutkan efek
yang akan ditimbulkan!
3. Jelaskan bagaimana cara melakukan ekstraksi logam berat merkuri
dalam sampel kosmetika!
4. Jelaskan bagaimana cara melakukan uji identifikasi logam merkuri
dengan metode reaksi warna, pengendapan serta pembentukan
amalgam!
H. Pustaka
Vogel, A.I., 1989, The Textbook of Quantitative Chemical Analysis, 5th Ed, Longman.

108
FORMAT LAPORAN JURNAL
I. TUJUAN
Tuliskan tujuan praktikum yang akan dikerjakan secara jelas dan singkat
(sebutkan senyawa yang akan diuji)
II. PRINSIP
Tuliskan prinsip dasar dari proses yang akan dikerjakan
III. REAKSI
Tuliskan reaksi yang akan terjadi pada praktikum (tuliskan semua
kemungkinan yang mungkin terjadi bila ada banyak sampel)
IV. PROSEDUR
Tuliskan dalam bentuk diagram alir
V. HASIL PENGAMATAN
Pengujian ke Hasil Pengujian Keterangan
(+) atau (-)
1
2
3

109
Beberapa merk kosmetika yang terjaring razia oleh Badan Pengawas Obat
dan Makanan (BPOM) tahun 2012-2013 yaitu:
Kosmetika mengandung Merkuri (Hg) sebagai berikut:
1) VAYALA Sabun Transparan
2) VAYALA Nightly Cream
3) VAYALA Daily Cream
4) DR Whitening treatment night cream
5) LIE CHE Whitening Soap
6) LIE CHE Day Cream
7) SP Special UV Whitening
8) LIEN HUA Day Cream (Bunga Teratai)
9) LIEN HUA Night Cream (Bunga Teratai)
10) Spesial Pearl Cream Super
11) Pemutih Sejuta Bintang
12) Racikan Walet Putih
13) Day Cream SJ UV White SJ SIN JUNG
14) Night Cream SJ SIN JUNG
15) Klip 80’S Day Cream
16) Klip 80’S Night Cream
17) Walet Krim (Night Cream Small)
18) Walet Krim (Day Cream Small)
19) Pemutih Dokter
20) Vitamin Pemutih Kecantikan
Kosmetika Mengandung Pewarna yang Dilarang sebagai berikut:
1) JUST MISS Lip Color Lipstick No.41
2) FEVES Color Cream 0.43 Phoenix Red
3) FEVES Color Cream 0.43 Phoenix Red (NA)
4) FEVES Color Cream 5.36 Golden Cupprum
5) POND’S Beauty Care Make Up Lipstick Colorful Eye Shadow Two Way
Cake (pink)

110
6) IZOUCA Eye Shadow Two Way Cake with Pearl Nutrient
7) TAILAIMEI 3 in 1 Two Way Cake & Eye Shadow no.A3
8) TAILAIMEI Eye Shadow & Blusher 3 Two Way Cake no. A12
9) TAILAIMEI Make up Kit Eye Shadow & Lipstick 7 Blusher & Two Way
Cake no.A81
10) TAILAIMEI Make up Kit Compact Powder, Eye Shadow Blusher &
Lipstick No. A73
11) TAILAIMEI Fashion Make up Kit Eye Shadow Lipstick & Blusher & Two
Way Cake no.A92
12) TAILAIMEI Make Up Kit Eye Shadow Lipstick No.A64
13) TAILAIMEI Make Up Kit BeautifulColor no.A78
14) TAILAIMEI 12 Eye Shadow & 4 Blush & 3 Two Way Cake
15) TAILAIME Make up Kit Eye Shadow & Blusher & Two Way cake
No.A10
16) TAILAIMEI Make up Kit Compact Powder Eye Shadow Blusher &
Lipstick no.A65
17) TAILAIMEI Make up Kit Eye Shadow Blusher Two Way Cake
18) TAILAIMEI Make up Kit Eye Shadow Lipstick Blusher & Two Way Cake
No.A67
19) TAILAIMEI make up Kit Complete Beauty Care Eye Shadow
20) TAILAIMEI Lipstick Blusher Two Way Cake No.A88
21) TIANNUO Lipstick Paris
22) POND’S Lip Beauty Moisture with Vit. EA18
Kosmetika Mengandung Hidrokinon sebagai berikut:
1. SBM-2 Cream
2. SB-2 Cream
3. SBM-1 Cream
4. SB-1 Cream
5. SB-3 Cream
6. SL-2 Cream