Makalah Model Atom
-
Upload
bcex-bencianak-pesantren -
Category
Documents
-
view
8 -
download
2
description
Transcript of Makalah Model Atom
BAB IIKAJIAN TEORETIS
A. Perkembangan Teori Model AtomPerkembangan teori atom dimulai ketika sorang filsuf Yunani, Democritus, mengemukakan bahwa setiap materi tersusun oleh partikel-partikel kecil yang tidak dapat dibagi lagi disebut atom. Atom ini berasa dari kaya a yang berarti tidak dan tomos yang berarti terbagi. Pada tahun 1803, John Dalton (1766-1844) melakukan percobaan dan menemukan teori mengenai atom. Teori atom Dalton mengemukakan bahwa atom adalah bagian kecil dari suatu zat yang sudah tidak dapat dibagi-bagi lagi yang berbentuk bola pejal. Tetapi pernyataan ini dibantah oleh J.J. Thomson yang melalui percobaan sinar katoda berhasil membuktikan bahwa teori Dalton tersebut salah.
1. Model Atom Jhon DaltonSeorang pemikir Yunani pada abad ke-5 sebelum masehi yaitu Demokritus, berpendapat bahwa suatu zat terdiri dari bagian-bagian kecil yang jika dibagi-bagi terus, akhirnya akan ditemukan suatu bagian terkecil yang sudah tidak bias dibagi-bagi lagi.Jhon Dalton (1766-1844), seorang ilmuwan berkebangsaan Inggris mengembangkan teori tentang atom yang secara garis besar dapat berisi tentang:a. zat terdiri dari atom yang merupakan sesuatu yang tidak dapat dibagi-bagi lagi;b. Atom-atom penyusun suatu zat tertentu meiliki sifat yang sama;c. Perbedaan suatu zat dengan zat lain disebabkan oleh perbedaan atom-atom penyusunnya;d. Reaksi kimia pada dasarnya merupakan penyusunan kembali atom-atom penyusun zat;e. Dalam reaksi kimia, jumlah atom yang terlibat memiliki perbandingan tertentu.
BAB IIPEMBAHASAN
A. Kesimpulan Setiap Teori Model Atom
1. Model Atom ThomsonThomson menarik kesimpulan bahwa suatu model atom harus memenuhi dua hal yaitu sebagai berikut:a. sebuah atom harus netral;b. sebaian besar massa atom terdapat pada muatan positifnya.
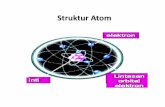
2. Model Atom RutherfordRutherford mengemukakan suatu model atom yaitu sebagai berikut:a. sebuah atom terdiri atas inti bermuatan positif yang terletak di pusat;b. inti atom dikelilingi electron yang dipengaruhi oleh gaya tarik menarik;c. atom bersifat netral.
3. Model Atom BohrBohr mengemukakan suatu model atom yaitu sebagai berikut:a. Elektron mengelilingin inti dengan lintasan atau orbit tertentu;b. Elektron dapat berpindah dari tingkat energi satu ke tingkat energy yang lain.
B. Bilangan Kuantum
1. Bilangan kuantum utama (n)Bilangan kuantum utama menyatakan dikulit / tingkat energy mana electron redakKulitKLMN
Harga n1234
2. Bilangan kuantu Azimut ()Bilangan Kuantum azimut menyatakan di sub kulit mana electron beredarSub KulitSPDF
Harga 0123
3. Bilangan Kuantum Magnetik (m)Bilangan kuantum magnetic menyatakan di orbit mana electron beredar / menggambarkan jumlah orbital.
4. Bilangan Kuantum Spin (s)Bilangan kuantum spin menyatakan kea rah mana electron beredar. Atau atom beredar mengelilingi inti atom pada rotasinya. Apabila elektro bergerak searah jarum jam maka bernilan +. Apabila electron bergerak berlawanan arah jarum jam maka bernilai -.
C. Spektrum Hidrogen
Spectrum Hidrogen dibedakan menjadi 2 yaitu sebagai berikut:1. Spektrum emisi yaitu spectrum yang dihasilkan oleh suatu zat yang memancarkan gelombang elektromagnetik.2. Spektrum absorpsi yaitu spektrum yang terjadi karena penyerapan panjang gelombang tertentu oleh suatu zat terhadap radiasi gelombang elektromagnetik yang memiliki spektrum continue.
D. Kegiatan Diskusi
1. PertanyaanAdapaun pertanyaan-pertanyaan yang diajukan dalam kegiatan diskusi fisika atom adalah sebagai berikut:a. bagaimana kesimpulan dari setiap teori atom tersebut? (Sandi Efirman)b. bagaimana hubungan antara pembelajaran atom di fisika dan kimia? (Riki Heriyanto)c. bagaimana cara menentukan bilangan kuantum utama?d. dalam kehidupan sehari-hari, teori model atom digunakan dalam hal apa?
2. JawabanAdapun jawaban-jawaban dari setiap pertanyaan yang diajukan adalah sebagai berikut:a. setiap teori model atom memiliki kelemahan=kelemahan dan juga kesimpulan. Dan dari setiap model atom tersebut saling melengkapi (Yiyik Sri Hartanti).b. apabila di dalam pembelajaran fisika, atom hanya dipelajari dasar-dasarnya saja. Tetapi di dalam pembelajaran kimia, atom dipelajari secara mendalam. Nindi Indriyani)c. biasanya diketahui dahulu salah satu dari bilangan kuantum tersebut. (Teti Rohaeni)d. Sampai sejauh ini teori model atom dalam kehidupan sehari-hari belum dirasakan manfaatnya. Hanya sebagai pengetahuan belaka dalam proses pembelajaran.3