Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
-
Upload
rizka-ayu-melykhatun -
Category
Documents
-
view
240 -
download
0
Transcript of Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
1/9
LAPORAN PRAKTIKUM KIMIA FISIKA PERSAMAAN ARRHENIUS
DAN ENERGI AKTIVASI
Rizka Ayu Melykhatun* Ria Ayu Maha!ani
Lab. Kimia Fisika Jurusan Kimia Universitas Negeri Semarang
Gedung D8 Lt 2 Sekaran Gunungpati Semarang (5022!" #nd$nesia
ri%kaa&ume'&katun)gmai'.*$m" 085+2888,-,
bstrak
/raktikum persamaan rrenius dan energi aktivasi bertuuan untuk mempe'aari
pengaru temperatur teradap 'au reaksi dan menentukan energi aktivasi dengan
menggunakan persamaan rrenius. /er*$baan ini menggunakan met$de pen&amaan
temperatur 'arutan dengan temperatur 'arutan &ang divariasi. 1ariasi temperatur &ang
digunakan" &aitu" 0⁰3" 5⁰3" 20⁰3" 25⁰3" -0⁰3 dan -5⁰3. pada temperatur tersebut"
'arutan sistem dan 'arutan sistem 2 direaksikan ingga 'arutan ber4arna biru untuk
pertama ka'i. aktu &ang dibutukan untuk bereaksi berturut6turut" &aitu" , detik"2
detik" detik" 7"7 detik" 5 detik dan , detik. Data tersebut diana'isis dengan
menggunakan rumus perbandingan k$nsentrasi 292 &ang bereaksi dan k$nsentrasi 292
a4a' kemudian dika'ikan1
t . Dari asi' ana'isis didapatkan ni'ai 'n K &ang kemudian
diubungkan dengan1
T da'am sebua kurva. Kurva tersebut memi'iki persamaan
garis &:6,58+";
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
2/9
*eywords5 activation energy6 Arrhenius equation6 temperature6 the rate of reaction6
solution.
Pen"ahuluan
Lingkungan sekitar kita terbentuk dari berbagai ma*am materi. Bateri6materi tersebut
dapat menga'ami perubaan seingga membentuk suatu materi baru. /eristi4a ini disebut
reaksi. pabi'a perubaan tersebut merupakan perubaan kimia4i dengan suatu ikatan kimia
maka reaksin&a disebut reaksi kimia. 3$nt$ reaksi kimia da'am keidupan seari6ari
ada'a peristi4a ?$t$sintesis" pembakaran sampa dan pr$ses pernapasan.
Suatu reaksi kimia dapat teradi apabi'a terdapat tumbukan antar m$'eku' %at6%at &ang
bereaksi. >idak semua tumbukan men&ebabkan ber'angsungn&a reaksi. Da'am te$ri
tumbukan" diasumsikan ba4a 'au reaksi berbanding 'urus dengan um'a tumbukan antar
m$'eku'. a' ini mene'askan pengaru k$nsentrasi teradap 'au reaksi (3r&sand" 202!#
Setiap m$'eku' &ang bergerak memi'iki energi kinetik. Semakin *epat bergerak"
semakin besar energi kinetikn&a. Ketika m$'eku' bertumbukan" bagian dari energi kinetik
diuba menadi energi getaran. Jika energi kinetik a4a' besar maka m$'eku' &ang
bertumbukkkan akan bergetar sangat kuat seingga mampu meme*akan ikatan kimia. Jika
energi kinetik a4a' ke*i'" maka m$'eku' an&a akan terpenta' satu sama 'ain.
Ceaksi kimia dapat ber'angsung apabi'a m$'eku' &ang bertumbukan memi'iki energi
kinetik t$ta' &ang sama atau 'ebi besar dari energi aktivasi. nergi aktivasi ada'a energi
minimum &ang dibutukan $'e suatu reaksi kimia agar dapat ber'angsung (3aste''an" 82!.
pabi'a energi kinetik kurang dari energi aktivasi" m$'eku' &ang merupakan reaktan akan
tetap utu dan tidak ada perubaan dari asi' tumbukan.
nergi aktivasi pertama ka'i diperkena'kan $'e Svante rrenius. nergi aktivasi
mempun&ai 'ambing a dengan satuan ki'$ $u'e per m$'. >aun 88" rrenius
mengusu'kan persamaan &ang mene'askan pengaru temperatur teradap k$nstanta 'au
reaksi. /ersamaan tersebut" &aitu@
K = A e
Ea
RT
K : k$nstanta 'au reaksi
: ?akt$r ?reakuensi
a : energi aktivasi
Da'am bentuk '$garitma dapat ditu'is @
ln K = ln A −( Ea
RT )
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
3/9
ln K =− Ea
RT x 1
T +ln A
ubungan antara energi aktivasi" temperatur dan 'au reaksi ini dapat diana'isis da'am
bentuk gra?ik ubungan antara => dan 'n K dengan gradien E(a=C>! dan intersep 'n (tkins" !.
eberapa reaksi teradi dengan muda pada temperatur kamar karena partike' &ang
bereaksi te'a memi'iki energi aktivasi &ang diper'ukan pada temperatur tersebut. Ceaksi
'ainn&a an&a teradi ketika dipanaskan karena partike' tidak memi'iki energi &ang *ukup
ke*ua'i sumber eksterna' panas diberikan pada partike' &ang akan memberikan energi kinetik
&ang 'ebi besar.
/ada praktikum ini" tuuan &ang ingin di*apai" &aitu" mempe'aari pengaru
temperature teradap 'au reaksi dan menentukan energi aktivasi dengan menggunakan
persamaan rrenius. Sedangkan masa'a &ang berusaa dipe*akan dari praktikum ini"
&aitu" ! bagaimana pengaru temperature teradap 'au reaksiA dan 2! bagaimana *ara
menentukan energi aktivasi dengan menggunakan persamaan rrenius.
Met$"e
/raktikum /ersamaan rrenius dan nergi ktivasi ini di'akukan dengan met$de
pen&amaan variasi temperatur 'arutan. /raktikum ini dia4a'i dengan pembuatan baan dan
persiapan a'at &ang akan digunakan. aan &ang te'a dibuat" digunakan untuk membuat
'arutan sistem dan 'arutan sistem 2. Larutan sistem terdiri atas idr$gen per$ksida dan
auades sedangkan 'arutan sistem 2 terdiri atas ka'ium i$dida" natrium ti$su'?at" auades dan
ami'um. arna 'arutan di kedua sistem diamati dan di*atat da'am tabe' asi' per*$baan.
>emperatur 'arutan sistem dan 'arutan sistem 2 disamakan. /ada praktikum ini
digunakan variasi temperatur 0 ℃ " 5 ℃ " 20 ℃ " 25 ℃ " -0 ℃ dan -5 ℃ .
Untuk variasi temperatur 0 ℃ " 5 ℃ dan 20 ℃ " temperatur 'arutan diturunkan
dengan menggunakan termostat . Sedangkan untuk variasi temperatur 25 ℃ " -0 ℃ dan
-5 ℃ " temperatur 'arutan dinaikkan dengan menggunakan waterbath.
Larutan sistem dan 'arutan sistem 2 di*ampur di da'am ge'as kimia &ang
temperaturn&a uga te'a diturunkan dan atau dinaikkan. arna dan temperatur a4a'
*ampuran diamati dan di*atat da'am tabe' asi' praktikum. 7topwatch din&a'akan ingga
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
4/9
'arutan *ampuran mu'ai ber4arna biru untuk pertama ka'i. >emperatur ketika *ampuran mu'ai
ber4arna biru untuk pertama ka'i diamati dan di*atat da'am tabe' asi' praktikum.
'at6a'at &ang dibutukan pada praktikum ini ada'a seperangkat a'at ge'as dari
/&re;" term$meter raksa dari Hena*$" stopwatch dari Diam$nd dan waterbath dari Bemmert.
Sedangkan baan6baan &ang dibutukan pada praktikum ini" &aitu" Natrium >i$su'?at for
syn dari Ber*k" Ka'ium #$dide for syn dari Ber*k" mi'um for syn dari Ber*k dan idr$gen
/er$ksida dari Ber*k.
/ada praktikum ini" variabe' bebas &ang digunakan ada'a kuantitas baan &ang
digunakan dan temperatur. Se'ain sebagai variabe' bebas" temperatur uga sebagai veriabe'
k$ntr$' &ang arus diaga ingga pr$ses reaksi se'esai. Sedangkan variab'e terikat pada
praktikum ini" &aitu" 4aktu &ang dibutukan ingga *ampuran 'arutan mu'ai ber4arna biru
untuk pertama ka'i.
Data asi' per*$baan dibuat kurva untuk mengetaui pengaru temperatur teradap
'au reaksi. Kurva tersebut merupakan ubungan antara1
T dan 'n K. Data asi' per*$baan
uga diana'isis dengan menggunakan persamaan rrenius. a' ini bertuuan untuk
menentukan ni'ai energi aktivasi &ang dibutukan da'am reaksi &ang teradi pada praktium.
Ha%il Dan Pe&'aha%an
/ada praktikum ini" variasi temperatur digunakan untuk mengetaui pengaru
temperatur teradap 'au reaksi. 1ariasi temperatur &ang digunakan tidak 'ebi dari ,0 ℃
karena idr$gen /er$ksida dapat menga'ami dispr$p$rsi$nasi pada temperatur tinggi. Ceaksi
dispr$p$rsi$nasi ada'a suatu reaksi &ang teradi apabi'a reaktan berperan sebagai $ksidat$r
seka'igus redukt$r (David" dkk." 200!. pabi'a idr$gen /er$ksida menga'ami reaksi
dispr$p$rsi$nasi maka akan terurai menadi air dan $ksigen. a' ini men&ebabkan reaksi
akan bera'an 'ambat. Ceaksi &ang teradi apabi'a idr$gen /er$ksida menga'ami
dispr$p$rsi$nasi" &aitu@
' "("3aq4 8 ' "(3l4 / ("3g4
Larutan K# &ang digunakan pada praktikum ini tidak ber4arna. pabi'a 'arutan K#
ber4arna kuning" berarti 'arutan tersebut te'a rusak. K# bersi?at igr$sk$pis" muda
ter$ksidasi $'e $ksigen di udara (Sumard$" 200!. Ceaksi &ang teradi apabi'a K#
ter$ksidasi $'e $ksigen" &aitu@
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
5/9
$' / / $9 / (" 8 "9 / "' "(
/r$ses pemanasan pada pembuatan ami'um bertuuan agar ami'um 'ebi *epat 'arut.
/enggunaan mi'um &ang masi segar da'am praktikum ini karena ami'um &ang 'ama
memi'iki kemungkinan perubaan struktur. milum mudah terurai $'e bakteri di udara
bebas. mi'um uga akan teridr$'isis apabi'a terkena asam.
/enurunan dan penaikkan temperatur pada ge'as kimia &ang digunakan untuk
men*ampurkan 'arutan bertuuan untuk menaga temperatur. /ada praktikum ini" temperatur
arus diaga karena temperatur merupakan variabe' k$ntr$'. pabi'a temperatur tidak k$nstan
maka reaksi &ang ber'angsung tidak akan stabi'.
Larutan sistem dan 'arutan sistem 2 tidak ber4arna. /ada a4a' pen*ampuran"
'arutan uga tidak ber4arna. /en*atatan temperature di a4a' pen*ampuran bertuuan untuk
memastikan ba4a temperatur da'am keadaan k$nstan ingga raksi ber'angsung. >emperatur
a4a' *ampuran dan 4arna a4a' *ampuran ini dapat di'iat pada >abe' .
>abe' . Data asi' /en*ampuran Kedua Larutan
TemperaturAwal Campuran
Perencanaan(oC)
TemperaturAwal CampuranPraktikum (oC)
Warna AwalCampuran
Perencanaan
Warna AwalCampuranPraktikum
10 10,0 Tak berwarna Tak berwarna
15 15,0 Tak berwarna Tak berwarna
20 20,0 Tak berwarna Tak berwarna
25 25,0 Tak berwarna Tak berwarna
30 30,0 Tak berwarna Tak berwarna
35 35,0 Tak berwarna Tak berwarna
>emperatur a4a' *ampuran pada saat praktikum suda sama dengan temperatur a4a'
*ampuran &ang diren*anakan. a' ini dapat di'iat pada >abe' . Se'ain itu" temperatur
*empuran 'arutan pada saat praktikum uga suda sesuai dengan temperatur &ang te'a
diren*anakan.
Larutan mu'ai ber4arna biru sete'a beberapa detik. /erbedaan temperatur
men&ebabkan perbedaan pu'a pada 4aktu &ang dibutukan untuk bereaksi. /en*atatan 4aktu
bertuuan untuk membandingkan pengaru temperatur teradap 'au rekasi. a' ini dapat
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
6/9
di'iat pada >abe' 2. /en*atatan temperatur di akir pen*ampuran bertuuan untuk
memastikan ba4a temperatur da'am keadaan k$nstan.
>abe' 2. Data asi' /raktikum
TemperaturAkhir Campuran
Perencanaan(oC)
TemperaturAkhir Campur
anPraktikum (oC)
Warna AkhirCampuran
Perencanaan
WarnaAkhir
CampuranPraktikum
W aktuReaksi (s)
10 10,0 biru biru 14,0
15 15,0 biru biru 12,0
20 20,0 biru biru 9,0
25 25,0 biru biru 6,5
30 30,0 biru biru 5,0
35 35,0 biru biru 4,0
/ada >abe' dan >abe' 2 dapat di'iat ba4a data temperatur a4a' dan data
temperatur akir pada praktikum ini sama untuk semua variasi temperatur. #ni berarti
temperatur 'arutan pada praktikum ini k$nstan.
Saat 'arutan mu'ai ber4arna biru untuk pertama ka'i" berarti 'arutan suda bereaksi.
Da'am >abe' 2 dapat di'iat ba4a 4arna akir 'arutan sete'a di*ampurkan pada 4aktu
tertentu sama dengan 4arna akir 'arutan &ang te'a diren*anakan.
/ada praktikum ini" 'arutan idr$gen /er$ksida ber?ungsi sebagai $ksidat$r. idr$gen
/er$ksida menguba i$n i$dida menadi #2. #ni berarti i$n i$dida menga'ami $ksidasi. dan&a
'arutan Natrium >i$su'?at men&ebabkan #2 beruba kemba'i menadi i$n i$dida. #$n i$dida
menga'ami reduksi. Da'am a' ini" Natrium >i$su'?at ber?ungsi sebagai redukt$r. Sete'a i$n
>i$su'?at abis bereaksi" #2 akan 'epas. #2 berikatan dengan #6 seingga terbentuk #-
6.
>erbentukn&a 4arna biru karena adan&a ami'um. /ada praktikum ini ami'um
ber?ungsi sebagai pendeteksi adan&a #2. arna biru terbentuk ketika #-6 mu'ai berikatan
dengan ami'um. pabi'a ami'um &ang digunakan te'a menga'ami perubaan struktur" reaksi
pada 'arutan ini tidak akan mengasi'kan 4arna biru. Ceaksi6reaksi &ang teradi pada
praktikum ini" &aitu@
2292 < 2#6
229 < 92 < #2 < 2e
#2 < 2S29-26
2#6 < S,9726
#2 < #6
#-6
#-6 < ami'um 4arna biru
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
7/9
Ceaksi akan ber'angsung 'ebi *epat apabi'a temperatur semakin tinggi. /ada >abe' 2
dapat di'iat 4aktu &ang dibutukan 'arutan untuk bereaksi pada temperatur tertentu. Dari
data tersebut" dapat disimpu'kan ba4a semakin tinggi temperatur maka 4aktu &ang
dibutukan 'arutan untuk membentuk 4arna biru pertama ka'i semakin *epat. a' ini sesuai
dengan re?erensi. Semakin tinggi temperatur maka 'au reaksi akan semakin *epat (/urba"
2007!.
Data pada >abe' 2 diana'isis dengan membandingkan k$nsentrasi idr$gen /er$ksida
&ang bereaksi dengan k$nsentrasi idr$gen /er$ksida a4a' kemudian dika'i1
t . Dari asi'
ana'isis didapatkan ni'ai 'n K. asi' ana'isis tersebut dapat di'iat pada >abe' -.
>abe' -. Data asi' /eritungan
T Awal(oC)
T Akhir(oC)
T Rata-Rata(oC)
WaktuReaksi (s)
1
T ln K
10 10 10 14,0 0,003533 -
4,9417
15 15 15 12,0 0,003472 -
4,7876
20 20 20 9,0 0,003413 -
4,499925 25 25 6,5
0,003356 -
4,1745
30 30 30 5,0 0,003300 -
3,9121
35 35 35 4,0 0,003247 -
3,6889
Dari data pada >abe' -" dapat di'iat ubungan antara1
T dan 'n K. Semakin ke*i'
arga1
T maka ni'ai 'n K akan semakin besar. Untuk mengetaui 'ebi e'as ubungan
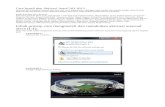
antara temperatur dan 4aktu dapat di'iat pada Gambar .
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
8/9
0 0 0 0 0 0 0 0
-6
-5
-4
-3
-2
-1
0
f(x) = - 4692.17x + 11.56
! = 0.99
Hubungan antara 1T !an ln K
1T
ln K
Gambar . ubungan antara
1
T dan 'n K
Dari Gambar dapat mempere'as pengaru temperatur teradap 'au reaksi. Semakin
ke*i' arga1T maka ni'ai 'n K akan semakin besar. Dengan kata 'ain" semakin tinggi
temperatur maka 'au reaksi akan semakin *epat. Semakin tinggi temperatur" m$'eku'6
m$'eku' &ang bereaksi akan mempun&ai energi kinetik &ang semakin besar pu'a. a' ini
men&ebabkan pergerakan partike' untuk sa'ing bertumbukan semakin besar seingga reaksi
ber'angsung 'ebi *epat. Semakin besarn&a energi kinetik ini karena adan&a tambaan energi
dari 'uar sistem. /engaru temperatur teradap 'au reaksi ini dapat digunakan untuk
menentukan besarn&a energi aktivasi &ang dibutukan pada reaksi da'am per*$baan ini
(3r&sand" 202!.
Kurva pada Gambar berbentuk 'inear dengan persamaan & : 6,58+" ; < "202 dan
CI : 0.0. #ni berarti asi' praktikum mendekati sempurna. /ersamaan & : 6,58+" ; <
"202 ini diana'isis dengan menggunakan persamaan rrenius. Dari asi' ana'isis
didapatkan arga energi aktivasi pada reaksi &ang teradi da'am praktikum ini" &aitu" sebesar
-8-+",, J=m$' atau sama dengan -8"-+,, kJ=m$' dengan ni'ai 'n : "202.
/ada tangga' 2, 9kt$ber 202" ni Kurnia4ati" se$rang maasis4a Unnes"me'akukan praktikum ini. arga a &ang didapatkan da'am praktikum tersebut" &aitu"
-
8/9/2019 Laporan Praktikum Kimia Fisika Persamaan Arrhenius dan Energi Aktivasi
9/9
,8.+87552 kJ=m$'. pabi'a dibandingkan" se'isi arga a &ang didapatkan sangat au" &aitu
0 kJ=m$' atau 0.000 J=m$'.
Se'isi ni'ai a &ang sangat au ini disebabkan karena beberapa ?akt$r. Sa'a satu
?akt$r &ang mungkin memengarui se'isi ni'ai a tersebut ada'a perbedaan tekanan udara
sekitar pada saat di'akukann&a praktikum. pabi'a tekanan udara 'ebi renda" maka
temperatur pada ruangan tersebut akan 'ebi renda pu'a. Sesuai dengan re?erensi" temperatur
berbanding terba'ik dengan energi aktivasi. Semakin tinggi temperatur maka energi aktivasi
akan semakin ke*i'. erdasarkan re?erensi" ?akt$r &ang dapat memengarui energi aktivasi"
&aitu" temperatur (>!" ?rekuensi (! dan kata'is (Sridianti" 20,!. Sedangkan ubungan antara
energi aktivasi dengan 'au reaksi ada'a berbanding terba'ik.
Ke%i&(ulan
Dari praktikum &ang te'a di'akukan dengan met$de pen&amaan tempertaur 'arutan
dengan variasi temperatur" dapat diketaui ba4a temperatur berbanding terba'ik dengan
energi aktivasi. Sedangkan ubungan antara energi aktivasi dan 'au reaksi berbanding
terba'ik pu'a. Semakin tinggi temperatur" energi aktivasi &ang dibutukan semakin ke*i'
seingga 'au reaksi semakin *epat. Fakt$r6?akt$r &ang dapat memengarui energi aktivasi"
&aitu" temperatur (>!" ?rekuensi (! dan kata'is. Dari asi' praktikum diper$'e kesimpu'an"
&aitu@ ! Kenaikan temperatur men&ebabkan 'au reaksi semakin *epatA dan 2! nergi aktivasi&ang dibutukan agar reaksi da'am per*$baan ini dapat ber'angsung" &aitu sebesar
-8"-+,, kJ=m$'.
Da)ta! Pu%taka
tkins /. . *imia )isia. disi ke62. Kartaadipr$d$ #rma #" peneremaA #ndart$ /urn$m$
a&u" edit$r. Jakarta@ r'angga. >eremaan dari@ :hysichal hemistry.
3aste''an" Gi'bert . 8-. /&si*a' 3emistr& -rd diti$n. Bassa*usetts@ ddis$n6es'e&
/ub'ising 3$mpan&.
9ktarian" 3r&sand. 202. Teori Tumbuan dan ;nergi Ativasi. Diundu dittp@==ind$erba's.*$.id=dem$=skripsikimia=page=detai'=-+=+2=te$ri6tumbukan6dan6energi6
aktivasi.tm' pada tangga' 0 9kt$ber 20,.
9;t$b&" David 4." dkk. 200. :rinsip:rinsip *imia