DASTER Elektro Kimia Fix
-
Upload
dian-arista-setiabudi -
Category
Documents
-
view
63 -
download
1
description
Transcript of DASTER Elektro Kimia Fix
I. Judul Percobaan :Analisis ElektrokimiaII. Hari / Tanggal Percobaan :Senin, 25 Mei 2015 pukul : 13.00 WIBIII. Hari/ Tanggal Selesai Percobaan :Senin , 25 Mei 2015 pukul : 16.00 WIBIV. Tujuan Percobaan :1. Menentuka potensial kimia Cu2+2. Analisis Cu2+ secara potensiometri
V. Tinjan PustakaPengukuran kuantitatif dalam kimia analitik secara umum dibedakan menjadi potensiometri (berdasarkan potensial sel) dan voltametri (berdasarkan arus sel). Potensiometri adalah istilah yang digunakan untuk menjelaskan pengukuran potensial atau voltage dari suatu sel elektrokimia yang terdiri dari elektroda dan larutan. Larutan tersebut berisi komponen utama yang mempunyai kemampuan mengion. Dasar metode potensiometri adalah membuat sel elektrik dari analit suatu larutan sehingga perbedaan potensial sel tersebut berkaitan dengan konsentrasi larutan.
Metode potensiometri digunakan untuk menentukan konsentrasi suatu ion (ion selective electrode), pH suatu larutan, dan menentukan titik akhir titrasi.Alat-alat yang diperlukan dalam metode potensiometri adalah :1. elektrode pembanding (refference electrode)
2. elektroda indikator ( indicator electrode )
3. alat pengukur potensial.
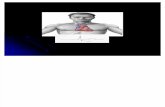
Komponen-komponen tersebut disusun membentuk suatu sel potensiometri seperti gambar berikut:
Dari gambar dapat dilihat bahwa sel potensiometri disusun dari dua setengah sel yang dihubungkan dengan jembatan garam yang berfungsi penyeimbangkan muatan larutan pada masing-masing setengah sel, selain itu juga berfungsi sebagai penghubung antara dua setengah sel tersebut. Masing-masing setengah sel terdapat elektroda yang tercelup dalam larutan elektrolit untuk ditentukan konsentrasinya oleh potensial elektrodanya. Pemisahan elektrode ini diperlukan untuk mencegah terjadinya reaksi redoks spontan dari laruan-larutan elektrolit yang digunakan dalam sel potensiometri.Potensiometri digunakan sebagai salah satu metode untuk mengukurkonsentrasi suatu larutan, dalam hal ini hubungan antara potensial sel dan konsentrasi dapat dijelaskan melalaui persamaan Nerst :
E = Eo ln QDimana: Eo : standar potensial reduksiR : konsanta gasT : temperatur ( K )n : jumlah elektron yang terlibat dalam rekasi reduksiF : konstanta faraday
Q : reaksi quosien.
Jika temperatur dalam laboratorium 298 K ,maka ln diubah ke log, maka diperoleh persamaan berikut:
E = Eo log QDimana E dinyatakan dalam satuan volt Mengingat bahwa potensial dari sel elektrokimia potensiometri adalah:Ecell = Ec EaElemen-elemen yang diperlukan dalam potensiometri antara lain adalah elektroda pembanding ( acuan ),elektroda Indikator,Jembatan garam dan larutan yang dianalisis.
Elektroda pembandingDi dalam beberapa penggunaan analisis elektrokimia, diperlukan suatu elektrode dengan harga potensial setengah sel yang diketahui, konstan, dan sama sekali tidak peka terhadap komposisi larutan yang sedang diselidiki. Suatu elektrode yang memenuhi persyaratan diatas disebut elektrode pembanding (refference electrode ). Ada dua jenis elektrode pembanding akan diuraikan berikut ini.1. Elektroda pembanding primerContoh dari elektroda jenis ini adalah elektroda hidrogen standart.Elektroda ini terbuat dari platina hitam agar penyerapan gas hidrogen pada permukaan elektroda dapat terjadi secara maksimal, sehingga reaksi
H2 ( 2H+ + 2e
Dapat berlangsung dengan cepat dan reversible. Potensial setengah sel dari elektroda pembanding primer adalah nol volt.Elektroda standart hidrogen jarang digunakan dalam proses analisis, tetapi hal ini penting karena elektroda standart yang digunakan untuk menentukan standart potensial sel pada standart setengah sel elektrokimia. Elektroda pembanding sekunderElektroda standart sekunder adalal elektroda yang sering digunakan dan banyak terdapat di pasar,karena penggunaannya yang lebih praktis. Ada dua macam elektroda standart sekunder yaitu elektroda kalomel dan elektroda perak/perak klorida.
a. Elektroda kalomelElektroda ini terbuat dari tabung gelas atau plastik dengan panjang 10cm dan garis tengah 0,5-1 cm yang dicelupkan ke dalam air raksa yang kontak dengan lapisan pasta Hg/HgCl2 yang terdapat pada tabung bagian dalam yang berisi campuran Hg, Hg2Cl2 dan KCl jenuh dan dihubungkan dengan larutan KCl jenuh melalui lubang kecil.
b. Elektroda perakElektroda pembanding yang mirip dengan elektroda calomel,terdiri dari suatu elektroda perak yang dicelupkan kedalam larutan KCI yang dijenuhkan dengan AgCI. Jika dibandingkan dengan elektroda kalomel, elektroda perak lebih unggul dalam temperatur yang tinggi. Namun, elektroda perak/perak klorida mempunyai kecenderungan untuk bereaksi dengan larutan membentuk kompleks perak yang tidak larut yang memungkinkan menyumbat jembatan garam yang menghubungkan larutan dan elektroda.
Elektroda indikatorElektroda indikator dibagi menjadi dua kategori, yaitu : elektroda logam dan elektroda membran. Elektroda logam dapat dikelompokkan ke dalam elektroda jenis pertama (first kind), elektroda jenis kedua(second kind),elektroda jenis ketiga(third kind).
a. Elektroda logamPotensial dari elektroda logam ditentukan dari posisi reaksi redoks ketika elektroda dan larutan bertemu.terdapat tiga macam elektroda logam yaitu elektroda logam jenis pertama, elektroda logam jenis kedua, dan elektroda logam jenis ketiga. Elektroda jenis pertamaElektroda jenis pertama adalah elektroda yang langsung berkeseimbangan dengan kation yang berasal dari logam tersebut .Contoh,elektroda tembaga.Cu2+ + 2e ( Cu(s) Elektroda jenis keduaElektroda jenis kedua adalah elektroda yang harga potensialnya bergantung pada konsentrasi suatu anion yang dengan ion yang berasal dari elektroda endapan suatu ion kompleks yang stabil.contoh elektroda perak untuk halida, reaksinya dapat ditulis,AgCl(s) ( Ag(s) + Cl
Elektroda jenis ketigaElektroda jenis ketiga adalah elektroda logam yang harga potensialnya bergantung pada konsentrasi ion logam lain.Contoh, elektroda Hg dapatdigunakan untuk menentukan konsentrasi Ca2+ , Zn2+ ,atau Cd2+ yang terdapat dalam larutan.
Elektroda membranElektroda membran telah digunakan dan dikembangakan cukup luas,karena dapat menentukan ion tertentu. Elektroda membran biasa disebut dengan elektroda selektif ion (ion selective electrode).Elektroda membran juga digunakan untuk penentuan pH dengan mengukur perbedaan potensial antara larutan pembanding yang keasamannya tetap dan larutan yang dianalisis.Elektroda membran dibagi empat macam yaitu elektroda membran kaca,elektroda membran cairan, elektroda padatan dan elektroda penunjuk gas.
a. Elektroda membran kacaKualitas paling bagus yang dijual dipasaran untuk elektroda membran kaca terbuat dari Corning 015, sebuah kaca yang terdiri dari 22% Na20, 6% CaO,dan 72% SiO. Ketika dicelupkan ke dalam larutan berair, maka pada bagian luar dari membran akan terhidrat sampai 10nm sampai beberapa jam. Hasil hidrasi dari membran menghasilkan muatan negatif, hal ini merupakan bagian dari fungsi kerja membran silika. Ion natrium, yang mampu bergerak menembus lapisan hidrat berfungsi sebagai ion penghitung. Ion hidrogen dari larutan berdifusi kedalam membran dan membentuk ikatan yang lebih kuat dengan membran sehingga mampu menggeser keberadaan ion Na+ yang mengakibatkan konsentrasiion H+ meningkat pada membran .Elektroda membran kaca sering dijual dalam bentuk kombinasi antara indikator dan elektroda pembanding. Penggunaan satu elektroda sangat bermanfaat untuk pengukuran pH.Kelebihan elektroda kaca : Larutan uji tidak terkontaminasi
Zat-zat yang tidak mudah teroksidasi & tereduksi tidak berinteferensi
Elektroda ini bisa dibuat cukup kecil untuk disisipkan dalam volume larutan yang sangat kecil.
Tidak ada permukaan katalitis yang kehilangan aktivitasnya oleh kontaminasi seperti platina pada elektroda hidrogen.
Kelemahan elektroda kaca yaitu Pada kondisi pH yang sangat tinggi (misal NaOH 0,1M dengan pH = 13) berakibat : spesifisitas untuk H+ hilang
Ketergatungan tegangan pH berkurang
Potensial menjadi tergantung pada Na+b. Elektroda membran padatElektroda ini menggunakan polikristal yang terdiri dari satuan kristal garam anorganik. Elektroda selektif ion polikristal ini dibentuk dari pelet tipis Ag2S atau campuran dari Ag2S dan garam perak atau logam sulfida.
c. Elektroda membran cairElektroda membran cair adalah suatu fasa cair spesifik yang dibatasi oleh suatu dinding yang berpori inert. Cairan spesifik tersebut terdiri atas senyawa organik dengan berat molekul yang tinggi,tidak larut dalam air dan memiliki struktur yang memungkinkan terjadinya pertukaran ion antara ion bebas dalam larutan yang diukur dengan ion-ion yang terletak pada pusat kedudukan molekul cairan spesifik tersebut contoh: Na+ , K ,Ca2+ , Pb2+d. Elektroda penunjuk gasElektroda ini dirancang untuk mendeteksi konsentrasi gas yang terlarut dalam larutan.Kelebihan dan Kelemahan Potensiometri
Kelebihan metode potensiometri
1. Bisa dilakukan untuk semua titrasi
2. Kurva titrasi berhubungan antara potensial terhadap volume titran Kekurangan metode potensiometri
1. Diperlukan pencampuran yang akurat dari volume standar maupun sampel yang akan diukur.
2. Diperlukan perhitungan yang lebih rumit.
3. Konsentrasi sampel harus diketahui
VI. ALAT DAN BAHAN
Alat :
1. pH meter
2. Gelas kimia
3. Gelas ukur
4. Labu ukur
5. Pipet gondok
Bahan :
1. Larutan CuSO4 0,1 M
2. Aquades
3. Larutan sampel Cu2+4. Larutan standar (10-3, 2.10-3, 8.10-3, 16.10-3) MVII. Alur Kerja
VIII. Hasil Pengamatan
No. PercbProsedur KerjaHasil PengamatanDugaan/ReaksiKesimpulan
SebelumSesudah
1.
Alur Kerja
-larutan CuSO4 : larutan bewarna biru
-aquades : larutan tak berwarna
-larutan sampel Cu2+ : larutan bewarna biru- 10-3M:
larutan bewarna biruV= 4,62
31,1oC
-2.10-3M : larutan bewarna biru (+)V= 4,62
31,7oC
-4.10-3M :
larutan bewarna biru (++)V= 4,97
31,3oC
-8.10-3M :
larutan bewarna biru (+++)V= 5,26
31,3oC
-16.10-3M
larutan bewarna biru (++++)V= 5,43
31,0oC
-Sampel :
V= 5,63
31,0oC
-Cu (Cu2+ + 2e--4H+ + O2 + 4e- ( 2H2O
Eo Cu2+/Cu
-Konsentrasi sampel : 0,03169 M
-jumlah elektron : 0,09
IX. Analisis dan PembahasanPercobaan ini bertujuan untuk menentukan potensial kimia Cu2+ dan analisis Cu2+ secara potensiometri. Prinsip dasar analisis potensiometri adalah interaksi antra analit dengan elektroda. Dalam percobaan ini analit yang digunakan yaitu larutan tembaga sulfat. Langkah pertama yaitu larutan tembaga sulfat 0,1 molar dilarutan dengan aquades menjadi beberapa konsentrasi yaitu, 10-3 M,2x10-3 M, 4x10-3 M, 8x10-3 M, dan 1.6x10-3M. Kemudian larutan CuSO4 dengan beberapa macam konsentrasi ini diukur potensial standarnya dengan menggunakan pH- meter. Pengukuran potensial pada larutan standar ini bertujuan untuk menentukan dan mengetahui nilai potensial satandar dari larutan standar yang telah dibuat.
Larutan standar yang memiliki konsentrasi 10-3 M, 2x10-3 M, 4x10-3 M, 8x10-3 M, dan 1.6x10-3Msetelah diukur potensialnya diperoleh nilai dalam satuan Volt 4,62; 4,62 ; 4,97 ; 5,26 ; dan5,43 secara berturut-turut dari konsentrasi 10-3 M hingga 1.6x10-3M .
Larutan standar CuSO4 ini nantinya akan dijadikan sebagai acuan untuk menentukan rentang konsentrasi Cu2+ pada sampel dengan bantuan nilai potensial standar dari larutan standar. Larutan sampel Cu2+ ini juga diukur nilai potensial standarnya. Dari percobaan yang telah dilakukan diperoleh nilai potensial standar sampel Cu2+ sebesar 5,63V. Dengan hasil nilai potensial standar dari sampel, maka sampel dapat diketahui konsentrasinya melalui persamaan grafik antara ln [Cu2+] dengan potensial standar dari larutan standar. Dari data hasil percobaan didapat grafik antara ln [Cu2+] dengan potensial standar dari larutan standar sebagai berikut:
Dari grafik diatas didapat persamaan garisy = 0,029x + 6.631. Berdasarkan grafik diatas dapat diketahui :
Persamaan regresi linier y = Y=0.29x+6.631
R = 0,984
Dengan (y) merupakan potensial sampel dan (x) merupakan ln[sampel B] maka,Potensial sampel (y)= 5.631. Menghitung konsentrasi [cu2+]
Y= a ln [cu2+] + b
5.63=0.29 ln [cu2+] + 6.631
5.63-6.631=0.29 ln [cu2+]
-0.1001=0.29 ln [cu2+]
-0.1001/0.29= ln [cu2+]
-3.4517= ln [cu2+]
0.03169= [cu2+]
2. menghitung jumlah elektron
y=ax+b
y=0.29x+6.631
E [cu2+]/cu=RT/nF ln [cu2+]+E [cu2+]/cu
RT/nF= a
8.314304/n96500=0.29
2527.456=27985n
N=2527.456/27985
N=0.09
Dari reaksi yang terjadi elektron yang telibat dalam reaksi tersebut tidak sesuai dengan teori yang diharapkan, elektron yang terlibat dalam reaksi seharusnya sebanyak 2, namun setelah dilakukan percobaan dan perhitungan dalam mencari elektron yang terlibat dalam reaksi didapatkan sebanyak 1. Hal ini disebabkan oleh beberapa faktor sehingga menyebabkan hasil percobaan tidak sesuai dengan teori yang diharapkan. Adapun faktor penyebab hal tersebut yaitu, dalam percobaan saat pengambilan larutan Cu2+ mengunakan dua pipet ukur yang berbeda skalanya sehingga dalam hal pengenceran tidak diperoleh standar yang sama dan mempengaruhi hasil pengukuran potensial, sehingga hal tersebut mengakibatkan tidak sesuainya hasil yang diperoleh dalam mencari elektron yang terlibat dalam reaksi elektrokimia.
X. KESIMPULAN
Dari hasil percobaan yang telah dilakukan dapat disimpulkan bahwa:
1. Potensial kimia dari sampel larutan Cu2+ sebesar 5,63V2. Konsentrasi sampel larutan Cu2+ adalah 0.03169M
3. Konsentrasi sampel larutan dapat ditentukan berdasarkan nilai potensial larutan standar.
4. Elektron yang terlibat dalam reaksi seharusnya 2 elektron, namun dari hasil percobaan didapatkan bahwa elektron yang terlibat dalam reaksi hanya sebanyak 1 elektron. Hal ini berbeda dengan nilai teoritis yang diharapkan.
XI. Jawaban Pertanyaan
1. Tuliskan persamaan regresi linier dari hubungan variabel x sebagai konsentrasi dan y sebagai potensial!
Jawaban :
Persamaan regresi linier :
y = 0.29x + 6.631
R2= 0.984
Sampel A memiliki konsentrasi 0.03169 M
y= a ln [cu2+] + b
5.63=0.29 ln [cu2+] + 6.631
5.63-6.631=0.29 ln [cu2+]
-0.1001=0.29 ln [cu2+]
-0.1001/0.29= ln [cu2+]
-3.4517= ln [cu2+]
0.03169= [cu2+]
Jadi konsentrasi sampel A = 2. Bagaimana caranya menentukan jumlah elektron yang terlibat dalam reaksi?Jelaskan!
Jawaban :
y= ax+b
y= 0.29x+6.631
E [cu2+]/cu= RT/nF ln [cu2+]+E [cu2+]/cu
= a
= 0.29
2527.456= 27985 n
n=n= 0.09
3. Dapatkan konsentrasi Cu2+ dari harga pH?Jelaskan!
Jawaban :
Eosel = Eoreduksi - Eooksidasi
4. Tentukan konstanta kesetimbangan Cu2+ menjadi Cu!
Jawaban :
Konstanta kesetimbangan Cu2+ menjadi Cu:
k =
XII. Daftar PustakaBasset, J. 1994.Vogel Analisa Kuantitatif Anorganik. Jakarta : Erlangga
Day, R.A.JR. & Underwood, A.L. 1998.Analisis Kimia Kuantitatif Edisi
Keenam. Jakarta: Erlangga.
Harizzul, R. 1995.Asas Pemeriksaan Kimia.Jakarta: UI Press.
Khopkar. 1990.Konsep Dasar Kimia Analitik. Jakarta : Universitas Indonesia
Setiarso Pirim,dkk.2015.Penuntun Praktikum Kimia Analitik II(DDPK).Surabaya: FMIPA UNESAPringgodigdo. 1977.Ensiklopedia Umum.Jakarta : Erlangga
Lampiran FotoNoDokumentasiKeterangan
1.
Ini larutan CuSO4 yang moritasnya 10-3 yag dilarutkan
2.
Ini larutan CuSO4 10-3 yang dimasukkan ke dalam gelas kimia
3.
Ini larutan CuSO4 10-3 yang di ukur dengan Ph meter
4.
Ini larutan CuSO4 yang moritasnya 2.10-3 yag dilarutkan
5.
Ini larutan CuSO4 2.10-3 yang dimasukkan ke dalam gelas kimia
6.
Ini larutan CuSO4 2.10-3 yang di ukur dengan Ph meter
7.
Ini larutan CuSO4 4.10-3 yang dimasukkan ke dalam gelas kimia
8.Ini larutan CuSO4 4.10-3 yang di ukur dengan Ph meter
9.
Ini larutan CuSO4 8.10-3 yang di ukur dengan Ph meter
10.
Ini larutan CuSO4 16.10-3 yang dimasukkan ke dalam gelas kimia
11.
Ini larutan CuSO4 16.10-3 yang di ukur dengan Ph meter
Konsentrasi sampel dan elektron
-dmasukkan dalam tabel dibuat grafik konsentrasi vs E ditentukan konsentrasi sampel ditentukan jumlah elektron yang terlibat
-diukur potensial dengan menggunakan pH meter
Potensial (v)
8.10-3M
Sampel
16.10-3M
4.10-3M
2.10-3M
10-3M
Sampel
16.10-3M
8.10-3M
4.10-3M
2.10-3M
10-3M
-dimasukkan dalam tabel dibuat grafik konsentrasi vs E ditentukan konsentrasi sampel ditentukan jumlah elektron yang terlibat
Konsentrasi sampel dan elektron
-diukur potensial dengan menggunakan pH meter
Potensial (v)