Atom
description
Transcript of Atom

ATOM, ION, DAN MOLEKUL
DI DALAM TUBUH
Oleh :
GINNAR MAYANG (20131660034)
SISKA MIRANTI (20131660032)
SUWARDI (20131660035)
S1 KEPERAWATAN PROGSUS
FIK UNIVERSITAS MUHAMMADIYAH SURABAYA
2013

ATOM, ION, DAN MOLEKUL DI DALAM TUBUH (TEORI ATOM)
I. FOKUS KEPERAWATAN
“Apakah ada gunanya bagi perawat mempelajari struktur dan perilaku atom?”. Pertanyaan ini
seringkali diajukan oleh perawat mahasiswa dan terkadang oleh perawat pendidik juga. Tentu
saja, diperlukan rentang imajinasi yang cukup luas untuk melihat bagaimana atom dan
karakteristiknya, yang dipelajari di kelas, imajinasi ini dipergunakan saat kita berada di dunia
pekerjaan yang “nyata”. Misalnya ketika merawat seorang pasien yang baru saja menjalani
pembedahan abdomen, perawat berupaya untuk meredakan nyeri, mengukur tekanan darah,
dsb. Perawat akan tertarik mengerjakan sesuatu yang dapat membuat pasien merasa
senyaman mungkin dan memantau pemulihan mereka. Untuk dapat melakukannya seefektif
mungkin, perawat professional perlu memahami proses yang begitu kompleks yang
berlangsung dalam tubuh pasien yang tengah dirawat. Lagipula, manusia pada dasarnya
terbentuk dari kumpulan atom! Kumpulan atom tersebut memang sangat menakjubkan,
sangat terorganisasi dan sangat efisien, tetapi tetap saja atom.
Seperti yang akan segera kita saksikan, jumlah sebenarnya jumlah atom yang ada sangat
sedikit, tetapi atom berinteraksi, berubah, dan bersatu dalam suatu cara yang khusus untuk
membentuk mahkluk yang sangat fantastik ini. Bagaimana kita sebagai perawat dapat
memberikan perawatan yang bermutu tinggi dan menyeluruh tanpa memiliki pengetahuan
mengenai atom yang membentuk manusia yang tengah kita rawat ini?
Contoh, pikiran tentang elektrolit, yang seringkali dibahas, terutama dalam kondisi darurat
seperti henti jantung. Ketidakseimbangan elektrolit dapat berakibat fatal sehingga sampel
darah perlu diambil untuk memeriksa kondisi elektrolit itu. Apakah sebenarnya elektrolit itu?
Apa hubungan elektrolit dengan kelompok besar zat yang lainnya yang juga dapat
menimbulkan begitu banyak masalah asam dan basa? Sekali lagi, ketidakseimbangan zat
tersebut didalam tubuh dapat mengakibatkan kematian.
Pada beberapa tahun belakangan ini banyak perhatian yang difokuskan pada pertanyaan
seputar diet. Diet ternyata merupakan berbagai masalah yang ada. Apakah anda tahu makna
sebenarnya dari istilah “lemak tak jenuh ganda” dari segi atom dan molekulnya? Zat tersebut
mungkin dianjurkan untuk dijadikan bagian dalam diet pasien. Perawat seringkali meminta
saran dan bimbingan mengenai masalah ini dan ia harus dibekali dengan pengetahuan yang
memadai sehingga dapat melaksanakan tugas tersebut.

II. ATOM DAN TUBUH
Dua atom atau lebih dapat bergabung untuk membentuk molekul, yang juga memiliki ukuran
sangat kecil. Mari kita pikirkan dengan membayangkan molekul air. Bayangkan anda
mengambil segelas air dan menuangkannya ke dalam samudera pasifik. Kemudian,
bayangkan air tersebut bercampur rata dengan semua air lain dalam samudera pasifik
sehingga partikel yang paling kecil dari air dalam gelas kitapun akan menyebar mulai dari
rusia sampai antartika dan dari australia sampai amerika selatan. Jika sekarang kita
mengambil segelas air dari samudera pasifik disalah satu lokasi di atas, di dalam gelas itu
akan kita temukan beberapa ratus partikel yang berasal dari air dalam gelas pertama kita!
“Partikel” dasar dari air tersebut ( dan zat yang lain ) merupakan molekul. Masing-masing
molekul air terdiri dari tiga atom – dua atom hidrogen dan satu atom oksigen.
Jika semua atom pada bagian tertentu dari suatu materi ternyata identik, maka materi tersebut
dinyatakan tersusun dari satu unsur kimia tunggal. Atom merupakan bagian terkecil dari
suatu unsur mempertahankan karakteristik kimiawi dari unsur tersebut.
Dengan demikian, unsur dapat didefinisikan sebagai suatu zat yang tidak dapat di uraikan
kembali menjadi zat yang lebih sederhana dengan cara apapun.
III. UNSUR YANG MEMBENTUK TUBUH MANUSIA
1. Yodium / I
Zat mineral yodium biasanya terdapat pada garam dapur yang tersedia bebas di pasaran,
namun tidak semua jenis dan merk garam dapur mengandung yodium. Yodium berperan
penting untuk membantu perkembangan kecerdasan atau kepandaian pada anak. Yodium
juga dapat membatu mencegah penyakit gondok, gondong atau gondongan. Yodium
berfungsi untuk membentuk zat tirosin yang terbentuk pada kelenjar tiroid.
2. Oksigen / O
Diperlukan untuk pernafasan sel, terkandung dalam sebagian besar senyawa organik,
misalnya bahan makanan.
3. Phospor / Fosfor / P
Fosfor berfungsi untuk pembentukan tulang dan membentuk gigi.
4. Cobalt / Kobal / Kobalt / Co
Cobalt memiliki fungsi untuk membentuk pembuluh darah serta pembangun B.
5. Chlor / CL
Chlor digunakan tubuh kita untuk membentuk HCl atau asam klorida pada lambung. HCl

memiliki kegunaAn membunuh kuman bibit penyakit dalam lambung dan juga
mengaktifkan pepsinogen menjadi pepsin.
6. Magnesium / Mg
Fungsi atau kegunaan dari magnesium adalah sebagai zat yang membentuk sel darah
merah berupa zat pengikat oksigen dan hemoglobin.
7. Mangaan / Mangan / Mn
Mangaan berfungsi untuk mengatur pertumbuhan tubuh kita dan sistem reproduksi.
8. Tembaga / Cuprum / Cu
Tembaga pada tubuh manusia berguna sebagai pembentuk hemo globin pada sel darah
merah.
9. Kalsium
Kalsium atau disebut juga zat kapur adalah zat mineral yang mempunyai fungsi dalam
membentuk tulang dan gigi serta memiliki peran dalam vitalitas otot pada tubuh
10. Kalium / K
Kalium kita butuhkan sebagai pembentuk aktivitas otot jantung.
11. Zincum / Zinc / Seng / Zn
Seng oleh tubuh manusia dibutuhkan untuk membentuk enzim dan hormon penting.
Selain itu zinc juga berfungsi sebagai pemelihara beberapa jenis enzim, hormon dan
aktifitas indera pengecap atau lidah kita.
12. Sulfur atau Belerang
Zat ini memiliki andil dalam membentuk protenin di dalam tubuh.
13. Natrium / Na
Natrium adalah zat mineral yang kita andalkan sebagai pembentuk faram di dalam tubuh
dan sebagai penghantar impuls dalam serabut syaraf dan tekana osmosis pada sel yang
menjaga keseimbangan cairan sel dengan cairan yang ada di sekitarnya.
14. Flour / F
Flour berperan untuk pembentuk lapisan email gigi yang melindungi dari segala macam
gangguan pada gigi.
IV. UNSUR KIMIA DALAM TUBUH
Zink: Komponen dalam beberapa enzim. Keberadaannya dalam air liur sangat diperlukan
untuk tumbuh kembang normal kuncup pengecap. Unsur ini juga penting untuk pertumbuhan,

perkembangan seksual, dan ketajaman pengecapan. Zink berperan penting dalam sintesis
protein dan dalam pembelahan sel.
Tembaga: Di temukan dalam beberapa enzim yang terlibat dalam suatu proses yang di sebut
oksidasi.
Selinium: Fungsi satu-satunya yang di ketahui adalah sebagai konstituen glotation
peroksidase, yang mengeluarkan hidrogen teroksidase dan organik teroksidase. Selenium di
yakini berkaitan erat dengan fungsi vitamin E.
Mangan: Suatu kofaktor untuk beberapa enzim, mangan terkosentrasi dalam hati dan ginjal
terutama dalam mitokondrianya.
Molibdenum: Komponen dalam beberapa enzin yang fungsinya sama dengan tembaga di
atas.Unsur ini juga di perlukan untuk pertumbuhan normal.
Kobalt: Fungsi biologis satu-satunya yang di ketahui adalah sebagai konsitituen dalam
vitamin b12 yang di butuhkan untuk kematangan eritrosit (sel darah merah).
Flour: Sangat penting bagi kesehatan gigi. Flour dalam bentuk ion fluorida bergabung
menjadi kristal hidroksiapatit pada email gigi, membuat gigi menjadi lebih resisten terhadap
pengaruh normal yang menyebabkan email menjadi terkikis dan berkaries. Flour juga
tergabung dalam stuktur tulang.
V. MOLEKUL
Bagian terkecil dari suatu unsur atau gabungan unsur yang dapat memiliki keberadaan
terpisah. Sebuah molekul tersusun dari satu atau beberapa atom.
Beberapa untsur hanya memiliki satu atom dalam setiap molekulnya, misalnya golongan
logam dan gas langka seperti helium, neon, argon, kripton dan xenon, sedangkan lainnya
memiliki dua atom per molekul misalnya oksigen, nitrogen, dan chlor.
Molekul dari berbagai zat mampu bereaksi bersama dalam kondisi tertentu untuk membentuk
molekul jenis yang baru. Alasannya di lakukannya proses tersebut dan memang, alasan
mengapa unsur dan campuran unsur selalu membentuk molekul.

VI. SIFAT KIMIA DAN FISIKA
Zat terkadang dikenali berdasarkan sifat kimianya. Sifat kimia menjelaskan cara setiap zat
melakukan perubahan baik dengan sendirinya atau akibat interaksi dengan zat lain untuk
membentuk zat yang baru. Perubahan semacam itu disebut reaksi kimia.
Sifat kimia semacam itu dapat di tentukan tanpa mengubah ciri khas dari unsur tersebut dan
mencakup :
Tidak lebur, suhu yang diperlukan untuk mengubah suatu zat dari bentuk padat
menjadi bentuk cair. Istilah ini identik dengan istilah titik beku.
Titik didih, suhu yang diperlukan untuk mendidihkan cairan dan mengubahnya
menjadi gas
Densitas atau kepadatan, massa zat pada volume yang pasti
Solubilitas atau keterlarutan, sampai sejauh mana zat dapat larut dalalm solven atau
pelarut tertentu.
VII. CAMPURAN
Suatu campuran dibentuk oleh dua unsur atau lebih yang bergabung dengan proporsi yang
berapapun besarnya. Campuran masih mempertahankan sifat individualnya.
Campuran juga dapat terdiri dari senyawa senyawa yang saling bercampuran berapapun
besarnya proporsis nyawa itu, atau unsur dan senyawa yang bergabung dalam proporsi yang
berapapun besarnya. Udara merupakan campuran gas, minyak bumi merupakan campuran
cairan, dan tanah merupakan campuran zat padat.
Istilah “campuran” memiliki aplikasi farmasi yang akan segera dikenali anda. Dalam
menangani batuk pilek, misalnya sejumlah zat diketahui memiliki efek menguntungkan bagi
penderita kondisi itu, contoh pseudoefedrin hidroclorida, atropin sulfat, dan scopolamin
hidrobromida, digabung untuk membentuk campuran tunggal. Masing-masing zat tersebut
begitu tertelan, akan melakukan fungsi khususnya, mengeringkan sekresi, meredakan batuk,
dsb.

VIII. SENYAWA
Suatu zat yang terbentuk dari penggabungan unsur-unsur dengan pembagian tertentu.
Senyawa dihasilkan dari reaksi kimia antara dua unsur atau lebih melalui reaksi
pembentukan. Misalnya, karat besi (hematit) berupa Fe2O3 dihasilkan oleh reaksi besi (Fe)
dengan oksigen (O). Senyawa dapat diuraikan menjadi unsur-unsur pembentuknya melalui
reaksi penguraian.
Senyawa mempunyai sifat yang berbeda dengan unsur-unsur pembentuknya. Senyawa hanya
dapt diuraikan menjadi unsur-unsur pembentuknya melalui reaksi kimia. Pada kondisi yang
sama, senyawa dapat memiliki wujud berbeda dengan unsur-unsur pembentuknya. Sifat fisika
dan kimia senyawa berbeda dengan unsur-unsur pembentuknya. Misalnya reaksi antara gas
hidrogen dan gas oksigen membentuk senyawa air yang berwujud cair.
Senyawa adalah zat tunggal yang terdiri atas beberapa unsur yang saling kait-mengait.
Senyawa dibentuk dari minimal 2 unsur yang berbeda. Walaupun dibentuk dari unsur yang
berbeda, namun senyawa tetap disebut zat tunggal, karena sifat-sifat unsur yang
membentuknya tidak dapat di temukan pada senyawa. Dengan kata lain
Senyawa telah menjelma menjadi zat yang baru.
Contoh:
Reaksi antara Hidrogen(H) dan oksigen (O2), diperoleh zat baru yang disebut air, yaitu:
H + O2 ——–> H2O
Pada reaksi tersebut, dihasilkan zat baru yang sifatnya berbeda dari unsur-unsur
penyusunnya.
Hidrogen adalah gas yang sangat ringan dan mudah terbakar, sedangkan oksigen adalah gas
yang terdapat di udara yang sangat diperlukan tubuh kita untuk pembakaran. Tampak jelas
bahwa sifat air berbeda dengan sifat hidrogen dan oksigen.
Ciri khas senyawa adalah dia mempunyai perbandingan massa penyusun yang tetap, air
tersusun dari oksigen dan hidrogen dengan perbandingan massa unsur oksigen banding
hidrogen adalah selalu 8 : 1

IX. ELEKTRON DAN ATOM
Kita telah mengetahui bahwa beberapa atom bergabung dalam pasangan dan kita tahu bahwa
atom mampu bereaksi bersama untuk membentuk senyawa. Setiap sel pada tubuh dan setiap
struktur dalam sel tersebut, bergantung pada kemampuan atom untuk bergabung membentuk
senyawa atom tersebut diperoleh dari makanan yang kita peroleh dan udara yang kita hirup.
Elektron-elektron didalam unsur tersusun sedemikian rupa, sehingga jumlah maksimum
elektronnya yang dapat ditampung dalam tiga tingkatan energi pertama, atau “kulit”, antara
lain :
2 dalam tingkatan energi pertama
8 dalam tingkatan energi kedua
8 dalam tingkatan energi ketiga
X. PENGIKATAN
Keberadaan molekul suatu unsur dan senyawa bergantung pada pembentukan beberapa jenis
ikatan yang mampu mempertahankan kesatuan atom atau ion. Ikatan semacam itu disebut
ikatan kimia yang ragam jenisnya akan dibahas.
Cara atom menjalankan perubahan sehingga memiliki kulit elektron terluar yang lengkap,
antara lain
Dengan berbagi elektron untuk membentuk ikatan kofalen.
Dengan melepas satu atau beberapa elektron terluar. Saat peristiwa ini terjadi, akan
terbentuk ion yang positif. Ion tersebut akan memiliki satu muatan positif jika hanya
satu elektron yang terlepas, dua muatan positif jika ada dua elektron yang terlepas.
Dengan menarik satu atau beberapa elektron untuk membentuk ion negatif. Ion ini
akan memiliki satu muatan negatif jika hanya satu elektron yang ditarik, dua muatan
negatif jika dua elektron elektron tertarik dsb.
Ikatan jenis lainnya memang ada, misalnya ikatan yang menyatukan logam dan es, tetapi
disini kita hanya akan membahas jenis ikatan yang utama.
Pemakaian elektron secara bersama (ikatan kovalen)
Ikatan kovalen dan energi
Ikatan ganda
Pertukaran elektron (ikatan ion atau ikatan elektron valen)
Pada saat ini telah ditemukan lebih dari seratus unsur dan begitu banyak senyawa kimia yang
telah disintesis. Bagaimana agar kita mudah mempelajari unsur-unsur itu? Para ahli kimia

telah mengelompokkan unsur-unsur berdasarkan
sifat-sifat kimia dan fisika yang mirip atau sama. Untuk mempelajari pengelompokan unsur-
unsur berdasarkan sifatnya dapat digunakan tabel periodik unsur. Tabel periodik unsur
berkembang mulai dari cara pengelompokan yang sederhana sampai yang lengkap. Tabel
periodik yang digunakan sekarang adalah tabel periodik modern yang disusun berdasarkan
kenaikan nomor atom dan kemiripan sifat unsur. Pada tabel periodik modern, unsur-unsur
dikelompokkan dalam golongan dan periode. Pada tabel periodik unsur, lambang unsur
dilengkapi dengan nomor atom dan massa atom. Dari data tersebut kita dapat menentukan
struktur atom suatu unsur seperti jumlah proton, neutron, elektron, dan konfigurasi
elektronnya. Dalam tabel periodik unsur kita dapat mempelajari sifat unsur seperti logam,
metaloid, nonlogam, dan sifat periodik yaitu jari-jari, energi ionisasi, afinitas elektron, dan
keelektronegatifan.
A. Perkembangan Tabel
Pengelompokan unsur-unsur dimulai oleh Antoine Lavoisier yang mengelompokkan unsur
menjadi logam dan bukan logam. Selanjutnya pengelompokan unsur berkembang dalam
berbagai bentuk dan dikenal dengan Triade Dobereiner, Oktaf Newlands, Tabel Periodik
Unsur Lothar Meyer dan Mendeleev, serta Tabel Periodik Unsur Modern.
B. Golongan, Periode, Nomor Atom, Nomor Massa, dan Massa Atom Relatif dalam Tabel
Periodik Unsur
Pada tabel periodik unsur, unsur-unsur dikelompokkan dalam golongan dan periode. Setiap
lambang unsur dilengkapi dengan nomor atom, nomor massa atau massa atom relatif.
1. Golongan dan Periode
Pada tabel periodik unsur, lajur vertikal menunjukkan golongan unsur-unsur, sedangkan lajur
horisontal menunjukkan periode.
a. Golongan
Pada tabel periodik unsur dikelompokkan menjadi golongan utama atau golongan A dan
golongan transisi atau golongan B.
Golongan utama terdiri dari 8 golongan yaitu golongan IA sampai dengan VIIIA. Golongan
unsur transisi terdiri dari 8 golongan yaitu golongan IB sampai dengan VIIIB. Untuk
golongan VIIIB terdiri dari 3 lajur vertikal, sedangkan golongan lainnya masing-masing 1
lajur vertikal. Unsur transisi berada di antara golongan IIA dan IIIA. Semua unsur transisi

bersifat logam dan banyak digunakan dalam kehidupan sehari-hari seperti Fe, Zn, Cu, Ni, Au,
Cr, Mn, dan Ag.
b. Periode
Berapa jumlah periode pada tabel periodik dan berapa unsur yang terdapat pada masing-
masing periode?
Tabel periodik unsur terdiri dari 7 periode dan dua deret unsur terpisah di bawah yaitu deret
lantanida danaktinida. Tiap periode terdiri dari beberapa unsur dengan jumlah yang berbeda-
beda yaitu sebagai berikut.
1) Periode kesatu terdiri dari dua unsur yaitu H dan He.
2) Periode kedua terdiri dari 8 unsur yaitu: Li, Be, B, C, N, O, F, Ne.
3) Periode ketiga terdiri dari 8 unsur.
4) Periode keempat 18 unsur.
5) Periode kelima 18 unsur.
6) Unsur pada periode keenam terdiri dari unsur yang ada pada tabel utama ditambah unsur-
unsur pada deret lantanida (no. 57-71), sehingga jumlahnya menjadi 32 unsur.
7) Unsur pada periode ketujuh juga terdiri dari unsur pada tabel utama ditambah unsur pada
deret aktinida (no. 89 – 103), sampai saat ini jumlahnya 28 unsur. Dengan ditemukannya
unsur baru maka jumlah unsur dalam periode ini akan bertambah terus.
2. Nomor Atom dan Nomor Massa
Lambang atom yang dilengkapi nomor atom dan nomor massa dapat dituliskan dengan notasi
sebagai berikut.
X = lambang atom
Z = nomor atom
A = nomor massa
Atom memiliki partikel-partikel penyusun atom yaitu proton, neutron, dan elektron. Proton
bermuatan positif, neutron bersifat netral, dan elektron bermuatan negatif. Apa makna dari
nomor atom dan nomor massa pada lambang suatu unsur?
Untuk memahami makna nomor atom dan nomor massa, coba lakukan kegiatan 1.4.
Jumlah partikel dasar pada atom berhubungan dengan nomor atom dan nomor massa unsur.
Dari Tabel 1.5 dapat disimpulkan hubungan antara nomor atom dengan partikel-partikel dasar
atom dan hubungan nomor massa dengan partikel- partikel dalam atom yaitu sebagai berikut.
Nomor atom (Z) = Jumlah proton atau jumlah elektron
Nomor massa (A) = Jumlah proton + jumlah neutron

= Jumlah nukleon
Jumlah neutron adalah selisih nomor massa dengan nomor atom.
Jumlah neutron = A – Z
3. Isotop, Isoton, dan Isobar
Salah satu teori atom menurut Dalton menyatakan bahwa atom-atom unsur akan mempunyai
sifat yang sama. Pendapat ini tidak sepenuhnya benar setelah ditemukan spektrograf massa
oleh F.W. Aston tahun 1919. Ternyata kebanyakan unsur-unsur dalam senyawa mempunyai
massa atom yang berbeda. Misalnya untuk klor ada yang memiliki massa 35 sma, 36 sma,
dan 37 sma. Selain itu, ada pula unsur-unsur yang berbeda tetapi mempunyai jumlah partikel
yang sama.
4. Massa Atom Relatif
Massa atom relatif dalam kimia sangat penting untuk mengetahui sifat unsur atau senyawa.
Bagaimana cara menentukan massa atom relatif? Massa atom relatif yaitu bilangan yang
menyatakan perbandingan massa atom unsur tersebut dengan massa atom yang dijadikan
standar. Mula- mula dipilih hidrogen sebagai atom standar karena merupakan atom teringan.
Kemudian diganti oleh oksigen karena atom oksigen dapat bersenyawa dengan atom lain.
Syarat atom yang massa atomnya dijadikan standar adalah harus atom yang stabil dan murni,
maka ditetapkan atom C-12 sebagai standar. Atom C-12 memiliki massa 12 satuan massa
atom (sma). 1 sma sama dengan 1/12 kali massa 1 atom C-12.
Massa atom relatif diberi lambang Ar dan dapat ditentukan dengan menggunakan rumus
sebagai berikut.
Ar unsur X = Massa 1 atom unsur X / 1/12 massa atom C12
Jadi massa atom relatif suatu unsur adalah perbandingan massa satu atom unsur tersebut
dengan 1/12 kali massa satu atom C-12.
C. Perkembangan Teori Atom
Atom merupakan partikel terkecil dari suatu unsur. Pada setiap partikel atom terdapat partikel
penyusun atom yang terdiri dari elektron, proton, dan neutron. Gambaran posisi dan susunan
partikel penyusun atom dalam suatu atom
berkembang dari temuan-temuan yang paling sederhana sampai yang rumit tetapi dapat
menggambarkan model atom yang sebenarnya. Gambaran ini disebut juga teori atom. Teori
atom sudah diungkapkan para ahli mulai dari beberapa abad
yang lalu.
Perkembangan teori atom dapat dijelaskan sebagai berikut.
1. Teori Atom Dalton

John Dalton pada tahun 1808 mengungkapkan sebagai berikut.
a. Semua materi mempunyai bagian terkecil yang disebut atom.
b. Atom tidak dapat dibagi-bagi lagi menjadi bagian yang lebih kecil.
c. Atom-atom suatu unsur sama dalam segala hal, tetapi berbeda dengan atom-atom unsur
lain.
d. Pada pembentukan senyawa terjadi ikatan antara penyusun senyawa tersebut.
e. Atom-atom bergabung dengan perbandingan yang sederhana.
2. Teori Atom Thomson
Sir J.J. Thomson tahun 1897 memperlihatkan elektron dengan teorinya sebagai berikut.
a. Atom merupakan bola yang bermuatan positif, pada tempat-tempat tertentu ada elektron
yang bermuatan negatif.
b. Jumlah muatan positif sama dengan muatan negatif. Teori atom Thomson ini dikenal
dengan nama teori atom Roti Kismis.
3. Teori Atom Rutherford
Ernest Rutherford tahun 1911 mengungkapkan model inti untuk suatu atom. Pada model inti
digambarkan atom sebagai ruangan kosong dengan inti yang padat mengandung muatan
positif terletak di pusat dan elektron beredar mengelilingi inti. Teori atom Rutherford
menerangkan sebagai berikut sebagai berikut.
a. Massa atom terpusat pada inti atom
b. Elektron beredar mengelilingi inti pada orbitnya atau kulitnya.
c. Ukuran atom sekitar 10–8 cm dan inti atom 10–13 cm.
Model atom Rutherford ada kekurangannya yaitu, jika elektron-elektron terus mengelilingi
inti akhirnya akan kehilangan energi dan kemungkinan dapat menumbuk inti.
4. Teori Atom Bohr
Niels Bohr tahun 1913 bekerja dengan Rutherford memodifikasi model atom dengan
menambahkan bahwa elektron mengelilingi inti pada tingkat-tingkat energi yang berbeda.
Bohr mengungkapkan sebagai berikut.
a. Elektron mengelilingi inti atom pada tingkat-tingkat energi tertentu yang disebut kulit
elektron.
b. Elektron dapat pindah dari tingkat energi yang satu ke yang lain dengan melepaskan atau
menyerap energi.
Walaupun model atom Bohr menjelaskan bagaimana elektron tidak akan menumbuk inti,
model Bohr tidak berlaku untuk atom berelektron banyak!
5. Teori Atom Modern

Teori atom modern berdasarkan mekanika quantum (tahun 1927) merupakan kelanjutan hasil
kerja Rutherford dan Bohr. Teori atom modern menyatakan sebagai berikut.
Elektron bergerak mengelilingi inti pada orbital. Orbital menggambarkan daerah
kebolehjadian ditemukannya elektron.
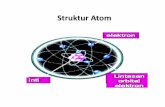
Struktur Atom
Menurut Bohr elektron mengelilingi inti atom pada tingkat-tingkat energi tertentu yang
disebut kulit elektron.
Bagaimana penyebaran elektron pada masing-masing kulit elektron tersebut? Elektron
tersusun pada masing-masing kulit dalam suatu konfigurasi elektron. Untuk mempelajarinya,
simaklah uraian berikut ini!
1. Konfigurasi Elektron
Elektron bergerak mengelilingi inti atom pada masing-masing orbitnya yang dikenal sebagai
kulit elektron. Jumlah kulit elektron suatu atom pada tabel periodikunsur sesuai dengan
nomor periode unsur atom tersebut, sedangkan jumlah
seluruh elektron sama dengan nomor atomnya. Kulit elektron diberi lambang K, L, M, N.
Sesuai dengan posisinya dari inti, K untuk kulit pertama, L kulit kedua, M kulit ketiga, dan N
kulit keempat. Susunan elektron pada masing-masing elektron disebut konfigurasi elektron.
2. Elektron Valensi
Kesamaan pada unsur-unsur golongan 1A yaitu jumlah elektron yang menempati kulit
terluarnya. Elektron pada kulit terluar disebut elektron valensi. Elektron valensi ini
merupakan elektron yang terlibat pada pembentukan ikatan
bila unsur-unsur bersenyawa (valen = ikatan). Unsur-unsur yang memiliki elektron valensi
sama, pada tabel periodik unsur terdapat pada golongan yang sama, maka unsur tersebut
memiliki sifat kimia yang sama. Elektron valensi menunjukkan jumlah elektron yang terdapat
pada kulit terluar dari suatu atom.
3. Konfigurasi Elektron Ion
Mengapa larutan garam dapur, NaCl dalam air dapat menghantarkan arus listrik? Pada
pelarutan NaCl dihasilkan ion Na+ dan ion Cl–. Apakah ion itu? Pada atom, jumlah elektron
sama dengan jumlah proton. Elektron bermuatan negatif, sedangkan proton bermuatan positif
sehingga atom tidak bermuatan atau netral. Untuk mencapai kestabilannya atom-atom ada
yang melepaskan elektronnya, ada juga yang menerima elektron sehingga terbentuk partikel
bermuatan yang disebut ion. Akibat pelepasan atau penerimaan elektron, ion dapat berupa ion
positif dan ion negatif

XI. REAKSI KIMIA
Sebuah reaksi kimia melibatkan perubahan kimia, yang berarti bahwa komposisi kimia, suatu
zat telah di ubah akibat pelepasan atau perolehan satu atau beberapa atom, atau kedua-
duanya, atau akibat penyusunan ulang atom dalam zat itu, atau bahkan semua hal tersebut.
Pada beberapa kasus, hanya penyusunan elektron yang menyebabkan terjadinya reaksi,
misalnya reaksi pemindahan elektron. Namun, ternyata landasan berlangsungnya semua
reaksi kimia tersebut adalah penyusunan ulang elektron.
XII. PERSAMAAN KIMIA
Karena beberapa ikatan kimia tengah diputus dan ikatan lainnya dibentuk, energi akan
selalu terlibat-baik diperoleh ataupun dilepaskan
Jumlah atom pada suatu unsur harus sama pada kedua sisi persamaan. Namun perhatikan
bahwa atom dapat berubah menjadi ion tanpa perlu mempengaruhi jumlahnya, asalkan
ion dihitung sebagai ekuivalen untuk tujuan ini.
Dalam menghitung atom, subscript numerik yang berada dibelakan sebuah atom hanya
mengacu pada atom itu saja
Jika ada angka diletakkan di depan rumus misalnya “2”, maka jumlah semua atom dalam
rumus dikalikan 2
Anak panah tunggal yang menuju satu arah berarti bahwa, dalam keadaan normal, reaksi
berlangsung ke satu arah. Jika anak panah menuju kedua arah, maka reaksi ini disebut
reaksi ekuilibrium. Kebanyakan reaksi dalam tubuh merupakan reaksi jenis ini.
Label seperti (S), (l), dan (g) mewakili solid (padat), liquid (cair), dan gas.