ALGORITMA NERACA MASSA
Transcript of ALGORITMA NERACA MASSA
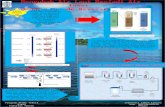
ALGORITMA NERACA MASSA1. 2. Ambil Basis Benzen Sebagai reaktan pembatas Hitung neraca massa di reaktor: Reaksi yang terjadi pada reaktor adalah: C6H6 (l) + HNO3 (l)H2SO4
C6H5NO2 (l) + H2O (l)
H = -117 kJ/mol
Diketahui Basis Benzen sehingga dapat diketahui : a. Benzen : Kemurnian 99,9 %C6H6 dan 0,1 % H2O H2O dlm C6H6 xa C6H6 bereaksi C6H6 sisa b. Nitrobenzen Mol C6H5NO2 c. Asam Nitrat Asam nitrat bereaksi terhadap nitrobenzen = 99,5 % (Kirk & Othmer, 2006). HNO3 HNO3 bereaksi HNO3 sisa d. = 9 ,5 x mol nitrobenzen 9 =9 ,5 9 x mol Asam Nitrat 10 010 0 0,1
= 99 ,9 Basis berat benzen = 90 % (Kirk & Othmer, 2006). =90 Basis mol benzen 100
= Basis benzen Benzen yang bereaksi
= (1/1) Basis mol benzen
= HNO3mula-mula - HNO3 bereaksi
H2O hasil reaksi H2O hasil reaksi = (1/1) x Basis mol benzen
e.
Trial perbandingan asam campuran 20-30 % HNO3, 55 65 % H2SO4, dan 5- 25 % H2O (US. Paten No 5.763.697). Dipilih komposisi asam campuran yaitu 21,15107914% HNO3, 63,45323741% H2SO4, dan 15,39568345% H2O.
f.
Komposisi asam campuran Diketahui : massa HNO3 Maka : H2O H2SO4 = 21,1510791415 ,39568345 63 ,45323741
x massa HNO3 x massa HNO3
= 21,15107914
g.
Cek H2O yang berasal dari HNO3 & H2SO4 H2O dlm HNO3 : Kemurnian HNO3 = 60 % HNO3, 40 % H2O H2O dlm HNO3 =40 x massa HNO3 60
H2O dlm H2SO4 : Kemurnian H2SO4 = 98 % H2SO4, 2 % H2O H2O dlm H2SO4 =2 x massa H2SO4 9 8
H2O dlm H2SO4 & HNO3 : H2O dlm HNO3 + H2O dlm H2SO4 = 21,1510791415 ,39568345
x massa HNO3 x massa HNO3 =
(H2O dlm HNO3 + H2O dlm H2SO4) - 21 ,15107914 0 Jika belum sama maka kembali ke poin (e).
15 ,39568345
Metode solver : o masukkan angka (H2O dlm HNO3 + H2O dlm H2SO4) x massa HNO3 pada SET TARGET CELL
15 ,39568345 21 ,15107914
o o CELL
Equal to : masukkan nilai = 0 Masukkan angka yang harus di trial pada BY CHANGING
Yaitu nilai trial
= % HNO3 = % H2SO4 = % H2O
h.
H2O masuk RE H2O masuk RE = H2O dalam C6H6 + H2O dalam asam campuran
i.
H2O keluar RE H2O keluar RE 3. = H2O masuk RE + H2O hasil reaksi
Hitung neraca massa di dekanter: dari data kelarutan maka dapat diketahui produk atas & bawah. C6H6 dan C6H5NO2 merupakan fase minyak (fraksi ringan) dimana berada pada lapisan atas. H2SO4 dan HNO3 merupakan fraksi berat, dimana berada dilapisan bawah. Sedangkan H2O merupakan pembatas antara fraksi berat dengan fraksi ringan.
a.
Umpan Masuk Aliran masuk DE-301 = Aliran keluar RE-201
b.
Aliran Keluar DE-301 C6H6 Kelarutan dalam air yaitu 0,225 per 100 bagian air pada temperatur 35oC. H2O masuk = H2O keluar RE-201
C6H6 masuk C6H6 produk bawah
= C6H6 keluar RE-201 =
0,225 100
H2O masuk
C6H6 produk atas H2O
= C6H6 masuk - C6H6 produk bawah
Kelarutan dalam benzen yaitu 0,145 per 100 bagian benzen pada temperatur 35 oC. H2O masuk C6H6 masuk H2O produk atas H2O produk bawah HNO3 Larut dalam air dalam semua perbandingan.HNO 3 masuk HNO 3 bawah HNO 3 atas = = H 2 Omasuk H 2 Obawah H 2 Oatas
= H2O keluar RE-201 = C6H6 keluar RE-201 =
0,145 100
C6H6 masuk
= H2O masuk - H2O produk atas
C6H5NO2 Practically insoluble in water. Assumsi : tidak ada nitrobenzen pada produk bawah, karena nitrobenzen tidak larut dalam air.
H2SO4 Larut dalam air dalam semua perbandingan.H 2SO 4 masuk H SO bawah H SO atas = 2 4 = 2 4 H 2 Omasuk H 2 Obawah H 2 Oatas
4. a.
Hitung neraca massa di distillasi: Menentukan Temperatur Bubble point feed
Pada keadaan bubble point, yi = (Ki x xi) = 1. Dengan cara trial T pada tekanan 1,01 atm hingga yi = 1 maka akan diperoleh temperatur bubble point feed. Dengan menggunakan program solver-excel b. Menentukan Derajat Pemisahan dan Key Komponen Diinginkan sebanyak 1E-4 %-mol C6H5NO2 berada di hasil atas. Dipilih Trial : : Light key Heavy key Split HK di bottom Split LK di bottom Menentukan distribusi komponen: Metode Hengstebecks (Coulson vol.6, 1983)D Log i B i = A + CLog i = A + CLog LK
= C6H6 = C6H5NO2 = 0,9999 = 1,57 E-4
D Log LK B LK
D A = Log HK B HK
D Log LK A B LK C= Log LKFi = Bi + Di Fi D =1+ i Bi Bi Bi = Fi ( Fi / Bi )
Di = Fi Bi
Nilai assumsi: C6H6 LK B D HNO3 = C6H6 feed x split LK di bottom =FB
Volatilitas relatif HNO3 lebih tinggi dari LK sehingga: D B H2O Volatilitas relatif H2O terletak diantara LK dan HK sehingga: D B B D H2SO4 Volatilitas relatif H2SO4 lebih rendah dari HK sehingga: B D = H2SO4 feed =0 = 0,5 x H2O feed =FD = C6H5NO2 feed x split HK di bottom =FB = HNO3 feed =FD
C6H5NO2
Nilai terkoreksi:D A = Log HK B HK
D Log LK A B LK C= Log LKD Log i = A + CLog i B i Fi D =1+ i Bi Bi Bi = Fi ( Fi / Bi )
Di = Fi Bi
Cek kemurnian C6H5NO2: Kemurnian = 3.787 ,8788 100 % = 99,8528 % Jika kemurnian < 99 % ulangi trial split LK dan HK.3.782 ,3051
Kemudian Cek kapasitas 30.000 ton/tahun (3.787,878788 kg/jam) pada produk bawah distillasi. Jika kapasitas belum memenuhi maka trial kembali basis benzen dengan program excel-solver. c. Menentukan Temperatur Dew point distilat Pada keadaan dew point, xi = (yi/Ki) = 1. Dengan cara trial T pada tekanan 1 atm hingga xi = 1 maka akan diperoleh temperatur dew point distilat. Dengan menggunakan program solver-excel d. Menentukan Temperatur Bubble point distilat
Pada keadaan bubble point, yi = (Ki x xi) = 1. Dengan cara trial T pada tekanan 1,25 atm hingga yi = 1 maka akan diperoleh temperatur bubble point bottom. Dengan menggunakan program solver-excel 5. 6. 7. Hitung neraca massa di kondensor: Hitung neraca massa di reboiler: Hitung neraca massa di evaporator : Diinginkan hasil H2SO4 98 %. H2O dalam H2SO4 98 % H2O yang menguap =2 x massa H2SO4 masuk evaporator g/jam 98
= H2O umpan - H2O dalam H2SO4 98%
Asumsi : Semua C6H6 dan HNO3 keluar di fase uap karena titik didih keduanya dibawah titik didih air. 8. 9. 10. 11. Hitung neraca massa di MP-201 : Hitung neraca massa di MP-202 : Hitung neraca massa di MP-203 : Hitung neraca massa di RE-201 :