3. TRANSFERENCIA DE MATERIA GAS-LÍQUIDO 91 3. TRANSFERENCIA DE MATERIA GAS-LÍQUIDO
Balance de Materia con Reacción Química
-
Upload
khangminh22 -
Category
Documents
-
view
1 -
download
0
Transcript of Balance de Materia con Reacción Química
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
Balance de Materia con Reacción Química
Previo a introducirnos en el tema vamos a recordar (y aprender) conceptos básicos
relacionados a las reacciones químicas.
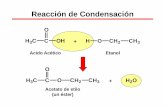
1) Estequiometría: Se refiere a la proporción en que se combinan ciertos reactivos
para dar los productos. Ej:
2A + B → C + 3D
Significa: 2 mol de A + 1 mol B → 1 mol C + 3 mol D
O sea que la relación estequiométrica: mol A/mol B = 2, es decir, siempre será
necesario el doble de moles de A que de B para que se produzca la reacción.
Cociente estequiométrico: mol A/ mol B = relación de coeficientes
estequiométricos.
Coeficiente estequiométrico: es el nº mínimo de moles de 1 especie dada que
debe ponerse en juego en una reacción química para asegurar el balance
atómico.
Los números que preceden a cada especie molecular son los coef.
estequiométicos y los denominamos con la letra griega ν, o sea el coef. Esteq. de
A → ν A= 2
Otra lectura de la ecuación estequiométrica referida los productos es: se
consumen 2 mol de A para producir 3 mol de D.
2) Conversión (α) : Ya hemos visto en Química General que una reacción química
no necesariamente se produce en un instante y también que no necesariamente se
produce en su totalidad; es decir que no desaparecen totalmente los reactivos y
sólo obtengo productos al terminar la reacción.
En otras palabras, no es práctico diseñar un reactor que consuma totalmente los
reactivos.
Definimos entonces conversión como:
E
i
S
i
E
i
N
NN
dossuministramoles
consumidosmoles
α. 100 = porcentaje de conversión
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
3. Exceso: Recordemos el concepto de reactivo limitante: es el reactivo que desaparece
cuando se lleva a cabo una reacción. Ej:
2A + B → C + 3D
Ingreso: 200 moles A + 150 moles B
Podemos ver que en caso que la reacción se produzca totalmente se consumirá todo
el A y sobrarán 50 moles de B. O sea A es el reactivo limitante.
El o los reactivos que no son limitantes (en este caso, B) se conoce como reactivo en
exceso .
Definimos entonces Exceso como:
teóricosmoles
teóricosmolesingresanquemolesEx
En nuestro caso:
Ex (B) = (150 – 100)/100 = 0,5
Ex * 100 = 50% (porcentaje de exceso)
4. Grado de Avance (ξ) : Es una medida de la extensión en que se ha completado la
reacción química consumiendo los reactivos. Es una variable dimensional, cuyas
unidades pueden ser: mol, lbmol, etc.
Veamos un ejemplo: Ejemplo 11
2A + B → C + 3D
Supongamos que parto de proporciones estequiométricas de reactivos y a la salida
del reactor tengo los siguientes resultados:
Qué pasó?
De B sólo han reaccionado 50 mol, ya que quedaron 50 mol sin reaccionar. Esto quiere
decir que la reacción avanzó sólo 50 mol de B (se consumieron 50 mol B; y si miro a A
sólo 100 mol de A (νA.50= 2. 50= 100 mol A).
El grado de avance de esta reacción es: ξ = 50 mol.
Veamos cómo escribir esto matemáticamente, usando la estructura de balance:
21BB
nn → 021BB
nn
R
200 mol A 100 mol B
1 2 50 mol C 150 mol D 50 mol B 100 mol A
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
221AA
nn → 0221AA
nn
2C
n → 02C
n
32D
n → 032D
n
Veo ahora: Entra – Sale + Genera = 0
Genera = ν i. ξ
Donde: ν i <0 si es de reactivos (consume (-): Sale del sistema)
ν i >0 si es de productos (produce (+): Ingresa del sistema)
Obviamente tendremos tantos ξ como reacciones químicas.
Conversión: Dado el siguiente esquema, definimos:
Conversión por paso: αA (por paso) = 2
32
A
AA
n
nn
Conversión global: αA (global) = 1
31
A
AA
n
nn
Balances atómicos:
Nos pongamos de acuerdo: SIEMPRE LA MASA ES CONSTANTE.
Sin reacción química: se conservan las moléculas (las especies moleculares no cambian)
Con reacción química: se conservan los átomos, desaparecen especies moleculares
(reactivos) y aparecen nuevas (productos).
Veamos un ejemplo: Ejemplo 12
M
R 1 2 3
4
A B
A B C D
A B C D
A B C D
R 1 2
N2. 20% H2. 70% NH3. 10%
N2 H2 NH3. 57%
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
El cambio en el % de NH3 se debe a la reacción química que se produce.
Hagamos los balances atómicos:
Átomos N) N sale – N entra = 0
N sale = 2. N2)2 + 1. NH3)2
N entra = 2. N2)1 + 1. NH3)1
N sale – N entra = 2. N2)2 + 1. NH3)2 – (2. N2)1 + 1. NH3)1)= 0
= 2. [N2)2– N2)1] + 1.[NH3)2- NH3)1] = 0
N2 NH3
N sale – N entra = 2. N2 + 1. NH3 = 0 → - 2. N2 = 1. NH3
Átomos H) H sale – H entra = 0
Hsale=2. H2)2 + 3. NH3)2 312
223 HNNH
H entra = 2. H2)1 + 3. NH3)1
H sale – H entra = 2. H2 + 3. NH3 = 0 → - 2. 2 = 3. NH3
Sistema lineal homogéneo indeterminado, por lo tanto cualquiera de los incrementos
puede ser desplazado al 2º miembro como término independiente.
Puedo escribir:
23
2
NHN
2
3 32
NHH
Tengo 2 ecuaciones con 3 incógnitas; por lo tanto tengo una variable independiente.
312223 HNNH
Los denominadores son los coeficientes esteq. νi de la ecuación química que los
combina, y que me permite relacionar los moles.
1 N2 + 3 H2 → 2 NH3
Esta ecuación resume la solución del balance atómico.
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
Desde el punto de vista del balance, los coeficientes estequiométricos de los reactivos
son negativos.
Observemos que los incrementos moleculares son directamente proporcionales a sus
coeficientes estequiométricos y del mismo signo en una misma reacción.
Grado de avance: para desacoplar los incrementos moleculares y manejarlos por
separado se introduce el concepto de GRADO DE AVANCE ξ (psi) de la reacción-
Veamos del ejemplo anterior:
i
nicomúnvalor
HNNH""
312223
Este “valor común” se denomina grado de avance y mide el número de veces que la
reacción produce o consume (genera) una cantidad estequiométrica de moles de c/u de
los productos y reactivos respectivamente.
Generalizando escribimos que:
i
ni → .ini Si ξ< 0, indica que la reacción se está produciendo al
revés.
Recordar:
Incremento: cantidad final – cantidad inicial
νi de los reactivos es < 0.
Estructura del término Generación.
Vemos ahora que:
ni = [ Sale(i) – Entra (i)] = Genera (i) = νi.ξ
Genera (i) = νi.ξ Molar: νi.ξ
Másico: νi.ξ.PMi
Si en un sistema se produce más de 1 reacción química, c/u tendrá su propio ξ. Si una especie molecular (i) participa en más de una reacción dentro del sistema,
su incremento ni resultará de sumar los incrementos parciales que produce cada reacción en la que participa.
ni = = νi1.ξ1 + νi2.ξ2 +….+ νin.ξn= r
n
r
ir.
1
El problema de cuantificar los incrementos moleculares ni se reduce a determinar los grados de avance ξ r de cada una de las reacciones químicas dentro del sistema.
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
Veamos ahora el siguiente ejemplo: Ejemplo 13
Desconocemos cuantas reacciones químicas se producen. Hagamos los balances atómicos: N) 1. NH3 + 2. N2 + 1. NO2 = 0 Sistema lineal homogéneo indeterminado: H) 3. NH3 + 2. H2O = 0 3 ecuaciones de balance y 5 incógnitas O) 2. O2 + 1. H2O + 2. NO2 = 0 → tengo 2 variables independientes. Elijo variables independientes: NH3 y . NO2
Entonces: 1) 2 N2 = - NH3 - NO2
2) 2. H2O = - 3. NH3 Reemplazo 2) en 3) 3) 2. O2 + 1. H2O = - 2. O2 2 N2 = - NH3 - NO2 → N2 = -1/2. NH3- 1/2. NO2 2. O2 = 3/2. NH3 - 2. O2 → O2 = 3/4. NH3 - O2 2. H2O = - 3. NH3 → H2O = - 3/2. NH3
Observo ahora las ecuaciones fijándome en 1 de las variables independientes NH3; queda entonces:
23
2
NHN
4332 NHO
2332 NHOH
12223
32
312
OHONNH
Coeficientes estequiométricos
R 1 2
N2 O2 NH3
N2 O2 NH3 H2O NO2
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
Por lo tanto: 2 NH3 + 3/2 O2 → N2 + 3 H2O Veamos ahora la otra variable independiente O2
2
22
NON
11
22 NOO
2222
212
ONNO
Coeficientes estequiométricos Por lo tanto: N2 + 2 O2 →2 NO2
Obtengo 2 reacciones químicas independientes: IGUAL Nº de REACCIONES QUIMICAS QUE VARIABLES INDEPENDIENTES. Las variables independientes no pueden estar nunca en la misma reacción!!! Veamos ahora qué pasa si tomo como variables independientes N2 y O2. Antes de efectuar ningún procedimiento matemático observamos, en función de las entradas y salidas del reactor, que necesariamente debe existir 1 reacción que involucre al O2 y al N2, Por lo tanto no se cumpliría que las variables independientes no pueden estar nunca en 1 misma reacción (sería lo mismo si tomo NH3 y H2O; o O2 y
H2O). Ver balances atómicos. Tomemos entonces como variables independientes N2 y NH3. Entonces: 1) 2 N2 = - NH3 - NO2
2) 2. H2O = - 3. NH3 las reordeno dejando las var. indep en el lado derecho
3) 2. O2 + 1. H2O = - 2. O2
1) 12/1
322
NHNNO
A
B
Estas relaciones (A y B) definen 2 ecuaciones estequiométricas
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
2) 3/23
2
NHOH
3) 2122
2
OHNOO
Reemplazo en 3, 2 y 1:
7/42/1)4/31.(
2/12
)3/2
(
1
)12/1
(32
32
332
2
NHNNH
N
NHNHN
O
Queda entonces:
1) 12/1
322
NHNNO 1
2223
4/72/311
OOHNONH
2) 3/23
2
NHOH 2
222
112/1
ONON
3) 7/42/1
322
NHNO
Como el agua no puede tener coeficiente fraccionario, multiplico por 2, el denominador de la 1º ecuación: 2 NH3 + 7/2 O2 → 2 NO2 + 3 H2O N2 + 2 O2 → 2 NO2 → idéntica la encontrada anteriormente Ec. Veamos ahora si tomamos como variables independientes N2 y NO2.
1) 2/1122
3
NNONH
2) 3/23
2
NHOH
3) 2122
2
OHNOO
Reemplazando 1) y 2) en 3):
*
*
C
DB
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
3/27/4.
2
3.
4
7
2/114
3
122
22222
2
NNONNO
NNONOO
Queda entonces:
1) 2/1122
3
NNONH
2) 3/13/222
2
NNOOH
3) 3/27/4
222
NNOO
Si ∆NO2 = 2 → ∆NH3 = -2 → ∆H2O = 3 → ∆O2 = -7/2 2NH3 + 7/2 O2 → 2 NO2 + 3 H2O
Si ∆N2 = 1 → ∆NH3 = -2 → ∆H2O = 3 → ∆O2 = -3/2 2NH3 + 3/2 O2 → N2 + 3 H2O Observamos que: = = = Podemos concluir entonces: El sistema involucra 2 reacciones químicas: tantas reacciones químicas como especies moleculares independientes haya en el balance atómico. Las 2 reacciones pueden elegirse de cualquier modo y escribirse en cualquier sentido. La única condición es que intervengan todas las especies reactivas. Cualquier combinación lineal que mantenga el nº correcto de ecuaciones estequiométricas es otra solución válida para el balance atómico- No es posible fusionar las ecuaciones esteq. en una sola porque se crean proporciones forzosas (arbitrarias) entre los incrementos. La solución correcta del balance depende del nº de ecuaciones esteq., pero no de cuáles sean estas ecuaciones.
E
F
A F
B D
C E
Introducción a la Ingeniería Química Dpto. de Ingeniería de Procesos y Gestión Industrial
FACET - UNT
Ing. Carlos Correa, Dra. Norma Barnes, Dra. Dora Paz
Por lo tanto, de ahora en más, trabajaremos con ecs. esteq. y tendremos siempre en cuenta que:
nº reacciones químicas = nº especies moleculares – nº especies atómicas Cada reacción química incrementa una incógnita: su grado de avance; por lo que ahora el nº de ecuaciones de balance disponibles para compensar los pesos será:
nº ecuaciones de balance = nº especies moleculares - nº reacciones químicas O lo que es lo mismo: nº ecuaciones de balance = nº especies atómicas Volvamos al Ejemplo 12:
nº reacciones químicas = nº especies moleculares – nº especies atómicas
nº reacciones químicas = 3 – 2 = 1
nº ecuaciones de balance = nº especies moleculares - nº reacciones químicas nº ecuaciones de balance = 3 – 1 = 2; o bien:
nº ecuaciones de balance = nº especies atómicas nº ecuaciones de balance = 2 GL = 3 -2 = 1 – Base = 0 N2 + 3 H2 = 2 NH3 ξ NH3) 0,10.F1-0,57.F2 + 2 ξ = 0 N2) 0,20.F1 – XN2. F2 - ξ = 0 H2) 0,70.F1 – XH2. F2 – 3 ξ = 0
Σ = F1 – F2 = 2 ξ = - Σ νi.. ξ
∆ nº moles = F2 - F1 = Σ νi.. ξ
R 2
1 2
N2. 20% H2. 70% NH3. 10%
N2 H2 NH3. 57%
1 2
1
2
3
4