Teknik histologi
-
Upload
indah-fajarwati -
Category
Documents
-
view
77 -
download
4
description
Transcript of Teknik histologi

1
1 PENDAHULUAN
Latar Belakang
Berbagai metode dikembangkan dalam mempersiapkan jaringan agar dapat dipelajari dan mirip dengan keadaan alaminya (Gartner dan Hiatt 2007). Salah satu metode yang banyak digunakan adalah metode parafin. Metode parafin merupakan suatu cara pembuatan preparat permanen dengan menggunakan parafin sebagai media embedding (Gunarso 1986). Parafin meresap ke jaringan dalam bentuk cair dan membeku dengan cepat ketika didinginkan. Hal ini mencegah perubahan struktur jaringan selama di mikrotom. Metode parafin memberikan pemotongan yang berkualitas dan cocok dengan sebagaian besar pewarnaan baik umum ataupun pewarnaan khusus (Suvarna et al. 2008).
Tahapan dalam pembuatan sediaan histologi meliputi sampling, fiksasi, dehidrasi dan clearing, infiltrasi, embedding, sectioning, dan stainning. Fiksasi adalah proses pemeliharaan jaringan menggunakan agen kimia yang bertujuan untuk menghambat perubahan jaringan menuju kematian (setelah di keluarkan dari tubuh) dan juga untuk mempertahankan arsitektur normalnya (Gartner dan Hiatt 2007). Setelah difiksasi, organ dimasukkan ke dalam alkohol bertingkat (dehidrasi) untuk menarik cairan jaringan. Kemudian dilakukan clearing untuk menggantikan tempat alkohol dalam jaringan (Uray 2009). Reagen dalam proses clearing bereaksi intermediet diantara zat pengdehidrasi dan penginfiltrasi. Reagen clearing seharusnya larut di dalam kedua zat tersebut (Suvarna et al. 2008). Setelah di clearing, organ diinfiltrasi dan di embedding menggunakan parafin, sehingga memudahkan organ untuk dipotong. Setelah didapatkan potongan seperti yang diharapkan, selanjutnya dilakukan pewarnaan (Maynard et al. 2014).
Untuk dapat membuat sediaan histologi maka dilakukan praktikum pembuatan sediaan histologi pankreas menggunakan metode parafin. Dengan praktikum ini juga diharapkan agar praktikan dapat memahami serangkaian proses pembuatan sediaan histologi dengan baik dan mampu menganalisis hasil sayatan.
Tujuan
Tujuan dari praktikum ini adalah sebagai berikut:1. Membuat sediaan histologi dari organ pankreas tikus (Rattus norvegicus L.)
menggunakan 2 larutan fiksatif berbeda yaitu Bouin dan Paraformadehid.2. Menganalisis sediaan histologi dari organ pankreas tikus (Rattus norvegicus
L.)

2
2 METODE
Waktu dan Tempat
Praktikum teknik histologi dilaksanakan dari bulan November 2015 sampai bulan Januari 2016. Praktikum ini dilakukan di Laboratorium Histologi Departemen Anatomi Fisiologi dan Farmakologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan pada praktikum ini adalah mikrotom, balok holder, tutup pagoda, tissue cassette, inkubator, kaca objek, cover glass, sarung tangan, masker, alat bedah, kertas label, gelas ukur, pipet tetes, spatula, bunsen, neraca digital, kamera digital, dan alat tulis. Bahan yang digunakan adalah 2 ekor tikus putih betina Sprague Dawley, larutan Bouin, larutan paraformaldehid, NaCl fisiologis, larutan dehidrasi (alkohol 70%, alkohol 80%, alkohol 90%, alkohol 95 %, dan alkohol absolut), larutan penjernih (xylol), parafin, hematoksilin, eosin, Distiled Water, entelan (perekat), ketamine dan xylazine, kertas tissu.
Cara Kerja
Pengambilan Sampel Organ atau SamplingTikus dibius menggunakan ketamine dan xylazine. Penginduksian
ketamine dan xylazine dilakukan secara intraperitoneal. Ujung-ujung jari tikus dipencet untuk memastikan apakah tikus sudah terbius sempurna. Jika tikus sudah tebius sempurna, dilakukan pembedahan dan pengambilan sampel organ.
Fiksasi dan Stopping PointProses fiksasi dilakukan menggunakan 2 metode, yaitu metode perfusi dan
metode langsung. Tikus A difiksasi secara perfusi menggunakan larutan fiksatif paraformaldehid sedangkan tikus B difiksasi secara nekropsi menggunakan larutan fiksatif bouin. Organ-organ dari tikus A direndam selama 1 minggu dalam larutan paraformadehid. Organ-organ tikus B direndam dalam larutan bouin selama 24 jam. Organ disayat untuk membantu dan mempercepat proses fiksasi, kemudian dimasukkan ke dalam tissue cassette, diberi label. Setelah difiksasi, organ dimasukkan ke dalam alkohol 70% sebagai stopping point.
DehidrasiOrgan dimasukkan kedalam alkohol 80%, 90%, 95% masing-masing selama
24 jam, kemudian dimasukkan ke dalam alkohol absolut I selama 1 jam, alkohol absolut II selama 1 jam, dan alkohol absolut III selama 1 jam.

3
Penjernihan atau ClearingProses ini dilakukan dengan menggunakan larutan xylol, yaitu dimulai dari
memasukkan pankreas kedalam xylol I selama 1 jam, kemudian xylol II selama 1 jam, xylol III dengan suhu kamar selama 30 menit, dan selama 30 menit berikutnya di dalam inkubator suhu 37°.
Penanaman Jaringan dalam Parafin atau EmbedingTahapan ini terdiri dari tiga proses yaitu infiltrasi parafin, penanaman
jaringan, dan pembuatan blok jaringan. Proses pertama dilakukan dengan memasukkan organ ke dalam parafin I selama 1 jam, parafin II selama 1 jam, dan ke dalam parafin III selama 1 jam. Proses infiltrasi parafin dilakukan di dalam inkubator.
Proses selanjutnya adalah penanaman jaringan ke dalam parafin menggunakan alat Tissue Embedding Console. Proses ini di mulai dengan mengolesi tutup pagoda dengan gliserin dalam kondisi hangat di atas hotplate bersuhu 67°C, kemudian parafin cair dituangkan ke dalam tutup pagoda secara perlahan hingga permukaan parafin cembung. Jaringan dengan segera diletakkan ke dalam parafin dengan menggunakan pinset secara hati-hati. Dalam satu tutup pagoda dapat diisi dengan lebih dari satu sampel dan letaknya diatur sedemikian rupa untuk memudahkan proses pemotongan. Setiap sampel diberi label menggunakan kertas yang ditanamkan di bagian tepi tutup pagoda. Tutup pagoda kemudian dipindahkan dari keadaan hangat ke bagian dingin (cold plate) selama beberapa saat sampai membeku, dalam proses pemindahan ini perlu dijaga agar organ-organ yang telah ditata tidak bergerak sehingga akan mengalami perubahan posisi. Setelah dari cold plate, tutup pagoda dipindahkan ke dalam air untuk membantu pembekuan parafin agar lebih sempurna.
Tahapan selanjutnya adalah pembuatan blok jaringan. Proses ini diawali dengan mengeluarkan parafin dari tutup pagoda. Potongan parafin yang membungkus jaringan dipotong sampai membentuk kotak. Pisau yang sudah dipanaskan di atas bunsen digunakan untuk merapikan potongan parafin dan menempelkannya pada balok kayu. Serpihan parafin diletakkan di atas blok kayu untuk membantu penempelan parafin, kemudian serpihan parafin dilelehkan menggunakan pisau yang telah dipanaskan. Sampel diletakkan di atas pisau panas dan secara perlahan ditempelkan diatas balok kayu yang telah dialasi parafin cair. Sampel siap untuk dipotong, blok parafin dapat disimpan dalam lemari es sebelum dipotong dengan mikrotom.
Pemotongan atau SectioningSetelah jaringan ditanam di dalam parafin dan ditempelkan pada blok kayu,
jaringan siap dipotong menggunakan mikrotom. Blok parafin dipasang pada mikrotom lalu posisinya diatur agar memperoleh hasil potongan yang optimal. Sediaan dipotong dengan ketebalan maksimal 5 µm. Sebelum dipotong, sediaan ditrimming terlebih dahulu untuk membuang parafin yang tidak digunakan, mendapatkan hasil sayatan yang baik serta mendapatkan potongan yang utuh. Setelah dipotong, sayatan diambil dengan potongan kertas yang basah pada bagian ujungnya lalu diapungkan di atas aquades untuk membuka lipatan. Kemudian sayatan dipindahkan ke dalam air hangat dengan suhu 37° untuk menghilangkan

4
kerutan, lalu diletakkan pada gelas objek untuk dilihat hasilnya di bawah mikroskop. Gelas objek yang terlekat oleh jaringan diberi label sesuai dengan kode sampel dan dikeringkan. Sediaan disimpan di inkubator dengan suhu 37°C selama untuk dilanjutkan dengan proses pewarnaan.
Pewarnaan atau StainningJaringan diwarnai dengan pewarnaan Hematoksilin Eosin. Jaringan yang
akan diwarnai diletakkan di dalam inkubator 67° C selama 3 menit. Jaringan kemudian dikelurkan dan diletakkan dalam suhu ruang selama 5 menit. Proses selanjutnya adalah deparafinisasi dengan xylol yang bertujuan untuk menghilangkan parafin pada jaringan. Dimulai dari memasukkan jaringan ke xylol III selama 3 menit, xylol II selama 3 menit, dan xylol I selama 5 menit. Langkah berikutnya adalah proses rehidrasi yang bertujuan mengembalikan cairan kedalam jaringan dengan menggunakan larutan alkohol. Proses rehidrasi yang pertama adalah memasukkan jaringan ke dalam alkohol absolut III, II, I masing-masing selama 3 menit, kemudian jaringan dimasukkan ke dalam alkohol 95%, 90%, 80% secara bergantian dan masing-masing selama 3 menit, kemudian dimasukkan dalam alkohol 70% selama 5 menit. Setelah dimasukkan kedalam alkohol bertingkat, langkah yang selanjutnya dilakukan adalah memasukkan jaringan kedalam air kran selama 5-10 menit dan terakhir kedalam akuades selama 10 menit. Setelah masuk kedalam larutan akuades selama 10 menit, hematoksilin dipipetkan ke jaringan selama 1 menit sampai pewarna berhasil mewarnai intisel. Sediaan jaringan kembali direndam dalam air kran selama 10 menit dan di dalam akuades selama minimal 5 menit. Pewarnaan kembali dilanjutkan dengan memipetkan pewarna eosin selama 3 menit untuk mewarnai sitoplasma jaringan. Sediaan jaringan kembali direndam dalam akuades selama 5 menit. Tahapan berikutnya adalah dehidrasi yang bertujuan menarik air dari jaringan agar tetap awet dan tidak cepat rusak. Sediaan jaringan dicelupkan 2-3 kali secara berurutan kedalam larutan alkohol 70%, 80%, 90%, 95%, absolut I dan absolut II, kemudian di dalam absolut III selama 1 menit. Proses terakhir adalah penjernihan atau clearing yaitu dimulai dengan mencelupkan jaringan 2-3 kali kedalam larutan xylol I dan xylol II, kemudian dimasukkan ke dalam xylol III selama 1 menit. Setelah melakukan pewarnaan, maka proses selanjutnya adalah mounting, yaitu penutupan sediaan dengan menggunakan entelan sebagai perekat.

5
3 HASIL DAN PEMBAHASAN
I. Pembuatan Sediaan Histologi.Dalam praktikum ini Proses fiksasi menggunakan 2 larutan yang berbeda,
yaitu larutan paraformaldehid dan bouin. Larutan paraformaldehid terdiri dari formalin, NaCl, Aquades dan KOH sebagai penjernih. Larutan Bouin terdiri dari Asam picrat, formalin, dan acetic acid glacial.
Cairan fiksasi dialirkan dengan menggunakan 2 metode. Metode pertama adalah dengan nekropsi yang dilakukan segera setelah hewan coba sudah terbius sempurna agar mencegah perubahan jaringan yang disebabkan autolisis sel. Sedangkan metode kedua adalah perfusi.
Perfusi merupakan metode pada teknik histologi untuk mengalirkan cairan fiksasi ke dalam jaringan dengan waktu yang relatif cepat, sehingga gambaran histologi yang diperoleh mewakili keadaan sesaat sebelum kematian. Metode ini membutuhkan peran pembuluh darah yang akan menyalurkan dan memberikan akses ke setiap jaringan dalam waktu yang cepat. Sel akan memulai proses autolisis segera setelah proses anoksia (kekurangan oksigen) terjadi. Jadi, semakin cepat larutan fiksatif sampai ke setiap sel, maka proses autolisis pun semakin cepat berhenti.
Gambar 1. Metode perfusi pada hewan coba. Keterangan: a. Ventrikel kiri, b. Atrium kanan.
Perfusi diawali dengan menyayat bagian atas abdomen dari tikus yang sudah dibius. Penyayatan dilanjutkan ke sekitaran daerah jantung tanpa mengenai organ. Atrium kanan disayat sedikit dan ventrikel kiri segera dialiri dengan garam fisiologi NaCl agar jantung tetap berdenyut dan darah yang hilang digantikan dengan NaCl. Jika darah yang keluar dari atrium kanan telah bening maka cairan NaCl digantikan dengan larutan fiksatif, sehingga larutan fiksatif ini dapat mengalir ke seluruh tubuh melalui pembuluh darah tikus.
Tahapan fiksasi berdasarkan Gage et. (2012) adalah dimulai dengan insisi pada lateral melewati integument dan dinding abdomen, dilanjutkan insisi pada diafragma dan daerah tersebut dipotong untuk mengekspos jantung. Kemudian potongan paralel dibuat pada kedua sisi tulang iga (costae) hingga tulang scapulae.
ba

6
Gambar 2. Preparasi hewan coba (sumber : Gage et al. 2012)
Jarum perfusi diletakkan melalui potongan ventrikel menuju aorta asendens. 1 set hemostat yang lain dapat digunakan untuk klem aorta, yaitu kira-kira pada ujung jarum untuk mencegah kebocoran. Selanjutnya gunakan gunting iris untuk membuat insisi kecil pada akhir posterior ventrikel kiri. Kemudian buka katupnya dan sambungkan dengan jarum yang sudah dimasukkan ke dalam jantung tikus. Pastikan tidak ada gelembung udara di dalam saluran tersebut. Pompa dengan tekanan 80 mmHg dan jaga tekanan hingga infus dapar selesai. Ketika dapar akan selesai (200 ml), ganti alur katup dapar sehingga cairan fiksatif dapat masuk.
Gambar 3. Metode perfusi pada hewan coba (sumber : Gage et al. 2012).
Setelah difiksasi berdasarkan waktu yang telah ditentukan, organ dimasukkan ke dalam alkohol 70% sebagai stopping point, dan dilanjutkan dengan dehidrasi. Dehidrasi merupakan proses penarikan cairan jaringan dengan menggunakan alkohol bertingkat. Kemudian dilakukan perjernihan atau clearing, yaitu proses menggantikan alkohol dalam jaringan. Kemudian organ di infiltrasi dan ditanam dalam parafin. Organ kemudian siap dipotong dan diwarnai.
Pewarnaan dengan menggunakan hematoksilin dan eosin merupakan metode yang paling banyak digunakan dalam pembuatan preparat histologis. Pewarnaan ini terdiri dari 2 jenis zat warna, yaitu hematoksilin yang fungsinya untuk mewarnai inti sel menjadi biru. Sedangkan eosin fungsinya untuk mewarnai sitoplasma menjadi merah.

7
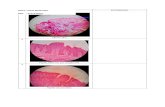
II. Sediaan Histologi Organ Pankreas TikusHasil pengamatan pada sediaan histologi pankreas dengan pewarnaan Hematoksilin Eosin (HE) dapat dilihat pada gambar 4. Hal utama yang dapat dilihat dari sediaan pada gambar tersebut adalah pulau langerhans yang dikelilingi oleh sel-sel acinar. Selain itu juga terdapat jaringan ikat dan pembuluh darah. Inti sel bewarna biru gelap dengan sitoplasma sel bewarna merah sebagai ciri khas dari pewarnaan HE. Hematoksilin merupakan zat warna yang bersifat basa sehingga dapat mewarnai inti sel yang bersifat asam sedangkan eosin adalah zat warna yang bersifat asam sehingga dapat mewarnai sitoplasma yang bersifat basa (Banks 1993).
Gambar 4. Histologi organ pankreas tikus pada pewarnaan HE. Keterangan = A dan B : Histologi pankreas Tikus A difiksasi menggunakan paraformaldehid, C : Histologi pankreas tikus B difiksasi menggunakan Bouin. Pulau langerhan (PL).
Dalam proses pembuatan sediaan histologi, terdapat beberapa kesalahan sehingga sediaan yang didapat menjadi tidak sempurna. Hal tersebut dapat dilihat dari gambar 2.
PL PL
A B
PL
C

8
Gambar 5. Hasil potongan yang kurang bagus. Keterangan: LP = Lipatan
Dari gambar 2 dapat dilihat hasil kesalahan dalam pengerjaan sediaan histologi pankreas. Gambar A dan B menunjukkan potongan yang tebal sehingga inti sel tidak terwarnai dengan baik. Pada gambar B juga terdapat lipatan yang menunjukkan ketidaksempurnaan dalam proses merentangkan jaringan di dalam air hangat ataupun kesalahan ketika proses pemindahan jaringan dari mikrotom yang mengakibatkan lipatan tidak dapat dihilangkan. Pada gambar C diduga jaringan terlalu lama dipanaskan sehingga mengakibatkan jarak diantara lobus acinar lebih lebar.
A B
C
LP

9
4 KESIMPULAN DAN SARAN
Kesimpulan
Dari praktikum yang telah dilakukan dapat disimpulkan:1. Pembuatan sediaan histologi pankreas tikus terdiri dari beberapa tahapan
yaitu sampling, fiksasi dan stopping point, dehidrasi, clearing, infiltrasi dan embedding, pemotongan atau sectioning, pewarnaan.
2. Beberapa kesalahan yang mungkin terjadi dalam pembuatan sediaan histologi adalah pemanasan jaringan yang berlebihan, sayatan yang terlalu tebal, lipatan karena proses perentangan yang tidak sempurna, pewarnaan yang tidak pas.
Saran
Disarankan untuk melakukan pemotongan jaringan dengan lebih tipis dan menanggulangi kesalahan-kesalahan yang mungkin terjadi. Selain itu disarankan untuk tidak melakukan pemotongan dengan tergesa-gesa.

10
DAFTAR PUSTAKA
Banks WJ. 1993. Applied Veterinary Histology. Ed ke-3. USA: Mosby.Gage GJ, Kipke DR, Shain W. 2012. Whole animal perfusion fixation for rodents.
J. Vis. Exp. e3564(65):1-9 Gartner LP, Hiatt JL. 2007. Color Textbook of Histology. Ed ke-3. Philadelphia:
Elsevier Inc. Gunarso W. 1986. Pengaruh Dua Jenis Cairan Fiksatif yang Berbeda pada
Pembuatan Preparat dari Jaringan Hewan Dalam Metoda Mikroteknik Parafin. Bogor: IPB Press
Maynard R, Downes N, Finney B. 2014. Histological Techniques an Introduction for Beginners in Toxicology. UK: The Royal Society of chemistry Cambridge.
Suvarna SK, Layton C, Bancroft JD. 2008. Bancroft’s Theory and Practice of Histological Techniques. Ed ke-7. London: Churchill Livingstone.
Uray AD. 2009. Profil sel β pulau langerhans jaringan pankreas tikus diabetes mellitus yang diberi virgin coconut oil (VCO) [Skripsi]. Bogor (ID): Institut Pertanian Bogor.