Pengamatan Virus Pada Bakteri Dengan Metode Plaque - Copy
-
Upload
rima-ramadhania -
Category
Documents
-
view
485 -
download
16
description
Transcript of Pengamatan Virus Pada Bakteri Dengan Metode Plaque - Copy
PENGAMATAN VIRUS PADA BAKTERI DENGAN METODE PLAQUE
Oleh :
Nama
: Rima Ramadhania
NIM
: B1J012106
Kelompok
: 2Rombongan
: I
Asisten
: Anwar RovikLAPORAN PRAKTIKUM VIROLOGI
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAAN
UNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGI
PURWOKERTO
2015I. PENDAHULUANA. Latar Belakang
Virus berasal dari bahasa Yunani yaitu venom yang berarti racun. Umumnya virus merupakan elemen genetik yang mengandung salah satu asam nukleat yaitu asam deoksiribonukleat (DNA) atau asam ribonukleat (RNA) yang dapat berada dalam dua kondisi yang berbeda, yaitu secara intraseluler dalam tubuh inang dan ekstrseluler di luar tubuh inang. Partikel virus secara keseluruhan ketika berada di luar inang yang terdiri dari asam nukleat yang dikelilingi oleh protein dikenal dengan nama virion. Virus dapat bertindak sebagai agen penyakit dan agen pewaris sifat. Virus sebagai agen penyakit memasuki sel dan menyebabkan perubahan-perubahan yang membahayakan bagi sel yang akhirnya dapat merusak atau bahkan menyebabkan kematian pada sel yang diinfeksinya, sebagai agen pewaris sifat, virus memasuki sel dan tinggal di dalam sel tersebut secara permanen (Alexopoulus, 1964).
Partikel virus di luar sel inang tidak mempunyai kegiatan metabolik yang mandiri. Perbanyakan virus berlangsung dengan replikasi, yaitu protein virus beserta komponen-komponen asam nukleatnya bereproduksi di dalam sel-sel inang yang rentan. Langkah-langkah infeksi virus secara garis besar yaitu: (1) pelekatan atau adsorpsi, (2) penentrasi dan pelepasan selubung, (3) replikasi dan biosintesis komponen, (4) perakitan dan pematangan, dan (5) pembebasan (Atlas, 1997).Pendeteksian adanya virus dapat menggunakan mikroskop elektron langsung, PCR, pelacak DNA dan metode Plaque. Plaque assay sering digunakan karena lebih mudah dan sederhana. Virus yang memulai infeksinya pada sel inang selanjutnya akan menyebabkan terbentuknya plaque atau zona lisis atau zona hambat (wilayah yang terang pada lapisan sel inang yang ditumbuhakan dalam media agar) (Schlegel, 1994).B. TujuanTujuan praktikum Pengamatan Virus pada Bakteri dengan Metode Plaque adalah untuk mengetahui ada tidaknya virus yang melisiskan sel bakteri, yang terlihat dari zona jernih atau adanya plaque yang terbentuk di dalam media NA yang telah diinokulasi sampel dan bakteri Escherichia coli.
II. MATERI DAN METODEA. Materi
Alat-alat yang digunakan antara lain labu erlenmeyer, cawan petri, tabung reaksi, tabung microsentrifuge 1,5 ml, membran filter milipore 0,45m, botol steril, microsentrifuge, pembakar spirtus, alkohol, korek api, wrapper, label, pipet ukur 1 ml, filler, batang druglasky, mikropipet, tip dan shaker inkubator. Bahan-bahan yang digunakan yaitu media NA (Nutrient Agar), alkohol 70%, inokulum Esherichia coli, media Luria Bertani, sampel air toilet, dan PBS (phosfat buffer saline).B. Metode
1. Pengkayaan bakteriofage dengan dimasukan 10 ml sampel air toilet dari tiap masing-masing kelompok kedalam labu erlenmeyer perlakuan.2. Inokulum E. coli dimasukan kedalam labu erlenmeyer perlakuan sebanyak 7,5 ml, setelah itu dimasukan media LB (Luria Bertani) dengan volume 7,5 ml.3. Kontrol dibuat dengan dimasukan 7,5 ml inokulum E. coli dan 7,5 ml media LB kedalam labu erlenmeyer kontrol.4. Labu erlenmeyer di wrapping dan di inkubasi 1x24 jam dengan suhu 37C di dalam shaker inkubator.5. Labu erlenmeyer yang berisi 75 ml campuran perlakuan dimasukan kedalam 10 tabung microcentrifuge masing-masing 1,5 ml dan disentrifugasi 2000 rpm selama menit. Supernatan yang terbentuk diambil dan dikumpulkan setelah itu disaring dengan membran filter milipore hingga membentuk filtrat. 6. Filtrat yang terbentuk kemudian dimasukan sebanyak 0,1 ml kedalam tabung effendorf yang sudah berisi 0,9 ml PBS (Phosfat Buffer Saline), dilakukan pengenceran bertingkat sampai 10. 7. Dua buah tabung pengenceran terakhir dimasukan 0,5 ml E. coli hingga terbentuk suspensi faga dan diinkubasi selama 10 menit suhu 37C.8. Suspensi faga sebanyak 0,6 ml masing-masing dimasukan kedalam media LB 7 ml lalu diplatting cawan dan diinkubasi 2x24 jam dengan suhu 37C. Plaque yang terbentuk kemudian diamati dan dihitung jumlahnya.I. HASIL DAN PEMBAHASANA. HasilTabel 1. Hasil Pengamatan PlaqueKelompokPlaque 10 PFUs/ mlPlaque 10 PFUs/ mlKontrol
13,2 x 101,917 x 10-
23,33 x 102 x 10-
31,67 x 102,67 x 10-
46 x 1010-
5-6 x 10-
61,5 x 108,3 x 10 -
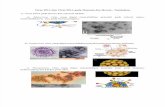
Gambar Hasil Pengamatan
B. Pembahasan
Berdasarkan hasil pengamatan keberadaan virus yang melisiskan bakteri, kelompok pertama yang menggunakan limbah kotoran sapi, pada cawan kontrol yang berisi bakteri Escherichia coli tidak terbentuk plaque, pada cawan kedua yang berisi limbah kotoran sapi terdapat plaque yang ditandai dengan adanya zona jernih, sedangkan pada cawan ketiga yang berisi limbah kotoran sapi dan bakteri E. coli juga terdapat plaque. Terdapat kemungkinan bahwa di dalam limbah kotoran sapi yang diinokulasi ke dalam cawan kontrol memang sudah terdapat virus yang kemudian dapat melisiskan bakteri dalam limbah tersebut. Pada cawan kelompok kedua, ketiga, keempat, dan keenam berturut turut menggunakan limbah kotoran kambing, ayam, kelinci, bebek dan manusia perlakuannya tidak ditemukan plaque sama sekali. Hal tersebut kemungkinan dikarenakan virus tidak masuk ke dalam fase litik untuk melisiskan sel bakteri atau tidak terdapat virus pada limbah tersebut sehingga tidak terbentuk plaque. Sesuai dengan pernyataan Alexopoulus (1964), bahwa plaque merupakan struktur visibel yang dibentuk oleh adanya kultur sel seperti kultur bakteri dalam medium nutrien. Plaque (zona jernih) terbentuk karena adanya aktifitas virus bakteri yang mereplikasi dan merusak struktur selpada bakteri. Metode plaque merupakan metode standar yang digunakan untuk menentukan konsentrasi virus dalam hal dosis infeksi. Metode plaque digunakan untuk menentukan jumlah unit pembentuk plaque dalam sampel virus yang merupakan salah satu ukuran kuantitas virus. Uji ini didasarkan pada metode mikrobiologi dilakukan dalam cawan petri (Kaufmann, 2002). Metode plaque diperkenalkan pada tahun 1952 oleh Rennato Dulbecco sebagai uji virologisyang digunakan untuk menghitung danmengukur infektifitas bakteriofag. Apabila satu sel terinfeksi oleh satu virus maka akan menyebar dan menginfeksi ke sel di sekitarnya. Uji plaque sering digunakan karena tidak memakan waktu dan biaya, serta tekniknya tidak terlalu sulit (Atlas, 1997). Salah satu kekurangan metode plaque adalah tidak dapat mengetahui jenis bakteriofag yang memiliki siklus hidup lisogenik.Menghitung jumlah plaque dapat digunakan sebagai metode kuantifikasi virus. Plaque ini kadang-kadang dapat dideteksi secara visual menggunakan colony counter, dalam banyak cara yang sama seperti koloni bakteri yang dihitung. Namun, mereka tidak selalu terlihat dengan mata telanjang, dan kadang-kadang hanya dapat dilihat melalui mikroskop, atau menggunakan teknik seperti pewarnaan atau immunofluorescence. Sistem komputer khusus telah dirancang dengan kemampuan untuk memindai sampel dalam batch (Finter, 1969).Teknik pendeteksian virus juga dapat digunakan pada kasus ancaman bioteroris yaitu pengkontaminasian minuman dengan virus secara sengaja. Bakteri dan fungi dapat dengan mudah didapatkan dengan sentrifugasi, sedangkan virus sulit untuk didapatkan dari minuman yang terkontaminasi virus. Pendeteksian virus tersebut menggunakan Viro-Adembeads, sebuah sistem penangkap virus dengan cepat menggunakan manik-manik magnetik anion berlapis polimer, didapatkan virus-virus dari minuman yang terkontaminasi secara sengaja, yaitu Vaccinia virus dan Herpesvirus 8 pada manusia. PCR menunjukkan bahwa laju pemulihan dari virus kontaminan pada teh hijau dan jus jeruk lebih rendah dari pada virus dalam susu dan air (Hatano et al, 2010).
Virus dalam siklus hidupnya memerlukan lingkungan sel yang hidup seperti sel bakteri, selhewan, maupun sel tumbuhan untuk bereproduksi. Menurut Campbell (2004), ada dua macam cara virus menginfeksi sel hospes (inang), yaitu daur litik dan lisogenik.a. Infeksi secara litik
1. Fase adsorpsi dan infeksi
Virus akan melekat atau menginfeksi daerah tertentu dari dinding sel hospes yang disebut reseptor. Daerah ini spesifik bagi virus tertentu, dan virus jenis lain tidak dapat melekat di tempat tersebut. Virus tidak memiliki enzim untuk metabolisme, tetapi memliki enzim lisozim yang berfungsi merusak atau melubangi dindingsel hospes. Dinding sel hospes yang terhidrolisis oleh lisozim mengakibatkan seluruh isi virus berupa DNA atau RNA masuk ke dalam hospes. Virus kemudian merusak dan mengendalikan DNA inangnya. 2. Fase replikasi (fase sintesis)
DNA virus mereplikasi diri dengan tetap mengendalikan DNA hospes sebagai bahan, serta membentuk selubung protein. Beratus-ratus molekul DNAbaru virusyang lengkap dengan selubungnya berhasil disintesis.
3. Fase pembebasan virus (fase lisis)Virus mengalami pendewasaan, sel hospes akan pecah (lisis) dan mengalami kehancuran sehingga virus-virus baru yang infeksius dapat keluar. b. Infeksi secara lisogenik
1. Fase adsorpsi dan infeksi
Virus menempel pada reseptor yang spesifik kemudian melakukan penetrasi pada hospes dengan mengeluarkan DNA atau RNAnya ke dalam tubuh hospes.2. Fase penggabungan atau integrasiDNA atau RNA virus bersatu dengan asam nukleat hospes membentuk profaga. 3. Fase pembelahanPembelahan diri sel hospes akan diikuti juga dengan pembelahan profag, sehingga dua sel anakan hospes mengandung profag didalam selnya. Hal ini akan berlangsung terus-menerus selama sel bakteriyang mengandung profag membelah. Profaga mungkin saja dapat memasuki fase litik akibat sinar UV atau kondisi sel inang yang tidak menguntungkan profaga tersebut.
Resistensi bakteri terhadap antibiotik merupakan kendala yang sangat serius dalam proses terapi infeksi bakteri. Bakteriofag, suatu jenis virus yang mampu secara spesifik menyerang bakteri, telah dikembangkan sebagai alternatif terapi. Bakteriofag sebagai musuh alami bakteri berpotensi untuk dimanfaatkan sebagai terapi pada kasus infeksi bakteri yang resisten terhadap antibiotik. Berdasarkan sifatnya dalam menginfeksi bakteri, terdapat 2 jenis bakteriofag yaitu lytic dan lysogenic bacteriophage. Ciri virus bakteriofag yang dapat digunakan sebagai terapi adalah memiliki kapabilitas dasar sebagai lytic phages, yaitu menginfeksi dan membunuh sel bakteri dengan melisiskan bakteri. Lysogenic phages merupakan jenis virus yang berintegrasi dengan asam nukleat bakteri terinfeksi, yang pada saat ini jenis faga tersebut belum dapat digunakan sebagai terapi, karena akan mengalami fase dorman di dalam sel pejamu; dapat menghambat bakteriofag jenis yang sama masuk; serta seringkali memiliki gen toksik didalam genomnya (Putra et al, 2012).
Bakteriofag jenis lytic phages mampu melisiskan sel bakteri melalui tahapan adsorpsi dan injeksi, replikasi, packaging, completion, dan disrupsi sel membran. Tahapan adsorpsi dan injeksi, bakteriofag berikatan dengan reseptor pada permukaan sel bakteri yang biasanya berupa rangkaian protein atau gula. Sebagian besar bakteriofag bersifat spesifik terhadap reseptor tersebut, namun ada sejumlah kecil bakteriofag disebut dengan polyvalent phages yang memiliki potensi untuk menginfeksi berbagai macam spesies bakteri. Spesifisitas sel target yang tinggi merupakan sebuah keuntungan, karena bila digunakan sebagai terapi infeksi bakteri, faga tidak akan menyerang flora normal ataupun sel tubuh manusia. Pasca terjadi adesi, DNA bakteriofag diinjeksikan ke dalam sitoplasma bakteri. DNA tersebut menjadi mRNA yang tugasnya membentuk bagian-bagian dari virus untuk proses replikasi. Komponen-komponen bakteriofag telah lengkap, asam nukleat hasil replikasi akan masuk ke dalam kapsid (tahap packaging), dan akan digabungkan dengan komponen lainnya seperti bagian leher dan ekor (tahap completion). Bakteriofag yang telah terbentuk secara sempurna akan keluar dari bakteri dengan menggunakan enzim holin dan endolisin, yang diproduksi melalui pengkodean DNA bakteriofag. Lisin berfungsi sebagai hidrolase peptidoglikan, sedangkan holing membentuk lubang pada membran sel, sehingga mempermudah lisin untuk menembus lapisan luar bakteri yang merupakan lapisan peptidoglikan (Putra et al, 2012).
Escherichia coli (E. coli) adalah bakteri dalam kelompok Enterobacteriaceae yang bersifat Gram negatif, anaerobik fakultatif, berbentuk batang, tidak membentuk spora, fermentatif dan biasanya bergerak dengan flagela peritrika. E. coli merupakan organisme yang biasanya hidup dalam saluran usus manusia dan pada hewan tingkat tinggi lainnya merupakan prokariotis yang paling banyak dipelajari. E. coli tidak mempunyai membran yang mengelilingi materi genetik didalamnya. Dinding luar selnya dilapisi oleh selongsong atau kapsul yang terbentuk dari senyawa berlendir. Membran sel terdiri dari molekul lipid yang membentuk dua lapisan tipis dengan berbagai protein yang membentuk lapisan tersebut. Membran ini bersifat selektif permeabel dan mengandung protein yang dapat melangsungkan pengangkutan nutrien tertentu ke dalam sel dan hasil buangan ke luar sel (Cahyonugroho, 2010). Pengamatan virus pada bakteri dengan metode plaque ini menggunakan bakteri Escherichia coli karena biasanya terkandung dalam kotoran hewan dan manusia, mudah ditemukan, didapat, serta dikultivasi dalam media buatan. Limbah ternak adalah sisa buangan hewan-hewan ternak dari suatu kegiatan usaha peternakan seperti pemeliharaan ternak, rumah potong, pengolahan produk ternak, dan sebagainya. Limbah tersebut meliputi limbah padat dan limbah cair seperti feses, urin, sisa makanan, embrio, kulit telur, lemak, darah, bulu, tulang, tanduk, isi rumen, dan lain-lain (Sihombing, 2000). Alasan penggunaan limbah kotoran karena diduga mengandung berbagai macam mikroba, di antaranya adalah protozoa, fungi, bakteri, dan virus. Sampel yang digunakan berasal darilimbah cair kotoran sapi, kambing, bebek, ayam, kelinci, bebek dan manusia. Virus yang di ketahui dapat menyebabkan infeksi saluran pencernaan seperti rotavirus, norovirus, astrovirus.
IV. KESIMPULAN DAN SARANA. Kesimpulan
Berdasarkan hasil dan pembahasan sebelumnya dapat diambil kesimpulan :
1. Terdapat virus yang melisiskan bakteri (bakteriofag), yaitu pada cawan media NA hasil inokulasi limbah cair kotoran sapi serta cawan media NA hasil inokulasi limbah cair kotoran sapi dan bakteri E. coli.2. Adanya virus yang melisiskan sel bakteri ditandai dengan munculnya plaque atau zona jernih di dalam media NA yang telah diinokulasi sampel dan bakteri E. coli.B. Saran
Sebaiknya digunakan juga metode pendeteksian virus yang lain selain metode plaque.DAFTAR REFERENSI
Alexopoulus. 1964. Introductary of Microbiology. John Willey and son. New York.
Atlas, R. M. 1997. Principles of Microbiology. WMC Brown, London.Cahyonugroho, Okik Hendriyanto. 2010. Pengaruh intensitas sinar ultraviolet dan pengadukan terhadap reduksi jumlah bakteri E. coli. Jurnal Ilmiah Teknik Lingkungan. 2 (1):18-23.Campbell, N. A. 2004. Biologi. Erlangga, Jakarta.Finter, N. B. 1969. Dye Uptake Methods for Assessing Viral Cytopathogenicity and Their Application to Interferon Assays. Journal of General Virology. 5 (3): 419427.Kaufmann, S.H.; Kabelitz, D. 2002. Methods in Microbiology: Immunology of Infection. Academic Press. 32.Hatano, Ben, A. Kojima, T. Sata, and H. Katano. 2010. Virus detection using viro-adembeads, a rapid capture system for viruses, and plaque assay in intentionally virus-contaminated beverages. J. Infect. Dis. 63: 52-54.Putra, Bayushi Eka dan A. Karuniawati. 2012. Bakteriofag sebagai potensi baru tata laksana infeksi bakteri resisten. J Indon Med Assoc. 62: 113-117
Schlegel, H. G. and Schmidt, K. 1994. Mikrobiologi Umum. Gadjah Mada University Press. Yogyakarta.Sihombing, D. T. H. 2000. Teknik Pengelolaan Limbah Kegiatan/Usaha Peternakan. Pusat Penelitian Lingkungan Hidup Lembaga Penelitian. Institut Pertanian Bogor, Bogor.Gambar 1.
Kontrol
E. coli
Gambar 2.
Limbah Kotoran Sapi
Gambar 4. Siklus Hidup Virus (Campbell, 2004)
Gambar 3.
Limbah Kotoran Sapi +
E. coli