.Dasar Teori Biofar Uji Disolusi Metformin
-
Upload
aynita-kurniawan -
Category
Documents
-
view
300 -
download
2
Transcript of .Dasar Teori Biofar Uji Disolusi Metformin

Dasar Teori
Disolusi obat adalah suatu proses hancurnya obat (tablet) dan terlepasnya zat-zat aktif
dari tablet ketika dimasukkan ke dalam saluran pencernaan dan terjadi kontak dengan cairan
tubuh. Pemikiran dilakukannya uji hancurnya tablet didasarkan pada kenyataan bahwa tablet
itu pecah menjadi partikel-partikel kecil, sehingga daerah permukaan media pelarut menjadi
lebih luas, dan akan berhubungan dengan tersedianya obat di dalam cairan tubuh. Namun
sebenarnya uji hancur hanya menyatakan waktu yang diperlukan tablet untuk hancur di
bawah kondisi yang ditetapkan, dan lewatnya seluruh partikel melalui saringan berukuran
mesh-10. Uji ini tidak memberi jaminan bahwa partikel-partikel itu akan melepaskan bahan
obat dalam larutan dengan kecepatan yang seharusnya. Itu sebabnya uji disolusi dan
ketentuan uji dikembangkan bagi hampir seluruh produk tablet. Laju absorbsi dari obat-obat
bersifat asam yang diabsorbsi dengan mudah dalam saluran pencernaan sering ditetapkan
dengan laju larut obat dari tablet. Bila yang menjadi tujuan adalah untuk memperoleh kadar
yang tinggi dalam darah, maka cepatnya obat dan tablet melarut biasanya menjadi sangat
menentukan. Karena itu laju larut dapat berhubungan langsung dengan efikasi (kemanjuran)
dari tablet dan perbedaan bioavailabilitas dari berbagai formula (Lachman, 1994).
Uji disolusi digunakan untuk menentukan kesesuaian dengan persyaratan disolusi
yang tertera dalam masing – masing monografi untuk sediaan tablet dan kapsul, kecuali pada
etiket dinyatakan bahwa tablet harus dikunyah. Persyaratan disolusi ini tidak berlaku untuk
kapsul gelatin lunak, kecuali bila dinyatakan dalam masing – masing monografi. Bila dalam
etiket dinyatakan bahwa sediaan bersalut enterik, sedangkan dalam masing – masing
monografi, uji disolusi atau uji waktu hancur tidak secara khusus dinyatakan untuk sediaan
bersalut enteric, maka digunakan cara pengujian untuk sediaan lepas lambat, seperti yang
tertera pada Uji Pelepasan Obat , kecuali dinyatakan lain dalam masing – masing monografi.
(Anonim, 1995).
Uji disolusi yang diterapkan pada sediaan obat bertujuan untuk mengukur serta
mengetahui jumlah zat aktif yang terlarut dalam media pelarut yang diketahui volumenya
pada waktu dan suhu tertentu, menggunakan alat tertentu yang didesain untuk uji
parameter disolusi. Uji disolusi digunakan untuk berbagai alasan dalam industri; dalam
pengembangan produk baru, untuk pengawasan mutu, dan untuk membantu menentukan
kesetaraan hayati. Perkembangan regulasi terbaru, seperti skema klasifikasi biofarmasetika,
telah menegaskan pentingnya disolusi dalam peraturan tentang perubahan setelah mendapat

izin dan memperkenalkan kemungkinan mengganti uji klinis dengan uji disolusi dalam kasus-
kasus tertentu (Dressman dkk, 1998).
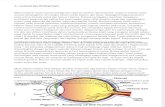
Alat uji disolusi menurut Farmakope Indonesia edisi IV:
- Alat uji disolusi tipe keranjang (basket)
- Alat uji disolusi tipe dayung (paddle)
Alat untuk uji pelepasan obat menurut USP 29, NF 24:
1. Alat uji pelepasan obat tipe keranjang (basket)
2. Alat uji pelepasan obat tipe dayung (paddle)
3. Alat uji pelepasan obat tipe reciprocating cylinder
4. Alat uji pelepasan obat tipe flow through cell
5. Alat uji pelepasan obat tipe paddle over disk
6. Alat uji pelepasan obat tipe silinder
7. Alat uji pelepasan obat tipe reciprocating holder
Medium disolusi idealnya diformulasi semirip mungkin dengan pH in vivo (cairan
gastrointestinal). Misalnya, medium disolusi yang didasarkan pada 0,1 N HCl digunakan
untuk menurunkan pH mendekati pH lambung, yaitu sekitar 1-3.
Efektivitas dari suatu tablet dalam melepas obatnya untuk absorpsi sistemik agaknya
bergantung pada laju disintegrasi dari bentuk sediaan dan deagregasi dari granul-granul
tersebut. Tetapi yang biasanya lebih penting adalah laju disolusi dari obat padat tersebut.
Seringkali disolusi merupakan tahapan yang membatasi atau tahap yang mengontrol laju
bioabsorpsi obat-obat yang mempunyai kelarutan rendah, karena tahapan ini seringkali
merupakan tahapan yang paling lambat dari berbagai tahapan yang ada dalam penglepasan
obat dari bentuk sediaannya dan perjalannya ke dalam sirkulasi sistemik. Bila suatu tablet
atau sediaan obat lainnya dimasukkan ke dalam beaker yang berisi air atau dimasukkan ke

dalam saluran cerna (saluran gastrointestin), obat tersebut mulai masuk ke dalam larutan dari
bentuk padatnya. Kalau tablet terbentuk tidak dilapisi polimer, matriks padat juga mengalami
disintegrasi menjadi granul-granul, dan granul-granul ini mengalami pemecahan menjadi
partikel-partikel yang halus. Disintegrasi, degradasi, dan disolusi bisa berlangsung secara
serentak dengan melepasnya suatu obat dari bentuk dimana obat tersebut diberikan (Martin,
1990).
Dalam pemilihan media disolusi, dapat dipertimbangkan hal-hal berikut:
- Jika kelarutan zat aktif tidak dipengaruhi pH, maka sebagai media dapat digunakan
aquades
- Jika kelarutan zat aktif dipengaruhi oleh pH, maka sebagai media disolusi digunakan
cairan lambung atau usus buatan.
Selain pertimbangan kelarutan, pemilihan cairan disolusi dapat berdasarkan pada
formulasi dan stabilitas zat aktif. Jika suatu zat aktif merupakan suatu molekul netral dan
kelarutannya dalam air sangat kecil sehingga penentuan kecepatan disolusi dalam air tidak
ada artinya maka dapat digunakan sistem pelarut hidro-alkohol, namun alkohol dapat
menyebabkan desintegrasi yang tidak realistis.
(Kurniawan, 2010).
Volume media disolusi
Volume media disolusi tergantung dari kelarutan zat aktif yang akan ditentukan
kecepatan disolusinya. Jika kelarutan suatu zat aktif kecil dan kadarnya cukup besar dalam
suatu sediaan, maka diperlukan media disolusi dalam volume yang cukup besar. Penjenuhan
cairan disolusi sebaiknya dicegah, sebagai acuan dapat digunakan bahwa volume media
disolusi yang digunakan dalam suatu pengujian disolusi minimal 4 kali lebih besar daripada
volume media di mana zat aktif tersebut dapat larut seluruhnya.
Suhu
Suhu dalam wadah disolusi harus dikendalikan secara seksama. Kelarutan zat aktif
tergantung juga pada suhu media, karena itu variasi suhu selama pengujian harus dihindari.

Wadah disolusi biasanya tercelup dalam penangas air yang dilengkapi dengan termostat.
Suhu yang biasa digunakan adalah 37 derajat Celcius.
Lokasi Pengambilan Alikot
Jika suatu sediaan tablet terdesintegrasi menjadi partikel-partikel halus dan perbedaan
bobot jenis antara partikel dan media disolusi cukup kecil, maka pengambilan alikot dapat
dilakukan di mana saja pada wadah disolusi. Menurut USP XXII pengambilan alikot
dilakukan pada suatu titik/tempat tertentu dalam wadah disolusi yaitu pada posisi antara alat
pengaduk (keranjang/dayung) dan permukaan atas media dan tidak kurang dari 1 cm dari
dinding wadah.
Lama Pengujian
Lama pengujian tergantung kelarutan zat aktif. Pengujian dilakukan paling sedikit
sampai diperoleh T 80% atau lebih.
Waktu Pengambilan Sampel
Waktu pengambilan alikot disesuaikan dengan monografi, biasanya dicantumkan %
terdisolusi dalam waktu tertentu. Untuk mengetahui profil disolusi zat aktif maka
pengambilan sampel harus dilakukan pada rentang waktu tertentu.
(Kurniawan, 2010)
Dalam praktikum kali ini kami melakukan uji disolusi meftormin. Metformin
merupakan obat antidiabetik oral yang berbeda dari golongan sulfonilurea baik secara
kimiawi maupun dalam cara bekerjanya. Obat ini merupakan suatu biguanida yang
tersubsitusi rangkap yaitu Metformin (dimethylbiguanide) Hydrochloride. Mekanisme kerja
Metformin antara lain :
Metformin merupakan zat antihiperglikemik oral golongan biguanid. Mekanisme
kerja Metformin menurunkan kadar gula darah dan tidak meningkatkan sekresi
insulin.
Metformin tidak mengalami metabolisme di hati, diekskresikan dalam bentuk yang
tidak berubah terutama dalam air kemih dan sejumlah kecil dalam tinja.

Metformin diindikasikan untuk Untuk terapi pada pasien diabetes yang tidak
tergantung insulin dan kelebihan berat badan dimana kadar gula tidak bisa dikontrol dengan
diet saja. Dapat dipakai sebagai obat tunggal atau dapat diberikan sebagai obat kombinasi
dengan Sulfonilurea. Untuk terapi tambahan pada penderita diabetes dengan ketergantungan
terhadap insulin yang simptomnya sulit dikontrol (Tatro, 2003).
Berikut merupakan faktor yang mempengaruhi kecepatan pelarutan suatu zat yaitu :
· Temperatur
Naiknya temperatur umumnya memperbesar kelarutan zat yang endotermis, serta
memperbesar harga koefisien difusi zat.
· Viskositas
Turunnya viskositas pelarut akan memperbesar kecepatan pelarutan suatu zat sesuai dengan
persamaan Einstein. Naiknya temperatur juga akan menurunkan viskositas sehingga
memperbesar kecepatan pelarutan.
· pH Pelarut
pH pelarut sangat berpengaruh terhadap kelarutan zat-zat yang bersifat asam lemah atau basa
lemah.
· Pengadukan
Kecepatan pengadukan akan mempengaruhi tebal lapisan difusi. Bila pengadukan cepat maka
tebal lapisan difusi berkurang sehingga
menaikkan kecepatan pelarutan suatu zat.
· Ukuran Partikel
Bila partikel zat terlalu kecil maka luas permukaan efektif besar sehingga menaikkan
kecepatan pelarutan suatu zat.
· Polimorfisa
Kelarutan suatu zat dipengaruhi oleh adanya polimorfisa. Karena bentuk kristal yang berbeda
akan mempunyai kelarutan yang berbedapula. Kelarutan bentuk kristal yang meta stabil lebih
besar daripada yang bentuk stabil, sehingga kecepatan pelarutannya besar.

· Sifat permukaan zat
Pada umunya zat-zat yang digunakan sebagai bahan obat bersifat hidrofob, dengan adanya
surfaktan di dalam pelarut akan menurunkan tegangan permukaan antara partikel dengan
pelarut, sehingga mudah terbasahi dan kecepatan pelarutan bertambah.
(Raini, 2010).

Daftar Pustaka
Anonim, 1995, Farmakope Indonesia Edisi IV, Depkes RI, Jakarta.
Tatro D.S. , 2003, A to Z Drug Facts, Facts and Comparisons, San Francisco.
Dressman dkk, 1998, Dissolution testing as a prognostic tool for oral drug absorption:
immediate release dosage forms, http://www.ncbi.nlm.nih.gov.
Lachman, Leon, 1994, Teori dan Praktek Farmasi Industri II, Universitas Indonesia Press,
Jakarta. Halm :659-660
Kurniawan, Dhadhang Wahyu, 2010, Uji Disolusi,
http://dhadhang.wordpress.com/2010/12/08/uji-disolusi-2 (Diakses tanggal 28 November
2013).
Martin, Alfred, 1990, Farmasi Fisik, Dasar-Dasar Kimia Fisik dalam Ilmu Farmasetik. UIP
Press. Jakarta. Halm: 845-846
United State Pharmacopeia. 2005. USP 29-NF 24. Rockville.
Raini M, 2010, Uji Disolusi dan Penetapan Kadar Tablet Loratadin,
ejournal.litbang.depkes.go.id (Diakses Pada tanggal 29 November 2013).