CML
-
Upload
prihastami-agustina -
Category
Documents
-
view
118 -
download
8
description
Transcript of CML

BAB 1PENDAHULUAN
1.1 Latar BelakangMyelogenous leukemia kronis (CML), dikenal juga dengan nama leukemia myeloid
kronik (chronic myeloid leukemia) merupakan suatu jenis kanker dari leukosit. CML adalah
bentuk leukemia yang ditandai dengan peningkatan dan pertumbuhan yang tak terkendali dari
sel myeloid pada sumsum tulang, dan akumulasi dari sel-sel ini di sirkulasi darah. CML
merupakan gangguan stem sel sumsum tulang klonal, dimana ditemukan proliferasi dari
granulosit matang (neutrofil, eosinofil, dan basofil) dan prekursornya. Keadaan ini merupakan
jenis penyakit myeloproliferatif dengan translokasi kromosom yang disebut dengan kromosom
Philadelphia.1
Kejadian leukemia mielositik kronik mencapai 20% dari semua leukemia pada dewasa,
kedua terbanyak setelah leukemia limfositik kronik. pada umumnya menyerang usia 40-50
tahun, walaupun dapat ditemukan pada usia muda dan biasanya lebih progresif. Di Jepang
kejadiannya meningkat setelah peristiwa bom atom di Nagasaki dan Hiroshima, demikian juga
di Rusia setelah reaktor Chernobyl meledak.2
Dalam perjalanan penyakitnya, leukemia mielositik kronik dibagi menjadi 3 fase, yaitu:
fase kronik, fase akselerasi, dan fase krisis blast. Pada umumnya, saat pertama kali diagnosis
ditegakkan, pasien masih dalam fase kronik, bahkan seringkali diagnosis leukemia mielositik
kronik ditemukan secara kebetulan, misalnya saat persiapan pra-operasi, dimana ditemukan
leukositosis hebat tanpa gejala infeksi.3 Selanjutnya untuk penegakan diagnosis memerlukan
pemeriksaan hapusan darah tepi, serta pemeriksaan sumsum tulang.1,3 Oleh karena pentingnya
diagnosis penyakit ini, penulis menyusun makalah mengenai leukemia mielositik kronik ini.
1.2 Tujuan1. Mengetahui patofisiologi leukemia mielositik kronik
2. Mengetahui diagnosis leukemia mielositik kronik
3. Mengetahui penatalaksanaan leukemia mielositik kronik

BAB 2LEUKEMIA MIELOSITIK KRONIK
2.1 DefinisiLeukemia granulositik kronik atau Chronic Myelogenous Leukemia (CML) merupakan
kelainan myeloproliferative yang ditandai dengan peningkatan proliferasi dari seri sel granulosit
tanpa disertai gangguan diferensiasi, sehingga pada apusan darah tepi dapat ditemukan
berbagai tingkatan diferensiasi seri granulosit, mulai dari promielosit (bahkan mieloblas), meta
mielosit, mielosit, sampai granulosit.2
2.2 EpidemiologiCML adalah salah satu dari beberapa kanker diketahui disebabkan oleh mutasi tunggal
genetik tertentu. Lebih dari 90% kasus dihasilkan dari kelainan sitogenetika dikenal sebagai
kromosom Philadelphia.
CML menyumbang 20% dari semua leukemia mempengaruhi orang dewasa. Leukemia
jenis ini sering menyerang individu setengah baya. Penyakit ini jarang terjadi pada individu yang
lebih muda. Pasien yang lebih muda mungkin mengalami bentuk yang lebih agresif dari CML,
seperti pada fase akselerasi atau krisis blast. Leukemia jenis ini dapat muncul sebagai penyakit
onset baru pada orang tua.
2.3 PatofisiologiCML adalah kelainan diperoleh yang melibatkan sel batang hematopoietik. Hal ini
ditandai oleh kelainan sitogenetika terdiri dari translokasi timbal balik antara lengan panjang
kromosom 22 dan 9 [t (9; 22)]. Hasil translokasi dalam kromosom, dipersingkat 22 pengamatan
pertama dijelaskan oleh Nowell dan Hungerford dan kemudian disebut kromosom Philadelphia
(Ph1).

Gambar 2.1 Kromosom Philadelphia
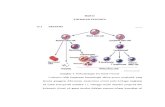
Seperti yang telah dijelaskan di atas, gen BCR-ABL pada kromosom Ph menyebabkan
proliferasi yang berlebihan dari sel induk pluripoten pada system hematopoiesis. Klon-klon ini,
selain proliferasinya berlebihan, juga dapat bertahan hidup lebih lama disbanding sel normal,
karena gen BCR-ABL juga bersifat anti-apoptosis. Dampak kedua mekanisme di atas adalah
terbentusknya klon-klon abnormal yang akhirnya mendesak system hematopoiesis lainnya.
Mekanisme terbentuknya kromosom Ph dan waktu yang dibutuhkan sejak terbentuknya
Ph sampai menjadi CML dengan gejala klinis yang jelas, hingga kini masih belum diketahui
secara pasti. Berdasarkan kejadian Hiroshima dan Nagasaki, diduga Ph terjadi akibat pengaruh
radiasi, sebagian ahli berpendapat akibat mutasi spontan. Sejak tahun 1980 diketahui bahwa
translokasi ini menyebabkan pembentukan gen hybrid BCR-ABL pada kromosom 22 dan gen
resiprokal ABL-BCR pada kromosom 9.
Gen hybrid BCR-ABL yang berada dalam kromosom Ph ini selanjutnya mensintesis
protein 210 kD yang berperan dalam lekemogenesis, sedangkan peran gen resiprokal ABL-
BCR tidak diketahui. Jadi sebenarnya gen BCR-ABL pada kromosom Ph (22q-) selalu terdapat
pada semua pasien CML, tetapi gen BCR-ABL pada 9q+ hanya terdapat pada 70% pasien
CML. Dalam perjalanan penyakitnya, pasien dengan Ph+ lebih rawan terhadap adanya kelainan
kromosom tambahan, hal ini terbukti pada 60-80% pasien Ph+ yang mengalami fase krisis blas

ditemukan adanya trisomi 8, trisomi 19, dan isokromosom lengan panjang kromosom 17i (17)q.
dengan kata lain selain gen BCR-ABL, ada beberapa gen-gen lain yang berperan dalam
patofisiologi CML atau terjadi abnormalitas dari gen supresor tumor, seperti gen p53, p16, dan
gen Rb.
Gambar 2.2 Patofisiologi Leukemia Mielositik Kronik
2.4 Diagnosis2.4.1 Anamnesis
Manifestasi klinis leukemia myelogenous kronis (CML) adalah membahayakan. Penyakit
ini sering ditemukan secara kebetulan dalam fase kronis, ketika didapatkan hitung leukosit
meningkat pada pemeriksaan darah rutin atau adanya splenomegali pada pemeriksaan fisik
umum. Gejala nonspesifik meliputi kelelahan dan penurunan berat badan dapat terjadi lama
setelah timbulnya penyakit. Kehilangan energi dan penurunan toleransi latihan dapat terjadi
selama fase kronis setelah beberapa bulan.
Pasien sering memiliki gejala yang berkaitan dengan pembesaran limpa, hati, atau
keduanya. Limpa besar dapat mengganggu pada lambung dan menyebabkan cepat kenyang
sehingga asupan makanan berkurang. Nyeri perut kuadran kiri atas digambarkan sebagai nyeri
dengan kualitas "mencengkeram" mungkin terjadi akibat infark limpa. Limpa yang membesar

juga dapat dikaitkan dengan keadaan hipermetabolik, demam, penurunan berat badan, dan
kelelahan kronis. Hati yang membesar dapat menyebabkan penurunan berat badan pasien.
Beberapa pasien dengan CML memiliki demam ringan dan berkeringat berlebihan terkait
dengan hipermetabolisme.
Pada beberapa pasien yang ada dalam fase akselerasi, atau fase akut dari penyakit
(melewatkan fase kronis), perdarahan, petechiae, ekimosis dan mungkin merupakan gejala
menonjol. Dalam situasi ini, demam biasanya berhubungan dengan infeksi. Nyeri tulang dan
demam, serta peningkatan fibrosis sumsum tulang, merupakan pertanda dari fase blast.
2.4.2 Pemeriksaan FisikSplenomegali adalah penemuan fisik yang paling umum pada pasien dengan leukemia
myelogenous kronis (CML). Dalam lebih dari 50% pasien dengan CML, limpa berukuran lebih
dari 5 cm di bawah batas kosta kiri pada saat penemuan. Ukuran limpa berkorelasi dengan
hitungan granulocyte darah perifer, dengan limpa terbesar yang diamati pada pasien dengan
jumlah leukosit yang tinggi. Sebuah limpa sangat besar biasanya pertanda transformasi menjadi
bentuk krisis blast akut dari penyakit.
Hepatomegali juga terjadi, meskipun kurang umum daripada splenomegali. Hepatomegali
biasanya bagian dari hematopoiesis extramedullary terjadi di limpa. Temuan fisik leukostasis
dan hiperviskositas dapat terjadi pada beberapa pasien, dengan ketinggian luar biasa leukosit
mereka penting, lebih dari 300,000-600,000 sel/uL. Setelah funduscopy, retina dapat
menunjukkan papilledema, obstruksi vena, dan perdarahan.
Krisis blast ditandai oleh peningkatan dalam sumsum tulang atau ledakan jumlah darah
perifer atau oleh perkembangan leukemia infiltrat jaringan lunak atau kulit. Gejala khas adalah
karena trombositopenia, anemia, basophilia, limpa cepat memperbesar, dan kegagalan obat
yang biasa untuk mengontrol leukositosis dan splenomegali.
2.4.3 Pemeriksaan PenunjangPemeriksaan untuk leukemia myelogenous kronis (CML) terdiri dari jumlah darah lengkap
dengan hitung diferensial, apusan darah tepi, dan analisis sumsum tulang. Meskipun khas
hepatomegali dan splenomegali dapat dicitrakan dengan menggunakan scan hati/limpa,
kelainan ini sering begitu jelas secara klinis sehingga pencitraan radiologis tidak diperlukan.
Diagnosis CML didasarkan pada temuan histopatologi dalam darah perifer dan Philadelphia
(Ph) kromosom dalam sel sumsum tulang.

Kelainan laboratorium lainnya termasuk hiperurisemia, yang merupakan refleksi dari
peningkatan selularitas sumsum tulang, dan peningkatan nyata serum vitamin B-12-binding
protein (TC-I). Yang terakhir ini disintesis oleh granulosit dan mencerminkan tingkat
leukositosis.
Tabel 2.1 Klasifikasi CML Berdasarkan WHO
Fase CML Definisi WHO
Fase Kronik Stabil Jumlah sel blast darah perifer kurang dari 10% pada darah dan sumsum
tulang
Fase Akselerasi Jumlah sel blasts 10-19% dari jumlah leukosit pada sel sumsum tulang
nucleated dan atau perifer; trombositopenia persisten (< 100 × 109/L) tidak
terkait dengan terapi atau trombositosis persisten (> 1000 × 109/L) tidak
responsive terhadap terapi; peningkatan jumlah leukosit dan ukuran limpa
tidak responsive terhadap terapi; bukti sitogenetik adanya clonal evolution
Krisis Blast Jumlah sel blast perifer ≥ 20% dari leukosit darah tepi atau sel sumsum
tulang nucleated; proliferasi blast ekstrameduler; dan focus atau kluster
besar blast pada biopsy sumsum tulang
1. Hapusan Darah Tepi Pada CML, peningkatan granulosit matang dan jumlah limfosit normal (persentase rendah
karena dilusi dalam hitungan diferensial) menghasilkan jumlah leukosit total 20,000-60,000
sel/uL. Kenaikan ringan pada basofil dan eosinofil terjadi dan menjadi lebih menonjol selama
masa transisi ke leukemia akut.
Proses apoptosis neutrofil matang/granulosit mengalami penurunan (kematian sel
terprogram), mengakibatkan akumulasi sel berumur panjang dengan enzim yang rendah atau
tidak ada, seperti alkalin fosfatase (ALP). Akibatnya, pada pengecatan alkali fosfatase leukosit
sangat rendah bahkan tidak ada pada sebagian besar sel, menghasilkan skor rendah.
Darah perifer pada pasien dengan CML menunjukkan gambaran darah khas
leukoeritroblastik, dengan sirkulasi sel dewasa dari sumsum tulang (Gambar 2.3).

Gambar 2.3 Hapusan Darah Tepi Pasien CML. fillm blood pada perbesaran 400x menunjukkan leukositosis dengan kehadiran sel-sel prekursor dari garis keturunan myeloid. Selain itu, basophilia, eosinofilia, dan trombositosis dapat dilihat. Courtesy of U. Woermann, MD, Divisi Media Instruksional, Lembaga Pendidikan Kedokteran, Universitas Bern, Swiss.
Fase transisi atau akselerasi CML ditandai dengan penurunan respon terhadap terapi
obat myelosuppressive, munculnya sel-sel blast perifer (≥ 15%), promyelocytes (≥ 30%), basofil
(≥ 20%), dan penurunan trombosit jumlah sampai kurang dari 100.000 sel/uL. Promyelocytes
dan basofil ditunjukkan pada Gambar 2.4.
Gambar 2.4. Hapusan Darah Tepi Pasien CML Fase Transisi. Film Blood pada perbesaran 1000X menunjukkan promyelocyte, eosinofil, dan basofil 3. Courtesy of U. Woermann, MD, Divisi Media Instruksional, Lembaga Pendidikan Kedokteran, Universitas Bern, Swiss.
Gambar 2.5 Hapusan Darah Tepi Pasien CML Fase Blast Film Blood pada perbesaran 1000X menunjukkan garis keturunan granulocytic keseluruhan, termasuk eosinofil dan basofil a. Courtesy of U. Woermann, MD, Divisi Media Instruksional, Lembaga Pendidikan Kedokteran, Universitas Bern, Swiss.

Tanda-tanda transformasi atau fase akselerasi pada pasien dengan CML adalah
penurunan respon terhadap obat-obatan myelosupresi atau interferon, meningkatnya sel blast
dalam darah tepi dengan basophilia dan trombositopenia tidak berhubungan dengan terapi,
kelainan sitogenetika baru, dan meningkatnya splenomegali dan myelofibrosis.
Di sekitar dua pertiga kasus, sel blast yang ditemukan adalah myeloid. Namun, pada
sepertiga kasus sisanya, sel blast yang ditemukan memperlihatkan fenotipe limfoid, bukti lebih
lanjut dari sifat sel induk penyakit asli. Kelainan kromosom tambahan biasanya ditemukan pada
saat fase blast krisis, termasuk tambahan Ph translokasi kromosom atau lainnya.
Sel myeloid awal seperti myeloblasts, mielosit, metamyelocytes, dan berinti sel darah
merah yang biasa hadir dalam hapusan darah, meniru temuan di sumsum tulang. Kehadiran
sel-sel progenitor yang berbeda midstage membedakan CML dari leukemia myelogenous akut,
di mana leukemic gap (maturation arrest) atau hiatus ada dan menunjukkan adanya sel-sel ini.
Anemia ringan sampai anemia sedang sangat umum pada saat diagnosis dan biasanya
normokromik normositik dan. Jumlah trombosit pada diagnosis bisa rendah, normal, atau
bahkan meningkat pada beberapa pasien (> 1 juta pada beberapa).
2. Analisis Sumsum TulangSumsum tulang bersifat hypercellular, dengan perluasan lini sel myeloid (misalnya,
neutrofil, eosinofil, basofil) dan sel progenitornya. Megakaryocytes (lihat gambar di bawah) yang
menonjol dan dapat ditingkatkan. Fibrosis ringan sering terlihat pada pengecatan reticulin.
Gambar 2.6 Hapusan Sumsum Tulang Pasien CML. Sumsum tulang Film pada perbesaran 400x menunjukkan dominasi jelas granulopoiesis. Jumlah eosinofil dan megakaryocytes meningkat. Courtesy of U. Woermann, MD, Divisi Media Instruksional, Lembaga Pendidikan Kedokteran, Universitas Bern, Swiss.
Pemeriksaan sitogenetik pada sel sumsum tulang, dan darah bahkan perifer, harus
mengungkapkan kromosom khas Ph1, yang merupakan translokasi resiprokal antara kromosom

dari bahan kromosom 9 dan 22 (lihat gambar di bawah). Ini adalah ciri khas CML, ditemukan di
hampir semua pasien dengan penyakit dan terdapat sepanjang perjalanan klinis seluruh CML.
Gambar 2.7 Philadelphia kromosom. Kromosom Philadelphia, yang merupakan kelainan karyotypic diagnostik untuk leukemia myelogenous kronis, akan ditampilkan dalam gambar ini dari kromosom banded 9 dan 22. Yang ditampilkan adalah hasil dari translokasi resiprokal 22q ke lengan bawah 9 dan 9q (c-ABL pada wilayah klaster breakpoint tertentu [bcr] kromosom 22 ditandai dengan panah). Courtesy of Peter C. Nowell, MD, Departemen Laboratorium Patologi dan Klinik dari University of Pennsylvania School of Medicine.
Selain itu, BCR chimeric / ABL messenger RNA (mRNA) yang menjadi ciri khas CML
dapat dideteksi oleh polymerase chain reaction (PCR). Ini adalah tes sensitif yang hanya
memerlukan beberapa sel dan berguna dalam memantau penyakit sisa minimal (MRD) untuk
menentukan efektivitas terapi. BCR-ABL transkrip mRNA juga dapat diukur dalam darah perifer
Analisis karyotypic sel sumsum tulang memerlukan keberadaan sel yang membelah
tanpa kehilangan viabilitas karena bahan mensyaratkan bahwa sel masuk ke mitosis untuk
mendapatkan kromosom individu untuk identifikasi setelah banding. Proses pemeriksaan ini
merupakan pemeriksaan yang memerlukan keahlian analis.
Teknik baru fluoresensi hibridisasi in situ (IKAN) menggunakan probe yang berlabel
hibridisasi baik kromosom metafase atau inti interfase, dan probe hibridisasi terdeteksi dengan
fluorochromes. Teknik ini merupakan cara yang cepat dan sensitif untuk mendeteksi kelainan
struktural numerik dan berulang. (Lihat gambar di bawah.)
Gambar 2.8 Fluoresensi hibridisasi in situ menggunakan unik-urutan, DNA probe ganda fusi untuk bcr (22q11.2) dengan warna merah dan c-ABL (9q34) gen daerah di hijau. Para bcr normal / ABL fusi hadir di Philadelphia kromosom-positif sel-sel dalam kuning (kanan panel) dibandingkan dengan kontrol (panel kiri). Courtesy of Emmanuel C. Besa, MD.

Dua bentuk mutasi BCR / ABL telah diidentifikasi. Ini bervariasi sesuai dengan lokasi
dari daerah mereka bergabung pada domain bcr 3 '. Sekitar 70% pasien yang memiliki 5
'breakpoint DNA memiliki pesan RNA b2a2, dan 30% pasien memiliki 3' breakpoint DNA dan
pesan RNA b3a2. Yang terakhir ini dikaitkan dengan fase kronis lebih pendek, kelangsungan
hidup lebih pendek, dan trombositosis.
CML harus dibedakan dari Ph1-negatif dengan hasil PCR negatif untuk BCR / ABL
mRNA. Penyakit ini termasuk gangguan myeloproliferative lain dan leukemia myelomonocytic
kronis, yang sekarang diklasifikasikan dengan sindrom myelodysplastic. Kelainan kromosom
tambahan, seperti kromosom Ph1-positif tambahan atau ganda atau trisomi 8, 9, 19, atau 21,
17 isochromosome, atau penghapusan kromosom Y, telah digambarkan sebagai pasien
memasuki sebuah bentuk transisi atau fase percepatan krisis blast.
Pasien dengan kondisi selain CML, seperti yang baru didiagnosis leukemia limfositik
akut (ALL) atau leukemia nonlymphocytic, mungkin juga mempunyai kromosom Ph1. Beberapa
menganggap pasien ini ada dalam fase blastic CML tanpa fase kronis. Kromosom ini jarang
ditemukan pada pasien dengan gangguan myeloproliferative lain, seperti polisitemia vera atau
thrombocythemia esensial, tetapi ini mungkin kondisi misdiagnosis leukemia myelogenous
kronis (CML). Hal ini jarang diamati dalam sindrom myelodysplastic.
2.5 Diagnosis BandingDiagnosis banding leukemia mielositik kronik meliputi:
• leukemia myeloid akut
• leukemia kronis myelomonocytic
• leukemia kronis neutrophilic
• Thrombocythemia
• Leukemoid reaksi dari infeksi (granulomatosa kronis [misalnya, tuberkulosis])
• Tumor nekrosis
• metaplasia myeloid Agnogenic Dengan Myelofibrosis
• Esensial Trombositosis
• Sindrom Myelodysplastic
• myeloproliferative disease
• Polisitemia Vera

2.6 PenatalaksanaanTujuan pengobatan leukemia myelogenous kronis (CML) telah berubah signifikan dalam
10 tahun terakhir meliputi:
1. Remisi hematologi (jumlah sel darah lengkap [CBC] normal dan pemeriksaan fisik
normal [yaitu, tidak ada organomegali])
2. Remisi sitogenetika remisi (kembali normal dengan sel kromosom Ph-positif 0%)
3. Remisi molekular ( hasil polymerase chain reaction negatif [PCR] untuk mutasi
BCR/ABL mRNA), yang merupakan upaya untuk penyembuhan dan memperpanjang
hidup pasien
CML memiliki 3 fase klinis: fase kronis awal, selama proses penyakit mudah dikontrol,
kemudian fase transisi dan tidak stabil (fase akselerasi), dan, akhirnya, tentu saja lebih agresif
(blast krisis), yang biasanya berakibat fatal. Dalam semua 3 fase, terapi suportif dengan
transfusi sel darah merah atau platelet dapat digunakan untuk meringankan gejala dan
meningkatkan kualitas hidup. Di negara-negara Barat, 90% pasien dengan CML didiagnosis
dalam tahap kronis. Jumlah sel darah putih pasien (WBC) biasanya dikontrol dengan obat-
obatan (remisi hematologi). Tujuan utama dari pengobatan selama fase ini adalah untuk
mengendalikan gejala dan komplikasi akibat anemia, trombositopenia, leukositosis, dan
splenomegali. Pengobatan standar pilihan sekarang mesylate imatinib (Gleevec), yang
merupakan molekul kecil inhibitor spesifik BCR / ABL dalam semua tahap CML.
Fase kronis bervariasi dalam durasi, tergantung pada terapi pemeliharaan yang
digunakan, biasanya berlangsung 2-3 tahun dengan terapi HU (Hydrea) atau busulfan, tetapi
dapat berlangsung selama lebih dari 9,5 tahun pada pasien yang merespon dengan baik untuk
terapi interferon-alfa. Selain itu, munculnya mesylate imatinib telah secara dramatis
meningkatkan durasi hematologi dan, memang, remisi sitogenetik. Beberapa pasien dengan
kemajuan CML pada fase transisi atau cepat, yang bisa berlangsung selama beberapa bulan.
Kelangsungan hidup pasien yang didiagnosis pada tahap ini adalah 1-1,5 tahun. Fase ini
ditandai dengan penurunan respon remisi dari jumlah darah dengan obat myelosuppressive dan
munculnya sel blast perifer (≥ 15%), promyelocytes (≥ 30%), basofil (≥ 20%), dan jumlah
trombosit kurang dari 100.000 sel / uL tidak berhubungan dengan terapi. Untuk mencapai remisi
hematologis diperlukan obat mielosupresif. Begitu tercapai remisi hematologis dilanjutkan
dengan terapi interferon dan cangkok sumsum tulang.
Terapi myelosuppressive dulunya adalah andalan pengobatan untuk mengkonversi
pasien dengan CML dari presentasi awal yang tidak terkendali untuk satu dengan remisi

hematologi dan normalisasi dari pemeriksaan fisik dan penemuan laboratorium. Namun, agen
baru terbukti lebih efektif, dengan efek samping yang lebih sedikit dan kelangsungan hidup lebih
lama.
HUHU (Hydrea), penghambat sintesis deoksinukleotida, adalah agen
myelosuppressive paling umum digunakan untuk mencapai remisi hematologi. Hitungan
darah awal sel dimonitor setiap 2-4 minggu, dan dosis disesuaikan tergantung pada
jumlah WBC dan platelet. Kebanyakan pasien mencapai remisi hematologi dalam waktu
1-2 bulan. Obat ini hanya menyebabkan durasi singkat myelosupresi, dengan demikian,
bahkan jika jumlah sel lebih rendah daripada yang dimaksudkan, menghentikan
pengobatan atau mengurangi dosis biasanya mengontrol jumlah darah. Dosis terapi
pemeliharaan dengan HU jarang menghasilkan remisi sitogenetik.
BusulfanBusulfan (Myleran) merupakan agen alkylating yang secara tradisional telah
digunakan untuk menjaga jumlah WBC di bawah 15.000 sel / uL. Namun, efek
myelosuppressive dapat terjadi jauh di kemudian hari dan bertahan lama, yang
membuat mempertahankan angka dalam batas normal lebih sulit. Penggunaan jangka
panjang dapat menyebabkan fibrosis paru, hiperpigmentasi, dan penekanan sumsum
berkepanjangan yang berlangsung berbulan-bulan.
Imatinib mesylate (Gleevec)Mesylate imatinib (Gleevec) adalah inhibitor tirosin kinase yang menghambat
tirosin kinase bcr-abl yang dihasilkan oleh Philadelphia (Ph1) kromosom. Imatinib
menghambat proliferasi dan menginduksi apoptosis pada sel positif BCR / ABL. Dengan
imatinib pada 400 mg / hari secara oral pada pasien dengan yang baru didiagnosis Ph1-
positif CML dalam tahap kronis, tingkat respon sitogenetika lengkap adalah 70% dan
tingkat kelangsungan hidup 3-tahun diperkirakan adalah 94%. Dengan dosis tinggi 800
mg / hari, tingkat sitogenetika lengkap respon meningkat menjadi 98%, tingkat respons
utama molekul adalah 70%, dan tingkat respon lengkap molekuler adalah 40-50%.

Gambar 2.9 Mekanisme Kerja Gleevec
Mekanisme molekuler untuk resistensi imatinib primer tidak diketahui. Mutasi
kinase-domain BCR / ABL merupakan mekanisme yang paling umum dari resistensi
sekunder atau diperoleh untuk imatinib, terhitung 50-90% kasus, 40 mutasi yang
berbeda saat ini telah dijelaskan. Karena imatinib mengikat ke domain kinase ABL di
konformasi tertutup atau tidak aktif untuk menginduksi perubahan konformasi, resistensi
terjadi ketika mutasi mencegah domain kinase dari mengadopsi konformasi spesifik
terhadap ikatan.
LeukapheresisLeukapheresis menggunakan pemisah sel dapat menurunkan jumlah WBC
dengan cepat dan aman pada pasien dengan jumlah WBC lebih dari 300.000 sel / uL,
dan dapat mengurangi gejala akut leukostasis, hiperviskositas, dan infiltrasi jaringan.
Leukapheresis biasanya mengurangi jumlah WBC hanya sementara. Dengan demikian,
sering dikombinasikan dengan kemoterapi Cytoreductive untuk efek lebih lama.
Interferon alfaDi masa lalu, interferon alfa adalah terapi pilihan untuk sebagian besar pasien
dengan CML yang terlalu tua untuk transplantasi sumsum tulang (BMT) atau yang tidak
memiliki sumsum tulang donor yang cocok. Dengan munculnya inhibitor tirosin kinase,

interferon alfa tidak lagi dianggap terapi lini pertama untuk CML. Ini dapat digunakan
dalam kombinasi dengan obat-obat baru untuk pengobatan kasus-kasus refrakter.
Sebuah studi oleh Simonsson et al menemukan bahwa penambahan periode yang
relatif singkat bahkan alfa2b pegylated interferon untuk imatinib meningkatkan tingkat
respon utama molekul pada 12 bulan terapi. Dosis yang lebih rendah dari alfa2b
pegylated interferon dapat meningkatkan toleransi sementara tetap mempertahankan
efikasi dan dapat dipertimbangkan dalam penelitian selanjutnya.
TransplantasiSumsum tulang alogenik transplantasi (BMT) atau transplantasi sel induk saat ini
satu-satunya obat yang telah terbukti untuk CML. Idealnya, harus dilakukan dalam tahap
kronis dari penyakit daripada pada fase transformasi atau krisis blast. Calon pasien
harus ditawarkan prosedur ini jika mereka memiliki donor terkait cocok atau single-
antigen-cocok tersedia. Secara umum, pasien yang lebih muda umum lebih baik
daripada pasien yang lebih tua. BMT harus dipertimbangkan dini pada pasien muda
(<55 y) yang memiliki donor saudara kandung yang cocok. Semua saudara harus
bertipe untuk antigen leukosit manusia (HLA)-A, HLA-B, dan HLA-DR. Jika tidak cocok,
jenis HLA dapat dimasukkan ke dalam register sumsum tulang untuk donor yang tidak
sepenuhnya cocok.
BMT alogenik dengan donor yang cocok tidak berhubungan telah menghasilkan
hasil yang sangat menggembirakan dalam penyakit ini. Prosedur ini memiliki tingkat
yang lebih tinggi dari kegagalan graft awal dan akhir (16%), penyakit host graft akut
kelas III-IV (50%), dan extensive chronic graft versus host disease (55%). Tingkat
kelangsungan hidup secara keseluruhan berkisar dari 31% menjadi 43% untuk pasien
yang lebih muda dari 30 tahun dan dari 14% menjadi 27% untuk pasien yang lebih tua.
Manfaat dan risiko harus dinilai dengan hati-hati dengan setiap pasien.
Angka kematian yang terkait dengan BMT adalah 10-20% atau kurang dengan saudara
cocok dan 30-40% dengan donor yang tidak berhub ungan. Registri sumsum tulang
mendekati angka kesembuhan untuk pasien dengan CML pada 50%. Transplantasi
telah ditujunkan ke pasien yang tidak mencapai remisi molekular atau menunjukkan
resistensi terhadap imatinib dan kegagalan generasi kedua bcr-abl inhibitor kinase
seperti dasatinib. Paparan sebelumnya untuk imatinib sebelum transplantasi tidak
mempengaruhi hasil posttransplant seperti kelangsungan hidup secara keseluruhan dan
kelangsungan hidup bebas perkembangan.

Sebuah analisis retrospektif yang mencakup 70 pasien dengan CML (44% pada
fase akselerasi atau krisis blast) yang telah menerima imatinib sebelum transplantasi sel
induk menunjukkan engraftment 90% dan diperkirakan transplantasi terkait kematian
44% dan mortalitas kambuh diperkirakan 24% pada 24 bulan . Graft versus host tingkat
penyakit adalah 42% untuk% akut dan 17 untuk kronis. [35] Sebagian besar data
berasal dari transplantasi alogenik dari donor yang cocok HLA-saudara dan
transplantasi syngeneic beberapa dari saudara kembar identik. Data menunjukkan
bahwa transplantasi alogenik memiliki hasil lebih baik dibandingkan transplantasi
syngeneic karena beberapa efek graft versus leukemia.
BMT adalah autologous yang diteliti, tetapi, relatif baru-baru ini, kemoterapi kombinasi
atau interferon telah ditemukan untuk menginduksi remisi sitogenetik dan
memungkinkan pemanenan Ph-negatif CD34 sel induk hematopoietik dari darah perifer
pasien.
Munculnya terapi imatinib telah dibayangi transplantasi sel induk alogenik
hematopoietik di CML baru didiagnosa. Namun, telah menyarankan bahwa pasien
dengan skor Sokal miskin berisiko (lihat Prognosis), tetapi risiko yang baik untuk
transplantasi sel induk alogenik hematopoietik ditransplantasikan awal atau dimuka.
Tidak ada konsensus saat ini ada pada masalah ini. Namun, konsensus secara luas
diterima adalah bahwa pasien yang kemajuan luar fase kronis pada imatinib harus
ditawarkan transplantasi sel induk hematopoietik jika ini adalah pilihan.
Dengan pasien dalam krisis ledakan yang belum terpapar imatinib, obat ini
digunakan dalam kombinasi dengan rejimen induksi sama dengan yang digunakan di
myelogenous akut atau leukemia limfoblastik. Namun, karena persentase yang tinggi
dari imatinib-tahan mutasi ada pada pasien, kambuh lebih sering terjadi dan pada waktu
sebelumnya dari induksi. Dengan demikian, semua upaya yang dilakukan untuk
melakukan transplantasi sel induk alogenik hematopoietik sesegera mungkin.
Kebanyakan pasien dengan penyakit sisa minimal (MRD) setelah transplantasi
membutuhkan terapi pemeliharaan interferon. Atau, mereka mungkin memerlukan
reinfusion sel T yang dikumpulkan dari donor.
SplenektomiSplenektomi dan radiasi limpa telah digunakan pada pasien dengan
splenomegali, biasanya dalam tahap akhir dari CML. Ini jarang diperlukan pada pasien
dengan CML yang terjaga. Beberapa penulis percaya bahwa splenektomi mempercepat

terjadinya metaplasia myeloid di hati. Selain itu, splenektomi berhubungan dengan
morbiditas perioperatif tinggi dan tingkat kematian karena perdarahan atau komplikasi
trombotik.
2.7 Pemantauan Jangka PanjangRespon sitogenetika dipantau setiap 3-6 bulan dengan karyotyping atau dengan
hibridisasi in situ fluoresensi (IKAN) untuk menghitung persentase sel sumsum tulang dengan
PH1-positif. Pemantauan jangka panjang menggunakan darah perifer untuk IKAN dan
kuantitatif reverse transcriptase PCR (RT-PCR) untuk BCR / ABL RNA tampaknya metode yang
handal untuk memantau respon terhadap terapi inhibitor tirosin kinase di semua fase CML [36].
Tujuannya adalah sel normal 100% setelah 1-2 tahun terapi. Pasien dengan MRD
(BCR / ABL positif) harus mengikuti terapi pemeliharaan selama mereka terus mengalami MRD.
Perbaikan sitogenetika telah diamati pada 70% pasien yang diobati selama lebih dari 3 bulan,
dengan rata-rata sel PH1-positif menurun dari 100% menjadi 65% (kisaran 0-95%). Penurunan
lengkap dari kromosom PH1 diamati pada 20% pasien.
Lebih dari 80% pasien yang baru didiagnosis dengan CML dalam tahap kronis akan
mencapai respon sitogenetika lengkap dengan dosis standar 400 mg / hari imatinib. Probabilitas
kelangsungan hidup sangat berkorelasi dengan tingkat respon, mendekati 100% pada pasien
yang mencapai remisi molekular (pengurangan BCR / ABL mRNA oleh paling sedikit 3-log pada
12 bulan).
Pada pasien dengan CML fase kronis yang telah gagal terapi interferon, respon
sitogenetika lengkap adalah 41% pada 18 bulan dan 52% pada 40 bulan, dengan kelangsungan
hidup 2 tahun adalah 76%. Pengembangan menjadi fase akselerasi atau krisis blast memiliki
puncaknya pada 2 tahun sebesar 7,6%, namun kejadian tetap konstan selama bertahun-tahun
dengan rata-rata 2%.
Tonggak terapi standar yang ingin dicapai adalah sebagai berikut:
1. Pada 3 bulan: respon hematologi lengkap (normal hitung darah lengkap dan tidak ada
bukti penyakit extramedullary)
2. Pada 6 bulan: kecil sitogenetika respon (36% sampai 65% sel PH1 +)
3. Pada 12 bulan: utama sitogenetika respon (0% sampai 35% PH1 +)
4. Pada usia 18 bulan: lengkap sitogenetika respon (0% PH1 +)
Kebanyakan pasien dengan respon sitogenetika lengkap terus memiliki temuan RT-PCR
positif, menunjukkan kehadiran MRD. Penghentian obat pada pasien ini biasanya diikuti oleh

kambuh, menunjukkan bahwa imatinib gagal untuk membasmi sel-sel induk leukemia pada
pasien ini.
Awal intensifikasi dengan penggunaan dosis tinggi dari imatinib (800 mg / hari) atau
imatinib dalam kombinasi dengan sitarabin atau interferon alfa dapat menyebabkan tingginya
tingkat RT-PCR negatif, tapi ini perlu dikonfirmasi dalam studi lebih lanjut.
Kriteria respon molekul utama adalah ≥ 3-log pengurangan BCR / ABL mRNA, dan untuk
respon molekul lengkap itu adalah negatif dengan RT-PCR. Karena hubungan yang baik
terbentuk antara BCR / ABL mRNA dalam sumsum tulang dan darah tepi, ini dapat dipantau
dari sampel darah perifer.
Pasien harus diskrining untuk mutasi dari domain kinase BCR / ABL apabila terdapat
indikasi hilangnya respon terhadap imatinib di tingkat manapun. Resistensi hematologi Utama
untuk imatinib terjadi pada sekitar 5% pasien yang gagal mencapai remisi histologis lengkap,
dan menunjukkan resistensi sitogenetika 15% primer dalam fase kronis. Resistensi sekunder
atau didapat (hilangnya respon sebelumnya) adalah 16% pada 42 bulan dan meningkat menjadi
26% pada mereka yang sebelumnya diobati dengan interferon, dan 73-95% pada fase
akselerasi atau fase blast.
2.8 PrognosaSecara historis, kelangsungan hidup rata-rata pasien dengan CML adalah 3-5 tahun dari
saat diagnosis. Saat ini, pasien dengan CML memiliki hidup rata-rata 5 tahun atau lebih dan 5
tahun tingkat kelangsungan hidup 50-60%. Peningkatan tersebut telah dihasilkan dari diagnosis
dini, terapi ditingkatkan dengan interferon dan transplantasi sumsum tulang, dan perawatan
suportif yang lebih baik.
Sebagai pengobatan ditingkatkan, kebutuhan untuk tahap pasien menurut prognosis
mereka menjadi perlu untuk membenarkan prosedur dengan morbiditas dan mortalitas yang
tinggi, seperti transplantasi sumsum tulang. Pementasan pasien didasarkan pada beberapa
analisis menggunakan analisis variate beberapa antara asosiasi dari host pretreatment dan
karakteristik sel leukemia dan tingkat kelangsungan hidup yang sesuai. Temuan dari studi ini
mengklasifikasikan pasien ke dalam kelompok berikut:
• Low-risk (kelangsungan hidup rata-rata 5-6 tahun)
• Moderate-risk (kelangsungan hidup rata-rata 3-4 tahun)
• High-risk (kelangsungan hidup rata-rata 2 tahun)

Satu banyak digunakan indeks prognostik, skor Sokal, dihitung untuk pasien berusia 5-
84 tahun dengan persamaan berikut:
Tiga kategori dari skor Sokal adalah sebagai berikut:
1. Risiko rendah: skor <0,8
2. Menengah risiko: skor 0,8-1,2
3. Resiko tinggi: skor> 1,2
Skor Sokal berkorelasi dengan kemungkinan mencapai respon sitogenetika lengkap,
sebagai berikut:
• low-risk: 91%
• Intermediate-risk: 84%
• high-risk: 69%
Sebuah model prognostik gabungan, menggabungkan model-model sebelumnya seperti
nilai Sokal, telah dirancang menggunakan jumlah orang miskin-prognosis karakteristik. Tahapan
dalam model ini adalah sebagai berikut:
• Tahap 1: 0 atau 1 karakteristik
• Tahap 2: 2 karakteristik
• Tahap 3: 3 atau lebih karakteristik
• Tahap 4: diagnosis pada fase ledakan
Prognosis buruk terkait dengan karakteristik termasuk faktor-faktor klinis dan
laboratorium berikut:
• Usia yang lebih tua
• Simptomatis
• Performance status buruk
• Afrika Amerika keturunan
• Hepatomegali
• Splenomegali
• Kromosom Ph Negatif atau BCR / ABL
• Anemia
Hazard ratio = exp 0.0116 (age - 43) + 0 .0345 (spleen size [cm below costal margin] - 7.5
cm) + 0.188 [(platelet count/700)2 - 0.563] + 0.0887 (% blasts in blood - 2.1)

• Trombositopenia
• Trombositosis
• Penurunan megakaryocytes
• Basophilia
• Myelofibrosis (reticulin ditambah atau kolagen)
Terapi terkait faktor berikut mungkin menunjukkan prognosis buruk pada pasien dengan
CML:
• Lama waktu untuk remisi hematologi dengan terapi myelosupresi
• Durasi remisi pendek
• Dosis total tinggi dari HU atau busulfan
• Supresi sel Ph-positif buruk dengan kemoterapi atau terapi interferon alfa
Sebuah penelitian di Jerman dari 139 pasien berisiko rendah dengan CML, menurut
skor Sokal, menunjukkan bahwa agen terapi baru telah membawa kemajuan dalam
kelangsungan hidup. Hidup rata-rata sesuai perlakuan yang digunakan adalah sebagai berikut:
• busulfan: 6 tahun (50 pasien)
• HU: 6,5 tahun (55 pasien)
• Interferon alfa: sekitar 9,5 tahun (34 pasien)
Beberapa pasien dengan remisi molekuler dari interferon alfa dapat disembuhkan, tapi
ini hanya dapat dibentuk dari waktu ke waktu. Para imatinib tirosin kinase inhibitor telah
menggantikan interferon sebagai terapi lini pertama, karena dikaitkan dengan tingkat respons
yang lebih tinggi dan toleransi yang lebih baik dari efek samping. Jangka panjang tindak lanjut
dari pasien yang menerima imatinib dalam pengobatan CML dan mencapai respon cytogenic
lengkap 2 tahun setelah awal pengobatan menunjukkan bahwa kelangsungan hidup mereka
secara statistik tidak signifikan berbeda dari masyarakat umum. [11]
Manifestasi dari blast krisis serupa dengan leukemia akut. Hasil pengobatan tidak
memuaskan, dan kebanyakan pasien menyerah pada penyakit sekali fase ini berkembang.
Fase akut, atau krisis blast, mirip dengan leukemia akut, dan kelangsungan hidup adalah 3-6
bulan pada tahap ini.

BAB 3PENUTUP
3.1 Kesimpulan1. CML adalah kelainan diperoleh yang melibatkan sel batang hematopoietik. Hal ini
ditandai oleh kelainan sitogenetika terdiri dari translokasi timbal balik antara lengan
panjang kromosom 22 dan 9 [t (9; 22)]
2. Diagnosis CML ditegakkan melalui pemeriksaan hapusan darah tepid an analisis
sumsum tulang.
3. Terapi CML tergantung pada fase penyakitnya, meliputi pemberian sitostatika,
splenektomi, serta cangkok sumsum tulang.
3.2 Saran1. Senantiasa update pengetahuan mengenai leukemia pada umumnya, dan leukemia
mielositik kronik pada khususnya karena dalam hal diagnosis maupun terapi dalam
bidang onkologi masih terus berkembang.
2. Perbaikan dalam hal penulisan maupun isi dari makalah sangat diharapkan oleh penulis
mengingat penulisan makalah ini masih jauh dari kata sempurna.
DAFTAR PUSTAKA

1. Sawyers CL. Chronic myeloid leukemia. N Engl J Med. Apr 29 1999;340(17):1330-40.
[Medline].
2. Druker BJ, Sawyers CL, Kantarjian H, et al. Activity of a specific inhibitor of the BCR-
ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute
lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med. Apr 5
2001;344(14):1038-42. [Medline]. [Full Text].
3. Kantarjian H, Sawyers C, Hochhaus A, et al, for the International STI571 CML Study
Group. Hematologic and cytogenetic responses to imatinib mesylate in chronic
myelogenous leukemia. N Engl J Med. Feb 28 2002;346(9):645-52. [Medline]. [Full
Text].
4. Merx K, Muller MC, Kreil S, et al. Early reduction of BCR-ABL mRNA transcript levels
predicts cytogenetic response in chronic phase CML patients treated with imatinib after
failure of interferon alpha. Leukemia. Sep 2002;16(9):1579-83. [Medline]. [Full Text].
5. Talpaz M, Silver RT, Druker BJ, et al. Imatinib induces durable hematologic and
cytogenetic responses in patients with accelerated phase chronic myeloid leukemia:
results of a phase 2 study. Blood. Mar 15 2002;99(6):1928-37. [Medline]. [Full Text].
6. Kantarjian HM, Cortes JE, O'Brien S, et al. Imatinib mesylate therapy in newly diagnosed
patients with Philadelphia chromosome-positive chronic myelogenous leukemia: high
incidence of early complete and major cytogenetic responses. Blood. Jan 1
2003;101(1):97-100. [Medline]. [Full Text].
7. Kantarjian HM, Talpaz M. Chronic myelogenous leukemia. Hematol Oncol Clin N Am.
Jun 2004;18(3):XV-XVI.
8. Shah NP, Tran C, Lee FY, et al. Overriding imatinib resistance with a novel ABL kinase
inhibitor. Science. Jul 16 2004;305(5682):399-401. [Medline].
9. Volpe G, Panuzzo C, Ulisciani S, Cilloni D. Imatinib resistance in CML. Cancer Lett. Feb
8 2009;274(1):1-9. [Medline].
10. Faderl S, Talpaz M, Estrov Z, O'Brien S, Kurzrock R, Kantarjian HM. The biology of
chronic myeloid leukemia. N Engl J Med. Jul 15 1999;341(3):164-72. [Medline].
11. Gambacorti-Passerini C, Antolini L, Mahon FX, Guilhot F, Deininger M al et. Multicenter
independent assessment of outcomes in chronic myeloid leukemia patients treated with
imatinib. J Natl Cancer Inst. Apr 6 2011;103(7):553-61. [Medline].

12. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the
BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. Apr 5
2001;344(14):1031-7. [Medline]. [Full Text].
13. Goldman JM, Druker BJ. Chronic myeloid leukemia: current treatment options. Blood.
Oct 1 2001;98(7):2039-42. [Medline]. [Full Text].
14. Santos FP, Alvarado Y, Kantarjian H, Verma D, O'Brien S, Mattiuzzi G, et al. Long-term
prognostic impact of the use of erythropoietic-stimulating agents in patients with chronic
myeloid leukemia in chronic phase treated with imatinib. Cancer. Mar 1
2011;117(5):982-91. [Medline].
15. Sawyers CL, Hochhaus A, Feldman E, et al. Imatinib induces hematologic and
cytogenetic responses in patients with chronic myelogenous leukemia in myeloid blast
crisis: results of a phase II study. Blood. May 15 2002;99(10):3530-9. [Medline].
16. Tang M, Gonen M, Quintas-Cardama A, et al. Dynamics of chronic myeloid leukemia
response to long-term targeted therapy reveal treatment effects on leukemic stem cells.
Blood. Aug 11 2011;118(6):1622-31. [Medline].
17. Ibrahim AR, Eliasson L, Apperley JF, Milojkovic D, Bua M, Szydlo R, et al. Poor
adherence is the main reason for loss of CCyR and imatinib failure for chronic myeloid
leukemia patients on long-term therapy. Blood. Apr 7 2011;117(14):3733-6. [Medline].
18. Hochhaus A, Kreil S, Corbin AS, La Rosée P, Müller MC, Lahaye T, et al. Molecular and
chromosomal mechanisms of resistance to imatinib (STI571) therapy. Leukemia. Nov
2002;16(11):2190-6. [Medline].
19. Marcolino MS, Boersma E, Clementino NC, et al. Imatinib treatment duration is related
to decreased estimated glomerular filtration rate in chronic myeloid leukemia patients.
Ann Oncol. Sep 2011;22(9):2073-9. [Medline].
20. FDA Approval for Dasatinib. National Cancer Institute. Available at
http://www.cancer.gov/cancertopics/druginfo/fda-dasatinib. Accessed August 24, 2011.
21. FDA Approval for Nilotinib. National Cancer Institute. Available at
http://www.cancer.gov/cancertopics/druginfo/fda-nilotinib. Accessed August 24, 2011.
22. [Best Evidence] Cortes JE, Jones D, O'Brien S, Jabbour E, Ravandi F, Koller C, et al.
Results of dasatinib therapy in patients with early chronic-phase chronic myeloid
leukemia. J Clin Oncol. Jan 20 2010;28(3):398-404. [Medline]. [Full Text].
23. Kantarjian H, Shah NP, Hochhaus A, Cortes J, Shah S, Ayala M, et al. Dasatinib versus
imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. Jun
17 2010;362(24):2260-70. [Medline].

24. Saglio G, Kim DW, Issaragrisil S, le Coutre P, Etienne G, Lobo C, et al. Nilotinib versus
imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. Jun 17
2010;362(24):2251-9. [Medline].
25. Kantarjian HM, Hochhaus A, Saglio G, et al. Nilotinib versus imatinib for the treatment of
patients with newly diagnosed chronic phase, Philadelphia chromosome-positive,
chronic myeloid leukaemia: 24-month minimum follow-up of the phase 3 randomised
ENESTnd trial. Lancet Oncol. Sep 2011;12(9):841-51. [Medline].
26. Jabbour E, Kantarjian H, O'Brien S, et al. The achievement of an early complete
cytogenetic response is a major determinant for outcome in patients with early chronic
phase chronic myeloid leukemia treated with tyrosine kinase inhibitors. Blood. Oct 27
2011;118(17):4541-6; quiz 4759. [Medline].
27. Hughes TP, Hochhaus A, Branford S, Müller MC, Kaeda JS, Foroni L, et al. Long-term
prognostic significance of early molecular response to imatinib in newly diagnosed
chronic myeloid leukemia: an analysis from the International Randomized Study of
Interferon and STI571 (IRIS). Blood. Nov 11 2010;116(19):3758-65. [Medline].
28. FDA. Sprycel (dasatinib): Drug Safety Communication – Risk of Pulmonary Arterial
Hypertension. US Food and Drug Administration. Available at
http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsforHumanMedicalPr
oducts/ucm275176.htm. Accessed October 11, 2011.
29. Sawyers CL. Even better kinase inhibitors for chronic myeloid leukemia. N Engl J Med.
Jun 17 2010;362(24):2314-5. [Medline].
30. Jabbour E, Kantarjian H, O'Brien S, Shan J, Garcia-Manero G, Wierda W, et al.
Predictive factors for outcome and response in patients treated with second generation
tyrosine kinase inhibitors for chronic myeloid leukemia in chronic phase post imatinib
failure. Blood. Oct 28 2010;[Medline].
31. Verma D, Kantarjian H, Strom SS, et al. Malignancies occurring during therapy with
tyrosine kinase inhibitors (TKIs) for chronic myeloid leukemia (CML) and other
hematologic malignancies. Blood. Oct 20 2011;118(16):4353-8. [Medline].
32. Simonsson B, Gedde-Dahl T, Markevarn B, et al. Combination of pegylated IFN-a2b with
imatinib increases molecular response rates in patients with low- or intermediate-risk
chronic myeloid leukemia. Blood. Sep 22 2011;118(12):3228-35. [Medline].
33. Moreb J, Johnson T, Kubilis P, Myers L, Oblon D, Miller A, et al. Improved survival of
patients with chronic myelogenous leukemia undergoing allogeneic bone marrow
transplantation. Am J Hematol. Dec 1995;50(4):304-6. [Medline].

34. McGlave PB, Beatty P, Ash R, Hows JM. Therapy for chronic myelogenous leukemia
with unrelated donor bone marrow transplantation: results in 102 cases. Blood. Apr 15
1990;75(8):1728-32. [Medline].
35. Deininger M, Schleuning M, Greinix H, Sayer HG, Fischer T, Martinez J, et al. The effect
of prior exposure to imatinib on transplant-related mortality. Haematologica. Apr
2006;91(4):452-9. [Medline].
36. Lima L, Bernal-Mizrachi L, Saxe D, Mann KP, Tighiouart M, Arellano M, et al. Peripheral
blood monitoring of chronic myeloid leukemia during treatment with imatinib, second-line
agents, and beyond. Cancer. Mar 15 2011;117(6):1245-52. [Medline].