Analisis Kualitas Sperma Ikan
-
Upload
laila-andini -
Category
Documents
-
view
462 -
download
19
Transcript of Analisis Kualitas Sperma Ikan

ANALISIS KUALITAS SPERMA IKAN
Oleh :
Nama : Laila AndiniNIM : B1J012053Rombongan : IIIKelompok : 1Asisten : Sumartika Yimastria
LAPORAN PRAKTIKUM STRUKTUR DAN PERKEMBANGAN HEWAN II
KEMENTERIAN PENDIDIKAN DAN KEBUDAYAANUNIVERSITAS JENDERAL SOEDIRMAN
FAKULTAS BIOLOGIPURWOKERTO
2013

I. PENDAHULUAN
A. Latar Belakang
Spermatozoa merupakan sel gamet jantan yang sangat terdeferensiasi.
Fungsinya adalah untuk mengantarkan material genetis jantan ke betina dan
mengaktifkan program perkembangan telur. Analisis sperma dilakukan untuk
mengetahui proses pada pembuahan, waktu pada setiap tahapan dan mengetahui serta
menentukan rasio spermatozoa dan ovum dalam pembuahan. Analisis sperma yang
dimaksud meliputi pemeriksaan jumlah milt yang dapat distriping dari seekor ikan
jantan masak kelamin, kekentalan sperma, warna, bau, jumlah spermatozoa hidup,
jumlah spermatozoa mati, motilitas, morfologi (ukuran dan bentuk kepala, ukuran
ekor, berbagai penyimpangan) (Yatim,1982).
Analisis sperma tidak hanya dapat dilakukan pada ikan, tetapi juga dapat
dilakukan pada tikus. Caranya hampir sama dengan analisis sperma pada ikan.
Pertama – tama, tikus dibius dengan uretan 25% dengan dosis 0,6 ml/100. Epididimis
kauda kemudian dibelah. Insisi (sekitar 1 mm) dibuat dalam epididimis kauda dan
tetes cairan sperma diteteskan ke slide mikroskop dan dua tetes normal saline
ditambahkan untuk memobilisasi sperma sel. Motilitas sperma kemudian dinilai
dengan menghitung spermatozoa motil per satuan luas dan dinyatakan dalam
presentase. Jumlah sperma dilakukan dengan homogenisasi epididimis dalam 5 ml
normal saline. Penghitungan kemudian dilakukan dengan menggunakan ruang
menghitung dalam haemocytometer (Salman, 2007).
Ikan Nilem ( Osteochilus hasselti ) dipilih sebagai bahan praktikum mengenai
analisis sperma karena ukurannya yang relatif lebih kecil dibandingkan dengan ikan

tawes dan ikan mas sehingga dapat dirawat dan dipelihara dalam aquarium. Selain itu
ikan nilem juga mudah diamati, mudah didapatkan dan harganya tidak terlalu mahal.
B. Tujuan
Tujuan dari praktikum kali ini adalah membekali mahasiswa dengan
kemampuan untuk melakukan analisis sperma dan menentukan kualitas spermatozoa
hewan uji.

II. MATERI DAN METODE
A. Materi
Alat-alat yang digunakan dalam praktikum analisis kualitas sperma ikan
adalah object glass + cover glass, cavity slide, pipet tetes, mikroskop, kertas tissue,
tusuk gigi, haemocytometer, makrometer, spilt 1mL, beaker glass 50 mL, kertas pH
indikator, well plate, pengukur waktu.
Bahan-bahan yang digunakan dalam praktikum analisis kualitas sperma ikan
adalah milt ikan nilem, larutan NaCl fisiologi atau larutan Ringer, pewarna giemsa
atau eosin dan akuades.
B. Metode
Metode yang digunakan dalam praktikum kali ini adalah:
1. Cara stripping
a. Ikan nilem dipegang dengan bagian ventral ada di bawah dan bagian dorsal
menghadap ke atas
b. Tangan kanan menutupi kepala, sedangkan tangan kiri menyangga ekor.
c. Bagian urogenital dilap dengan tisu.
d. Abdomen ikan nilem diurut dari anterior ke arah posterior menuju lubang
urogenital hingga pada lubang tersebut keluar cairan berwarna putih susu
(milt).
e. Milt yang keluar langsung disedot dengan menggunakan spuit injeksi tanpa
jarum.

2. Volume
Milt ikan nilem yang tertampung pada spuit injeksi diukur volumenya dengan
langsung membaca skalanya.
3. Warna
Diamati secara visual dengan latar belakang berwarna putih.
4. Bau
Dibaui dengan cara dikipas-kipas dengan tangan.
5. pH
Derajat keasaman (pH) diukur dengan menggunakan kertas pH, dengan cara
mencelupkan kertas pH dalam sampel sperma, diamkan beberapa saat, kemudian
dicocokan warna yang terjadi dengan pH indikator.
6. Cara pengenceran milt.
a. Sampel sperma diambil 0.1 ml dimasukkan ke dalam cawan.
b. Larutan NaCl fisiologis sebanyak 0,9 ml dicampurkan ke dalam cawan
(perbandingan antara sampel dengan larutan pengencer harus selalu 1:9).
c. Diaduk - aduk dengan menggunakan batang pengaduk sampai benar-benar
homogen.
d. Sperma yang sudah diencerkan ini meupakan sperma dengan pengenceran
10x.
e. Sperma pengenceran 10x diambil dengan menggunakan spuit yang lain
sebanyak 1 ml dimasukkan ke dalam cawan yang berbeda.
f. Larutan Nacl fisiologis 9 ml dicampurkan ke dalam sperma tersebut.
g. Sperma dengan pengenceran dua kali ini, merupakan sperma dengan
pengenceran 100x.

h. Pengenceran dilakukan lagi untuk mendapatkan sperma dengan pengenceran
1000x dan 10000x.
7. Motilitas sperma
a. Milt yang sudah diencerkan 1000x diambil dengan menggunakan pepet
tetes.
b. Milt diteteskan di atas objek glass.
c. Ditetesi dengan aquades, kemudian dihomogenkan.
d. Ditutup dengan cover glass dan diamati dengan menggunakan
mikoroskop.
e. Bergerak atau tidak bergerak, ditentukan persentase motilitasnya.
8. Menghitung jumlah total spermatozoa
a. Milt yang sudah diencerkan 1000x diambil dengan menggunakan pipet
tetes.
b. Diteteskan di bilik hitung Haemocytometer yang sudah ditutup dengan
cover glass melalui sela-sela paritnya.
c. Hitung jumlah sperma menggunakan lima kotak besar yang ada di bagian
tengah.
d. Jumlah total spermatozoa dihitung dengan rumus:
∑ total spermatozoa = (Rata-rata 5 kotak sedang x pengenceran x 2,5.105)
9. Morfologi sperma
a. Sediaan preparat apus spermatozoa dibuat dengan cara meneteskan
sperma (pengenceran 100x) pada objek glass di salah satu ujungnya.
Tetesan sperma ditentukan dengan menggunakan ujung objek glass yang
lain, yang diberdirikan dengan sudut 30o. Tetesan sperma diratakan
dengan menyorongkan gelas objek lain menjauhi titik tetesan tersebut.

b. Apusan spermatozoa dibiarkan kering udara selama 5 menit.
c. Ditetesi dengan pewarna larutan Eosin (pengenceran 20x), selama 30
menit.
d. Dibiarkan kering udara.
e. Diamati dengan menggunakan mikroskop, spermatozoa dicari.

III. HASIL DAN PEMBAHASAN
A. Hasil
1. Volume milt : 0,4 ml
2. pH : 8,5
3. Warna milt : putih susu
4. Bau milt : amis
5. Konsentrasi spermatozoa/mL : 5,45 x 1010 sel/mL
6. Viabilitas : 3 menit 7 detik
7. Motilitas : 50%
8. Jumlah total spermatozoa
∑ Total
Spermatozoa
K1 K2 K3 K4 K5 K6 Rata
Rata
5,45 x
1010
6,3 x
1010
1,85 x
1010
1,45 x
1010
1,65 x
1010
2,9 x
1010
3,92 x
1010
Perhitungan ;
Diketahui:
Kotak 1 = 24 Kotak 4 = 26
Kotak 2 = 14 Kotak 5 = 22
Kotak 3 = 23
Jawab :
∑ Total Sperma = rata - rata 5 kotak x 2,5.105 x faktor pengenceran (sel/ml)
= 21,8 x 2,5.105 x 10000
= 5,45 x 1010 sel/ml

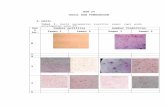
9. Morfologi spermatozoa
2 1
Gambar Mikroskopis Sperma Ikan Nilem (Ostoechilus haselti)
Perbesaran 40 x 10
Keterangan :
1. Kepala
2. Ekor

B. Pembahasan
Berdasarkan pengamatan yang telah dilakukan, didapatkan volume milt ikan
nilem sebesar 0,4 ml hal ini tidak sama dengan pustaka, menyatakan bahwa sperma
yang normal (normospermia) volumenya antara 1 s.d. 6 ml. Sehingga sperma yang
dihasilkan ikan nilem tergolong hypospermia karena volumenya kurang dari 1 ml.
Konsentrasi sperma sangat dipengaruhi oleh asupan nutrisi dan frekuensi
pengambilan sperma. menyatakan bahwa protein yang tinggi dalam pakan dapat
meningkatkan volume, konsentrasi dan jumlah spermatozoa yang hidup. Konsentrasi
sperma yang rendah disebabkan kebutuhan nutrisi dalam sel sperma belum
mencukupi karena nutrisi yang tersedia lebih banyak dipakai untuk kebutuhan
pertumbuhan dan perkembangan tubuh. Frekuensi pengambilan sperma
mempengaruhi konsentrasi sperma, karena spermatozoa memiliki waktu tertentu
untuk proses spermatogenesis sehingga jumlah spermatozoa berkurang jika frekuensi
pengambilan sperma terlalu dekat (Condro,2012).
Viabilitas didapatkan selama 3 menit 7 detik. Menurut pustaka, bahwa durasi
motilitas terjadi dalam periode yang sangat pendek pada ikan air tawar, Pergerakan
aktif spermatozoa ikan sekitar 1-2 menit dan tak ada lagi pergerakan setelah 5 menit.
Semakin kental sperma tersebut semakin besar vikositasnya. Hal ini mungkin
disebabkan karena sperma terlalu banyak, cairannya sedikit, gangguan liquedaction,
perubahan komposisi plasma sperma, dan pengaruh obat-obatan (Condro,2012).
Bau sperma hasil striping kelmpok kami adalah amis. Menurut Yatim (1982), bau
sperma yang normal adalah khas, tajam, tidak busuk. Bau itu berasal dari oksidasi
spermin yang dihasilkan prostat. Bau yang tidak khas mani, prostate tidak aktif atau
ada gangguan. Gangguan itu pada saluran atau kelenjar sendiri. Bau busuk oleh
adanya infeksi (Yatim, 1982).

Warna sperma hasil striping kelompok kami adalah putih susu, hal ini
menunjukkan bahwa sperma ikan nilem yang digunakan pada praktikum adalah
sehat. Umumnya semen berwarna krem keputih-putihan atau hampir seputih susu.
Derajatnya keputihnya atau kekeruhannya sebagian besar tergantung pada
konsentrasi spermanya. Semakin keruh biasanya jumlah sperma per ml semen itu
semakin banyak. Semen yang berwarna hijau kekuning-kuningan biasanya banyak
mengandung kuman Pseudomonas auroginosa yang menandakan adanya peradangan
yang kronis dalam saluran reproduksinya. Semen yang berwarna merah atau
kemerah-merahan menandakan bahwa semen itu mengandung sedikit atau banyak
darah (Partodiharjo, 1990).
Berdasarkan dengan hasil praktikum yang telah dilakukan nilai pH 8,5.
Berdasarkan pustaka, bau dan warna sudah sesuai. Namun ada perbedaan pada pH.
Sperma yang normal mempunyai pH antara 7,2-7,8. pH lebih dari 8 menunjukkan
adanya radang akut kelenjar kelamin atau epididymis. pH kurang dari 7,2
menunjukkan adanya penyakit kronis pada kelenjar atau epididymis. pH rendah
sekali menunjukkan adanya gangguan atau aplasia pada vesicular seminalis atau
ductus ejaculatorius. pH dapat berubah satu jam sesudah ejakulasi (Meirnawati,
2011).
Motilitas yang diamati yaitu 50% untuk sperma yang motil dan 50% untuk
sperma yang tidak motil. Menurut pustaka, sperma segar yang akan digunakan untuk
pembekuan harus memiliki motilitas minimal 70%. Penggunaan hemositometer
untuk menentukan jumlah spermatozoa dalam semen menurut pendapat terbaru
dianggap kurang praktis, karena kecuali memerlukan sedikit keahlian dalam
menghitung juga memerlukan waktu dalam menghitung dengan mikroskop. Sperma
yang diteteskan di atas kotak hemositometer ditutup dan dihitung, hasilnya dicatat

misalnya y. Y ini adalah jumlah sel-sel spermatozoa yang mati dan yang terlihat
tidak bergerak dalam kotak-kotak. Spermatozoa yang tidak bergerak belum tentu
mati Hal ini disebabkan selama melakukan pengenceran waktu yang diperlukan
terlalu lama dan milt ikan juga sudah terjadi kontak dengan cahaya, yang
mengakibatkan spermatozoa dalam milt ikan mati (Meirnawati, 2011).
Konsentrasi spermatozoa berdasarkan perhitungan menggunakan haemocytometer
sebesar 5,45 x 1010 sel/ml. Sehingga menurut Yatim (1982), konsentrasi spermatozoa
tersebut termasuk dalam golongan polyzoospermia karena jumlah spermanya lebih
dari 250 juta/ml. Jumlah spermatozoa normal (normozoospermia) berada pada
rentang antara 40 sampai 200 juta/ml. Menurut Maria et al. (2006), proses
lingkungan yang dingin dan bahan-bahan kimia juga mempengaruhi motilitas
spermatozoa. Sperma pada ikan kemungkinan tidak hidup pada plasma. Sperma
dilepaskan pada lingkungan akuatik, osmosis menurun (pada spesies air tawar) dan
motilitas sperma dimulai.
Kualitas milt merupakan sebuah ukuran kemampuan sperma berhasil
membuahi sel telur, yang kemampuan tersebut sebagian besar bergantung pada
parameter qualitatif dari milt seperti komposisi cairan semen, volume milt, kepadatan
sperma, dan motilitas sperma (Rurangwa et al., 2004). Cairan semen ikan memiliki
komposisi yang unik mengenai keberadaan komponen organik dan inorganik yang
mendukung viabilitas spermatozoa (Hajirezaee et al., 2010). Motilitas dan kepadatan
sperma menentukan kemampuan fertilisasi spermatozoa dan sering digunakan untuk
menilai kualitas milt (Suquet et al., 1982; Billard, et al., 1993; Linhart et al., 1994a;
Krol et al., 2006). Dalam peternakan ikan, berbagai faktor mempengaruhi parameter
milt yang bergantung pada interaksi kompleks diantara faktor genetik, faktor
fisiologi, dan faktor lingkungan.

Faktor – faktor ini mungkin mempengaruhi baik pada level berbeda proses
produksi maupun selama pengumpulan dan penyimpanan sperma in vitro
sebelumnya untuk fertilisasi dan aktivasi setelah bertelur. Faktor – faktor ini telah
dibagi menjadi efek karakteristik biologi penetas (umur, berat dan panjang tubuh),
kondisi pemeliharaan dari penetas (suhu, fotoperiode, makanan, komponen yang
tidak diinginkan, kesejahteraan hewan, dan kesehatan), induksi pemijahan buatan,
waktu pemijahan (waktu pengumpulan dan semen diulang), dan faktor – faktor kimia
(Hajirezaee et., al, 2010). Tidak ada hubungan ilmiah antara bentuk sperma dan yang
kromosom konten. Setelah sperma menembus telur, pembuahan memiliki peluang
bagus untuk mengambil tempat. Namun, mungkin ada beberapa keturunan laki-laki
yang akan mewarisi jenis yang sama kelainan morfologi. Apakah rutin penyelidikan
kelainan Y-kromosom pada manusia harus dimulai ketika morfologi rendah dicatat
adalah kontroversial.
Dalam praktikum ini digunakan beberapa larutan, seperti larutan Ringer,
pewarna Giemsa, dan methanol. Pengenceran dengan larutan Ringer dapat
memperpanjang viabilitas spermatozoa di dalam milt menjadi sekitar 9-10 menit.
Bila tidak hanya 5 menit saja. Dengan pewarna Giemsa, dapat dilihat menggunakan
mikroskop bahwa spermatozoa normal berbentuk oval atau bulat dengan bagian
ujung lebih terang dan bagian pangkal dekat leher lebih gelap (Soeminto, 2002).
Penggunaan haemositometer untuk menentukan jumlah spermatozoa dalam
semen menurut pendapat terbaru dianggap kurang praktis, karena kecuali
memerlukan sedikit keahlian dalam menghisab juga memerlukan waktu dalam
menghitung dengan mikroskop. Sperma yang diteteskan di atas kotak
haemositometer ditutup dan dihitung, hasilnya dicatat misalnya y. Y ini adalah

jumlah sel-sel spermatozoa yang mati dan yang terlihat tidak bergerak dalam kotak-
kotak. Spermatozoa yang tidak bergerak belum tentu mati (Partodiharjo, 1990).
Daya fertilisasi sangat ditentukan oleh kualitas telur, sperma, media dan
penanganan manusia. Telur yang terfertilisasi terlihat dari warna telur yang bening.
Telur yang perkembangannya sehat adalah berwarna transparan dan bersih, sehingga
mudah dibedakan dengan telur yang mati. Morfologi (bentuk dan struktur) sperma
juga tak kalah pentingnya dalam menentukan keberhasilan pembuahan. Bila
sepertiga dari jumlah sperma yang dihasilkan memiliki bentuk dan struktur yang
normal maka kemungkinan terjadinya pembuahan juga makin tinggi. Jika ada bagian
dari sepasang kromosom homolog tidak bergerak memisahkan diri pada waktu
mitosis, satu gamet menerima dua jenis kromosom yang sama dan gamet lainnya
tidak mendapatkan kromosom. Jika salah satu gamet yang menyimpang bersatu
dengan gamet normal pada waktu pembuahan, maka keturunannya akan memiliki
jumlah kromosom yang abnormal. Bila organisme tersebut mampu bertahan hidup,
organisme tersebut akan memperlihatkan sejumlah gejala yang disebabkan oleh
abnormalnya jumlah gen yang terletak pada kromosom tambahan atau kromosom
yang hilang. Abnormalitas terjadi diduga saat pemberian kejutan suhu panas ada
sebagian telur yang belum bisa mengembalikan jumlah kromosom yang berkurang
pada saat proses perkembangan telur yang diinginkan, yaitu menghasilkan sigot
diploid (2n) dan telah mengalami modifikasi kromosom, sehingga sebagian telur
yang menetas pada tiap perlakuan ada yang menghasilkan larva abnormal
(Subekti,2009).
Analisis sperma adalah suatu pemeriksaanyang penting untuk menilai organ
reproduksi pria. Untuk mengetahui apakah seorang pria fertil atau infertil. Peranan
analisa semen penting sekali. Semen diperiksa harus dari seluruh cyakulat. Karena

itu mengambilnya harus dari tubuh harus dengan masturbasi atau couptus interuptus
(Khaidir, 2006).

IV. KESIMPULAN DAN SARAN
A. Kesimpulan
1. Volume sperma yang dihasilkan adalah 0,4 ml.
2. Viskositas sperma yang dihasilkan adalah 3 menit 7 detik menit
3. Bau sperma yang dihasilkan adalah bau amis
4. Warna sperma yang dihasilkan adalah putih susu
5. pH sperma 8,5 yang berarti basa.
6. Persentase sperma motil adalah 50 % dan sperma non motil adalah 50 %.
7. Jumlah total spermatozoa adalah 5,45 x1010 sel/ml.
8. Kualitas dan kuantitas spermatozoa kurang baik sebab berdasarkan
pengamatan terdapat beberapa hasil yang tidak sesuai dengan pustaka
diantaranya yaitu persentase spermatozoa motil dan non motil dan pH sehingga
tingkat keberhasilan spermatozoa untuk membuahi sel telurnya adalah kecil.
B. Saran
1. Sebaiknya pengamatan motilitas spermatozoa segera setelah dilakukan
pengenceran supaya masih dapat terlihat sperma yang motil.
2. Sebaiknya penghitungan jumlah total spermatozoa menggunakan alat bantu
yang lebih akurat sehingga tidak salah dalam penghitungannya.

DAFTAR REFERENSI
Condro, Herdianto Sapto. 2012. Pengaruh Penambahan Madu Pada Media Pengencer NaCl Fisiologis Dalam Proses Penyimpanan Sperma Terhadap Kualitas Sperma Ikan Komet ( Carassius auratus auratus ). Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya.
Hajirezaee, et al. 2010. Fish milt quality and major factors influencing the milt quality parameters: A review. Faculty of Natural Resources, Department of Fisheries and Environmental Sciences, University of Tehran.
Khaidir, Masrizal. 2006. Penilaian Tingkat Fertilitas dan Penatalaksanaannya Pada Pria. Jurnal Kesehatan Masyarakat. Hal 30 – 34.
Maria et al., 2006. Effects of cooling and freezing on sperm motility of the endangered fish piracanjuba Brycon orbignyanus (Characiformes, Characidae). Brazil
Meirnawati, setyana, dkk. 2011. Daya Fertilisasi Sperma Beku Ikan Tawes (Puntius javanicus) Setelah Disimpan Dengan Fruktosa Dan Tris Aminomethan. Fakultas Perikanan dan Kelautan Universitas Airlangga. Surabaya.
Partodiharjo, Soebadi. 1990. Ilmu Reproduksi Hewan. Mutiara Sumber Widya, Surabaya.
Salman, M. T. 2007. Sperm quality of male rats treated with aqueous extract of Enantia chlorantha stem bark. College of Health Sciences, University of Ilorin, Ilorin, Nigeria.
Soeminto, et al . 2002. Pembentukan Ikan Jantan Homogamet (XX) lewat Ginosenis dan Pemberian Andriol pada Ikan Nilem ( Osteocillus hasselti CV). Fakultas Biologi Unsoed, Purwokerto.
Subekti. 2009. Pengaruh Kejutan Suhu Panas Dan Lama Waktu Setelah Pembuahan Terhadap Daya Tetas Dan Abnormalitas Larva Ikan Nila ( Oreochromis niloticus ) . Fakultas Perikanan dan Kelautan Universitas Airlangga . Surabaya.
Yatim, W. 1982. Reproduksi dan Embriologi. Tarsito, Bandung.