85569864-Registrasi-Obat
-
Upload
danyorakhmadasitorus -
Category
Documents
-
view
3 -
download
1
Transcript of 85569864-Registrasi-Obat
-
Registrasi Obat
Menurut klasifikasi Anatomical Therapeutic Chemical (ATC), obat diklasifikasikan dalam
kelas terapetik. Registrasi obat dikategorikan menjadi dua yaitu:
1. Registrasi baru
Kategori yang termasuk dalam registrasi baru adalah:
1. Kategori 1
Adalah registrasi obat baru dengan zat aktif baru atau derivat baru atau kombinasi baru atau
dalam bentuk sediaan baru
2. Kategori 2
Adalah registrasi obat dengan komposisi lama dalam bentuk sediaan baru atau kekuatan
baru atau produk biologi sejenis
3. Kategori 3
Adalah registrasi obat atau produk biologi dengan komposisi lama dengan:
1. indikasi baru
2. posologi baru
4. Kategori 4
Adalah registrasi obat copy dengan:
4.1 obat copy dengan nama dagang
4.2 obat copy dengan nama generik
5. Kategori 5
Adalah registrasi sediaan lain yang mengandung obat
2. Registrasi variasi
Kategori yang termasuk registrasi variasi adalah:
1. Kategori 6
Adalah registrasi obat copy yang sudah mendapat izin edar dengan perubahan yang sudah
pernah disetujui di Indonesia :
6.1 perubahan atau penambahan bentuk sediaan dengan posologi atau cara pemberian yang
berbeda
6.2 perubahan atau penambahan bentuk sediaan
-
6.3 perubahan atau penambahan kekuatan sediaan
6.4 perubahan komposisi
6.5 perubahan obat copy dengan nama dgaang menjadi obat copy dengan nama generik
atau sebaliknya
2. Kategori 7
Adalah registrasi obat yang sudah mendapat izin edar dengan perubahan klim penandaan
yang mempengaruhi keamanan
3. Kategori 8
Adalah registrasi obat yang sudah mendapat izin edar dengan:
8.1 perubahan zat tambahan
8.2 perubahan spesifikasi dan/atau metode analisa
8.3 perubahan stabilitas
8.4 perubahan teknologi prodiksi dan/atau tempat produksi
4. Kategori 9
Adalah registrasi obat yang sudah mendapat izin edar dengan perubahan atau penambahan
jenis kemasan
5. Kategori 10
Adalah registrasi obat yang sudah mendapat izin edar dengan:
10.1 perubahan klim penandaan yang tidak mempengaruhi efikasi, keamanan dan mutu
10.2 perubahan desain kemasan
10.3 perubahan nama pabrik atau nama pemberi lisensi
10.4 perubahan importir
10.5 perubahan/penambahan besar kemasan
10.6 perubahan nama dagang tanpa perubahan formula dan jenis kemasan
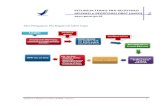
Registrasi obat diajukan oleh pendaftar kepada Kepala Badan POM. Registrasi dilakukan
dalam dua tahap, yaitu pra-registrasi dan penyerahan berkas registrasi. Penyerahan berkas
registrasi dilakukan dengan menggunakan formulir registrasi dan disket, dilengkapi dengan
dokumen-dokumen penunjang sesuai ketentuan yang berlaku. Data dan segala sesuatu yang
berhubungan dengan penilaian dan pengujian dalam rangka registrasi obat dijaga kerahasiaannya
oleh Kepala Badan POM.
-
1. Pra-registrasi
Pra-registrasi adalah prosedur registrasi yang dilakukan untuk menentukan jalur evaluasi dan
kelengkapan dokumen registrasi obat untuk kategori 1, kategori 2, kategori 3, kategori 4,
kategori 5, kategori 6, kategori 7. Pengajuan pra-registrasi disertai dengan penyerahan dokumen
pra-registrasi dan dilengkapi dengan bukti penulusuran nama obat. Nama obat dapat merupakan
nama generik atau nama dagang berdasarkan Pedoman Umum Nama Obat. Dokumen pra-
registrasi digunakan untuk pertimbangan penetapan jalur evaluasi dan dilengkapi dengnan
laporan administratif. Jika diperlukan, kriteria penetapan jalur evaluasi dilengkapi dengan rincian
laporan independen. Hasil pra-registrasi diberitahukan secara tertulis kepada pendaftar dan
bersifat mengikat.
Dokumen pra-registrasi terdiri dari:
I. Dokumen Teknis
1. Obat baru dan produk biologi terdiri dari:
1. Ringkasan produk yang didaftarkan
2. Ringkasan data ilmiah yang dilengkapi dengan referensi
yang menunjang
3. Dokumen pertimbangan penetapan jalur evaluasi
4. Informasi produk dari negara acuan dalam bahasa inggris
5. Nama, alamat/negara dari industri yang terlibat dalam
pembuatan zat aktif dan obat jadi
6. Informasi tentang zat tambahan yang berasal dari hewan
(bila ada)
7. CoA bahan baku zat aktif dan obat jadi
8. Protokol dan data hasil uji stabilitas zat aktif dari produk
biologi
2. Obat copy terdiri dari:
1. Ringkasan produk yang didaftarkan
2. Dokumen pertimbangan penetapan jalur evaluasi
3. Kelengkapan data mutu dan teknologi:
-
i. Spesifikasi dan prosedur tetap metoda pengujian
bahan baku dan obat
ii. Protokol uji stabilitas obat
iii. Protokol uji disolusi terbanding, jika persyaratan
iv. Protokol uji bioekuivalen, jika dipersyaratkan
II. Dokumen Administratif
1. Obat produksi dalam negeri:
1. Obat tanpa lisensi
Izin industri farmasi atau Surat Persetujuan Penanaman Modal Asing
Sertifikat Cara Pembuatan Obat yang Baik (CPOB) untuk bentuk sediaan
yang didaftarkan
2. Obat lisensi
Izin industri farmasi atau dokumen penunjang dengan bukti yang cukup
untuk badan/institusi riset sebagai pemberi lisensi
Izin industri farmasi sebagai penerima lisensi
Sertifikat CPOB industri farmasi penerima lisensi untuk bentuk sediaan
yang didaftarkan
Perjanjian lisensi
c. Obat kontrak
Izin industri farmasi pendaftar atau dokumen penunjang dengan bukti
yang cukup untuk badan/institusi lain
Izin industri farmasi sebagai penerima kontrak
Perjanjian kontrak
Sertifikat CPOB industri farmasi pendaftar
Sertifikat CPOB industri farmasi penerima kontrak sesuai bentuk sediaan
obat yang dikontrakkan
2. Obat impor terdiri dari:
1. Salinan dokumen administratif
Izin industri farmasi atau pedagang besar farmasi importir
Surat penunjukan dari industri farmasi atau pemilik produk luar negeri
-
Certificate of Pharmaceutical Product dari negara produsen dan negara
dimana diterbitkan sertifikat pelulusan bets
Sertifikat CPOB dari produsen di luar negeri
Site Mater File industri farmasi di luar negeri, yang belum mempunyai
produk dengan persyaratan sama yang disetujui beredar di Indonesia,
terdiri dari antara lain Struktur Organisasi, Personalia, Fasilitas Produksi
yang dimiliki, Daftar SOP, Daftar Produk dan Inspeksi terakhir dari
otoritas setempat
2. Dokumen mengenai perimbangan
kegiatan impor dan ekspor.
3. Dokumen penunjang informasi
kebutuhan untuk program kesehatan
masyarakat.
Kriteria penetapan jalur evaluasi obat baru dan produk biologi terdiri dari :
I. Jalur I (100 hari kerja)
Obat yang indikasinya untuk terapi penyakit serius dan penyakit yang mengancam nyawa
manusia, sebagai berikut:
1. a. Obat dengan zat aktif baru (New Chemical Entity) dan
b. Obat yang memiliki bukti klinis yang bermakna yang dapat menunjukan terapi yang
penting untuk menyelamatkan nyawa manusia. Contoh:
Obat untuk AIDS dan penyakit yang terkait dengan HIV;
Obat untuk gangguan neurologik yang berat, seperti penyakit Alzheimer,
Amyothropic Lateral Sclerosis (ALS), Multiple Sclerosis
Obat untuk kanker dan penyakit disabling yang lain
2. Obat yang mempunyai bukti valid seperti Orphan Drug di beberapa negara seperti
Amerika Serikat, Uni Eropa, Australia, Se;andia Baru, dan Inggris
II. Jalur II (150 hari kerja)
Obat yang telah beredar di negara-negara sebagai berikut:
-
1. Negara yang telah menerapkan siostem evaluasi terharmonisasi antara lain adalah
negara Eropa dengan sistem evaluasi melalui EMEA (The European Agency for
the Evaluation of Medicinal Products)
2. Negara dengan sistem evaluasi yang telah dikenal baik
II. Jalur III (300 hari kerja)
Obat yang tidak memenuhi kriteria evaluasi melalui jalur I maupun jalur II
2. Registrasi
Pengajuan registrasi dilakukan dengan menyerahkan berkas registrasi dengan mengisi
formulir registrasi dan disket disertai bukti pembayaran biaya evaluasi dan pendaftaran, dan hasil
pra registrasi. Formulir registrasi atau disket disediakan oleh Direktorat Penilaian Obat dan
Produk Biologi. Pendaftar diwajibkan membayar biaya evaluasi. Biaya evaluasi sesuai dengan
Ketentuan Peraturan Pemenrintah tentang Tarif Atas Jenis Penerimaan Negara Bukan Pajak
(PNBP) yang berlaku pada Badan Pengawas Obat dan Makanan.
Untuk keperluan evaluasi mutu, pendaftar harus menyerahkan contoh obat untuk tiga kali
pengujian dan bahan baku pembanding sesuai spesifikasi dan metode pengujian zat aktif dan
obat dimaksud. Pengecualian untuk obat copy, penyerahan obat dan bahan baku pembanding
adalah apabila diperlukan. Pelaksanaan penyerahan contoh dan bahan baku obat akan diteapkan
tersndiri oleh Kepala Badan POM. Registrasi obat kontrak, obat lisensi, dan obat impor, selain
harus memenuhi ketentuan registrasi obat, juga harus menyertakan lampiran yang telah
ditentukan pada Lampiran 8 Keputusan Kepala Badan POM RI No. HK.00.05.3.1950 tentang
Kriteria dan Tata Laksana Registrasi Obat.
3. Berkas registrasi
Berkas registrasi terdiri atas formulir registrasi dengan dokumen administratif dan dokumen
penunjang. Dokumen administratif merupakan yang harus dilengkapi untuk registrasi obat.
Dokumen penunjang terdiri dari dokumen mutu dan teknologi untuk menjamin mutu; dokumen
uji pre klinik yang menggambarkan farmakodinamik, farmakokinetik maupun toksisitas yang
aman, sebelum diuji coba pada manusia dan matriks laporan uji klinik; dan dokumen uji klinik
harus dapat membuktikan efikasi dan keamanan obat jadi secara meyakinkan dan matriks
laporan uji klinik.
-
Formulir registrasi harus dilengkapi dengan rancangan kemasan yang meliputi etiket,
dus/bungkus luar, strip/blister, catch cover, ampul/vial, dan kemasan lain sesuai ketentuan
tentang pembungkusan dan penandaan yang berlaku, yang merupakan rancangan kemasan obat
yang akan diedarkan dan dapat dilengkapi dengan rancangan warna dan brosur yang merupakan
informasi mengenai obat.
Rancangan kemasan khusus untuk obat generik, sesuai dengan ketentuan mengenai
spesifikasi baku obat generik. Informasi minimal yang harus dicantumkan pada rancangan
kemasan sesuai dengan Lampiran 14 Keputusan Kepala Badan POM RI No. HK.00.05.3.1950
tentang Kriteria dan Tata Laksana Registrasi Obat. Informasi minimal yang harus dicantumkan
dalm brosur adalah sesuai dengan Lampiran 15 Keputusan Kepala Badan POM RI No.
HK.00.05.3.1950 tentang Kriteria dan Tata Laksana Registrasi Obat.
Untuk registrasi baru, berkas yang diserahkan terdiri dari disket yang telah diisi sesuai data
pada Formulir A, Formulir B1, Formulir B2, Formulir B3, Formulir B4, Formulir C1, Formulir C2,
Formulir C3, Formulir D dan dokumen penunjang registrasi baru utuk masing-masing kategori
sesuai Lampiran 16 Keputusan Kepala Badan POM RI No. HK.00.05.3.1950 tentang Kriteria
dan Tata Laksana Registrasi Obat. Berkas registrasi obat copy dengan zat aktif yang telah ada
Standar Informasi Elektronik (STINEL), terdiri atas diket yang telah diisi sesuai data pada
Formulir A, Formulir B2 1-13, serta berkas Formulir A, Formulir B1, Formulir B2 14, Formulir
B3, Formulir B4, Formulir C1, dan Formulir D. Berkas registrasi obat copy dengan zat aktif yang
belum ada STINEL terdiri atas disket yang telah didisi sesuai data pada Formulir A, serta berkas
Formulir A, Formulir B1, Formulir B2, Formulir B3, Formulir C1, dan Formulir D. Untuk
registrasi variasi, berkas yang diserahkan terdiri atas disket yang telah diisi sesuai data pada
Formulir dan dokumen penunjang egistrasi variasi untuk masing-masing kategori.
4. Pengisian Formulir
Pengisian formulir registrasi dan dokumen registrasi mengikuti ketentuan sebagai berikut:
pengisian formulir registrasi harus menggunakan bahasa Indonesia atau bahasa Inggris; dokumen
registrasi dapat menggunakan bahasa Indonesia atau bahasa Inggris; penandaan obat bebas/bebas
terbatas harus menggunakan bahasa Indonesia; penandaan obat khusus ekspor sekurang-
kurangya menggunakan bahasa Inggris. Pedoman pengisian formulir registrasi sesuai Lampiran
19 sedangkan dalam pengisian formulir registrasi penulisan zat aktif dan zat tambahan sesuai
-
dengan Lampiran 20 Keputusan Kepala Badan POM RI No. HK.00.05.3.1950 tentang Kriteria
dan Tata Laksana Registrasi Obat.