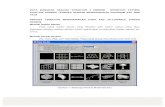
struktur lewins NH3BCl3
-
Upload
ila-fathmarullah-masuku -
Category
Documents
-
view
266 -
download
0
Transcript of struktur lewins NH3BCl3
-
7/22/2019 struktur lewins NH3BCl3
1/5
1. Perhatikan struktur lewins NH3BCl3 berikut ini !
Pasangan electron yang terbentuk secara kovalen koordinasi ditunjukan pada nomor .
(Nomor atom N=7 ; H=1 ; Cl=17 ; B=5)
A. 1B. 2C. 3D. 4E. 5
2. Harga keempat bilangan kuantum dari electron terakhir dari unsur 8035
X adalah
A. N=4; l=1; m=0; s=-1/2B. N=4; l=3; m=+2; s=+1/2C. N=4; l=3; m=-1; s=-1/2D. N=4; l=2; m=-1; s=+1/2E. N=4; l=2; m=+2; s=-1/2
3. Konfigurasi electron dan letak unsure dalam tabel sistem periodik unsur 30Zn adalah.(nomor atom Ar=18)
4. Unsur P dan Z memiliki konfigurasi sebagai berikut :P= 1s22s22p63s23p3
Z=1s22s22p5
Jika kedua unsure berkaitan sesuai aturan oktet bentuk molekul seyawa yang terjadi adalah .
A. Segitiga datarB. Segitiga piramidaC. TetrahedralD. Segiempat piramidaE. Octahedral
-
7/22/2019 struktur lewins NH3BCl3
2/5
5. Perhatikan data sifat fisik dari 2 buah zat berikut !
Berdasarkan data tersebut, jenis ikatan yang terdapat dalam zat X dan Y berturut-turut adalah
A. Kovalen dan ionB. Kovalen dan logamC. Kovalen polar dan ionD. Kovalen non polar dan ionE. Ion dan kovalen polar
6. Perhatikan grafik titik didih beberapa senyawa hidrida golongan IVA, VA dan VIA !
Berdasarkan grafik tersebut, senyawa yang mengandung ikatan hidrogen antara molekulnya
adalah.
A. 1 dan 2B. 1 dan 4C. 2 dan 3D. 3 dan 5E. 3 dan 6
7. Dalam suatu bejana tertutup berlangsung reaksi pembakaran 90 gram glukosa dan 96 gram gasoksigen menghasilkan gas karbondioksida dan uap air menurut reaksi:
C6H12O6 (s) + 6 O2 (g) 6 O2 (g) +6 H2O (l)Masa zat hasil reaksi adalah .(Ar C=12; H=1; O=16)
A. 64 gramB. 108 gramC. 186 gramD. 192 gramE. 264 gram
-
7/22/2019 struktur lewins NH3BCl3
3/5
8. Ktristal kalsium klorida (CaCl2.xH2O) sebanyak 5,88 gram dipanaskan, massanya berkuranghingga tersisa 4,44 gram kalsium klorida menurut reaksi :
CaCl2.xH2O (s) CaCl2(s) + xH2O(g)
Rumus senyawa Kristal tersebut adalah .(Ar Ca=40; Cl=35,5; H=1; O=16)
A. CaCl2.H2OB. CaCl2. 2H2OC. CaCl2. 3H2OD. CaCl2. 4H2OE. CaCl2. 5H2O
9. Salah satu proses dalam industry kecil kerajinan tangan logam tembaga adalah pelarutan logamdengan larutan besi (III)klorida. Reaksi pelarutan tersebut menhghasilkan larutan besi (II) dan
tembaga (II)klorida . persamaan reaksi setara yang menunjukan proses terebut adalah .
A. 2FeCl2(aq) + Cu(s) 2FeCl3(aq) + CuCl2(aq)B. Fe2Cl3(aq) + Cu(s) 2Fe(s) + CuCl3(aq)C. 2FeCl(aq) +2 Cu(s) 2Fe2Cl(aq) + Cu2Cl(aq)D. CuCl2(aq) + Fe(s) FeCl2(aq) + Cu(s)E. 2FeCl3(aq) + Cu(s) 2FeCl(aq) + CuCl2(aq)
10.Perhatikan data percobaan uji larutan berikut !
Pasangan senyawa yang merupakan larutan elektrolit kuat dan non elektrolit berturut-turut ditunjukan oleh larutan nomor.
A. (1) dan (3)B. (2) dan (5)C. (4) dan (5)D. (5) dan (1)E. (5) dan (3)
11.Larutan 100 mL H2SO4 0,04 M memiliki pH sebesar.A. 2log 8B. 4log 2C. 4log 8D. 12log 4E. 12 + log 8
-
7/22/2019 struktur lewins NH3BCl3
4/5
12.Sebanyak 20 mL asam sulfat di masukan ke dalam labu Erlenmeyer, setelah di tetesi 3 tetesfenolftalien di titrasi dengan larutan KOH 0,5 M diperoleh data sebagai berikut :
Berdasarkan data tersebut , kosentrasi asam sulfat yang dititrasi sebesar .
A. 1,000 MB. 0,750 MC. 0,500 MD. 0,250 ME. 0,050 M
13.Perhatikan data uji pH beberapa larutan !
Larutan yang merupakan larutan penyangga adalah .
A. P dan QB. Q dan RC. R dan SD. R dan TE. S dan T
14.Garam ammonium klorida NH4Cl dapat dibuat dengan mereaksikan 50 mL larutan NH30,2 M dan50 mL larutan HCl 0,2 M, menurut reaksi : NH3(aq) + HCl(aq) NH4Cl(aq).
Senyawa tersebut dalam air mengalami hidrolisis dengan pH larutan sebesar .
(Kb NH3=10-5
; Kw=10-14
)
A. 1log 5B. 1 + log 5C. 5 + log 1D. 9 + log 1E. 9 + log 5
-
7/22/2019 struktur lewins NH3BCl3
5/5
15.Sebanyak 100 mL larutan Ba(NO3)2 0,4 M di campurkan dengan 100 mL larutan Na2SO40,4 M.Jika Ksp BaSO4 = 1.10
-10, masa BaSO4 yang mengedap sebanyak .
(Ar Ba = 137; s =32; O=16; Na = 23; N =14)
A. 2,33 gramB. 9,32 gramC. 23,30 gramD. 56,80 gramE. 93,20 gram