Periode dan golongan
-
Upload
furinda -
Category
Data & Analytics
-
view
520 -
download
7
Transcript of Periode dan golongan

Tugas Pengantar Elektronik
AFRINDA WAHYUNINGRUM
A1F012045

PERIODE DAN GOLONGAN

PERKEMBANGAN TABEL PERIODIK
1. TRIADE ( DOBEREINER )
Unsur-unsur dikelompokkan berdasarkan kemiripan sifat-sifatnya.
Tiap kelompok beranggotakan tiga unsur, sehingga disebut triad.
Di dalam triad, unsur kedua mempunyai sifat-sifat yang berada di antara unsur pertama dan ketiga.
Contoh :

PERKEMBANGAN TABEL PERIODIK
2. SISTEM OKTAF ( NEWLANDS )
Unsur-unsur dikelompokkan berdasarkan kenaikan massa atom . Sifat unsur ke-8 mirip dengan sifat unsur ke-1 Karena terjadi pengulangan sifat setiap unsur ke-8 maka disebut Hukum Oktaf.
Contoh :

PERKEMBANGAN TABEL PERIODIK3. SISTEM PERIODIK PENDEK ( MENDELEEV )
Ia mengelompokkan unsur-unsur berdasarkan kenaikan massa atom secara horisontal membentuk baris yang disebut periode.
Penyususnan pada periode akan berhenti dan berganti pada periode berikutnya jika terjadi pengulangan sifat unsur.
Unsur-unsur dengan sifat yang mirip akan membentuk kolom yang disebut golongan.

1.1. Unsur-unsur ditata dalam 12 baris mendatar dan 8 kolom tegak atau golongan Unsur-unsur ditata dalam 12 baris mendatar dan 8 kolom tegak atau golongan Agar unsur dapat dimasukkan dalam golongan yang sesuai maka perlu Agar unsur dapat dimasukkan dalam golongan yang sesuai maka perlu ditinggalkan beberapa ruang kosongditinggalkan beberapa ruang kosong
2.2. Unsur-unsur yang termasuk dalam sub golongan yang sama pada tabel Unsur-unsur yang termasuk dalam sub golongan yang sama pada tabel Mendeleev mempunyai sifat fisik dan kimia yang samaMendeleev mempunyai sifat fisik dan kimia yang sama
3.3. Sifat-sifat ini berubah secara berangsur-angsur dari atas ke bagian bawah Sifat-sifat ini berubah secara berangsur-angsur dari atas ke bagian bawah golongan Li(174golongan Li(174ooC) > Na(97,8C) > Na(97,8ooC) > K(63,7C) > K(63,7ooC) > Rb(38,9C) > Rb(38,9ooC) > Cs(28,5C) > Cs(28,5ooC)C)
4.4. Untuk menempatkannya dengan benar pada tabel, Mendeleev membuat Untuk menempatkannya dengan benar pada tabel, Mendeleev membuat penyesuaian salah satunya Indium Mulanya In diduga memiliki bobot 76 penyesuaian salah satunya Indium Mulanya In diduga memiliki bobot 76 dengan bentuk oksida InO, namun Mendeleev menga jukan senyawa Indengan bentuk oksida InO, namun Mendeleev menga jukan senyawa In22OO33 dengan bobot 113 dan terletak antara kadmium dan timahdengan bobot 113 dan terletak antara kadmium dan timah
5.5. Atom lain yang mengalami penyesuaian antara lain Berilium (13,5 menjadi 9),Atom lain yang mengalami penyesuaian antara lain Berilium (13,5 menjadi 9), uranium (120 menjadi 240).uranium (120 menjadi 240).6.6. Mendeleev dengan sengaja meninggalkan ruang kosong dalam tabelnya Mendeleev dengan sengaja meninggalkan ruang kosong dalam tabelnya
untuk unsur-unsur yang belum ditemukanuntuk unsur-unsur yang belum ditemukan7.7. Salah satu unsur yang berhasil diramalnya adalah Germanium dengan Salah satu unsur yang berhasil diramalnya adalah Germanium dengan
perkiraan sifat-sifat fisika dan kimia yang mendekati kenyataanperkiraan sifat-sifat fisika dan kimia yang mendekati kenyataan
KELEBIHAN SISTEM MENDELEYEVKELEBIHAN SISTEM MENDELEYEV

PERKEMBANGAN TABEL PERIODIK
4. SISTEM PERIODIK LOTHAR MEYER
Sistem periodik pertama yang dibuat berdasarkan kenaikan massa
atom dan kemiripan sifat unsur.I II III IV V VI VII VIII IX
B=11.0 Al=27.3 -- ?In=113.4 Tl=202.7
-- -- --
C=11.97 Si =28 -- Sn=117.8 Pb=206.4
Ti=48 Zr=89.7 --
N=14.01 P=30.9 As=74.9 Sb=122.1 Bi=207.5
V=51.2 Nb=93.7 Ta=182.2
O=15.96 S=31.98 Se=78 Te=128? --
Cr=52.4 Mo=95.6 W=183.5
- F=19.1 Cl=35.38 Br=79.75 J=126.5 --
Mn=54.8 Ru=103.5 Os=198.6?
Fe=55.9 Rh=104.1 Ir=196.7
Co = Ni = 58.6 Pd=106.2 Pt=196.7
Li=7.01 Na=22.99 K=39.04 Rb=85.2 Cs=132.7 --
Ag=107.66 Au=196.2
?Be=9.8 Mg=23.9 Ca=39.9 Sr=87.0 Ba=136.8 --
Zn=64.9 Cd=111.6 Hg=199.8
Periodic table according to Lothar Meyer,1870

PERKEMBANGAN TABEL PERIODIK
5. SISTEM PERIODIK BENTUK MODERN ( MOSELEY )
Penyusunan unsur berdasarkan kenaikan nomor atom dan kemiripan sifat, yang menghasilkan keteraturan pengulangan sifat berupa periode ( baris ) dan kemiripan sifat berupa golongan ( kolom ).
Kemiripan sifat dari unsur-unsur dalam golongan yang sama, terkait dengan konfigurasi elektronnya.

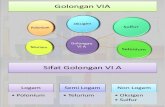
GOLONGAN DAN PERIODEA. GOLONGAN
2. Sistem 18 golongan
Golongan A ( utama )Golongan A ( utama ) Nama Nama Golongan B ( transisi ) Golongan B ( transisi )
I AI A
II AII A
III AIII A
IV AIV A
V AV A
VI AVI A
VII AVII A
VIII AVIII A
Golongan alkaliGolongan alkali
Golongan alkali tanahGolongan alkali tanah
Golongan boronGolongan boron
Golongan karbonGolongan karbon
Golongan nitrogenGolongan nitrogen
Golongan oksigenGolongan oksigen
Golongan halogenGolongan halogen
Golongan gas muliaGolongan gas mulia
I BI B
II BII B
III BIII B
IV BIV B
V BV B
VI BVI B
VII BVII B
VIII BVIII B
Kolom-kolom vertikal dalam sistem periodik disebut golongan.Ada 2 cara penamaan golongan, yaitu :
1. Sistem 8 golongan
Sistem periodik dibagi dalam 8 golongan yang masing-masing terdiri atas golongan utama ( golongan A ) dan golongan transisi ( golongan B ).Nomor golongan ditulis dengan angka romawi
Sistem periodik dibagi dalam 18 golongan, yaitu golongan 1 sampai dengan 18, dimulai dari kiri.

GOLONGAN DAN PERIODE
B. PERIODE
Lajur-lajur horisontal dalam sistem periodik disebut periode.
Sistem periodik modern terdiri dari 7 periode.
periodeperiode Jumlah unsurJumlah unsur Nomor atomNomor atom
11223344556677
228888
1818181832323232
1-21-23-103-10
11-1811-1819-3619-3637-5437-5455-8655-86
87-11887-118

HUB. KONFIGURASI ELEKTRON DENGAN SPU
1. Nomor periode sama dengan jumlah kulit
2. Nomor golongan sama dengan jumlah elektron valensi ( khusus golongan utama ).
Letak unsur dalam sistem periodik dapat ditentukan berdasarkan konfigurasi elektronnya, atau sebaliknya, konfigurasi elektron dapat ditentukan berdasarkan letak unsur dalam sistem periodik.
Contoh :
unsurunsur Konfigurasi elektronKonfigurasi elektron periodeperiode golongangolongan
AA
XX
2 8 42 8 4
2 8 8 12 8 8 1
2 8 18 72 8 18 7
33
44
55
IVAIVA
IAIA
VIIAVIIA
Hubungan Konfigurasi Elektron dengan SPU

SIFAT PERIODIK UNSURA. JARI-JARI ATOM
Jari-jari atom adalah jarak dari inti hingga kulit terluar.

SIFAT PERIODIK UNSURA. JARI-
JARI VOLUME ATOM
JARI-JARI ION

SIFAT PERIODIK UNSUR
B. ENERGI IONISASI
Energi ionisasi adalah besarnya energi yang diperlukan untuk melepas satu elektron dari suatu atom netral dalam wujud gas sehingga terbentuk ion berwujud gas dengan muatan +1.

TABEL ENERGI IONISASI

SIFAT PERIODIK UNSUR
C. AFINITAS ELEKTRON
Afinitas elektron, yaitu besarnya energi yang menyertai atom untuk menerima sebuah elektron.
Afinitas elektron adalah perubahan entalpi Afinitas elektron adalah perubahan entalpi ∆∆H yang terjadi apabila sebuah atom H yang terjadi apabila sebuah atom netral dalam fase gas menerima sebuah elektron dari jarak tak terhingganetral dalam fase gas menerima sebuah elektron dari jarak tak terhingga
Misal: ClMisal: Cl(g)(g) + e + e-- Cl Cl--(g)(g) EA = -3,615 eVEA = -3,615 eV

SIFAT PERIODIK UNSUR
D. KEELEKTRONEGATIFAN
Keelektronegatifan adalah besarnya tendensi/kecenderungan suatu atom untuk menerima elektron.

SIFAT PERIODIK UNSUR
E. TITIK DIDIH DAN KELOGAMAN
Satu periode :
dari kiri kanan makin bertambah puncaknya pada golongan IV A kemudian menurun drastis sampai golongan VIII A
Satu golongan :Golongan I A sampai IV A dari atas ke bawah makin rendah titik didih dan tititk lelehnya
Golongan V A sampai VIII A dari atas ke bawah titik didih dan titik leleh makin tinggi

Ringkasan Sifat Periodik Unsur

THANK YOU FOR
YOUR ATTENTION