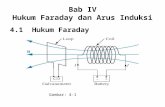
Perbedaan Sel Kering dan Basah serta menjelaskan Hukum Faraday
-
Upload
diana-amrita -
Category
Documents
-
view
8.547 -
download
2
Transcript of Perbedaan Sel Kering dan Basah serta menjelaskan Hukum Faraday

TUGAS KIMIAPERBEDAAN SEL KERING DAN BASAH DAN MENJELASKAN
HUKUM FARADAY
PROGRAM STUDI PENDIDIKAN FISIKAJURUSAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
FAKULTAS KEGURUAN DAN ILMU PENDIDIKANUNIVERSITAS LAMBUNG MANGKURAT
2012

TUGAS KIMIAPERBEDAAN SEL KERING DAN BASAH DAN
MENJELASKAN HUKUM FARADAY
DOSEN PEMBIMBING :Drs. H. A. KUSASI, M.PD
DISUSUN OLEH :DESSY LAILA KAMSINAH A1C412004NURUL ATQIYA A1C412012ANDY AZHARI A1C412020INTAN RIAS RINDANG SARI A1C412022PUTRI DIANA AMRITA A1C412026YULIA NOR ANNISA A1C412030ACHY ROLENTHA A1C412058RUSDIANSYAH A1C412018ROBITH SAIFULLAH A1C412208MILANDARI A1C412070

A. Aki / Baterai Timbal (Accu)
1. Sejarah:
Penemu aki Adalah Alessandro Volta Berasal dari Negara Italia 2. Pengertian:
ACCU (mulator) atau sering disebut aki, adalah salah satu komponen utama dalam kendaraan bermotor, baik mobil atau motor, semua memerlukan aki untuk dapat menghidupkan mesin mobil (mencatu arus pada dinamo stater kendaraan). Aki mampu mengubah tenaga kimia menjadi tenaga listrik.

3. Syarat Pembuatan Aki :
1 • Elektrodanya harus dari bahan penghantar listrik
2 • Kedua macam elektrodanya harus dari bahan yang berbeda.
3• Elektrolit nya harus mengandung
asam,basa, atau garam,sehingga larutan itu merupakan penghantar listrik
4• Perbedaan pada elektroda dan
elektrolitnya yang di gunakan akan membuat perbedaan pula pada tegangan yang dihasilkannya, namun umumnya tidak lebih dari 2,2 volt tiap selnya.
5• Arus listrik yang dihasilkan dapat
diperbesar dengan jalan menambah luas permukaan elektroda yang terhubung langsung dengan elektrolit namun hal ini tidak berpengaruh pada tegangan (Volt).

Dalam baterai timbal:Elektroda negatif : logam timbal (Pb) Elektroda positifnya : timbal yang dilapisi timbal
oksida (PbO2)Elektrolit : asam sulfat (H2SO4).
4. Reaksi yang terjadi dalam aki

5. Fungsi aki
• Sebagai alat untuk menghimpun tenaga listrik (dipakai pada mesin mobil dsb)
• Penghasil, dan penyimpan daya listrik hasil reaksi kimia peranti untuk mengubah tenaga listrik menjadi tenaga kimia atau sebaliknya.

B. Baterai / Sel Kering / Sel Lelanche
• Sel Leclanché ditemukan oleh insinyur Perancis Georges Leclanché (1839-1882). Sel kering mangan terdiri dari:
• Katoda(elektroda positif) : Karbon/grafit (C)
• Anoda(elektroda negatif) : Zn• Elektrolit : Campuran berupa
pasta : MnO2 + NH4Cl + sedikit Air

Anoda : logam seng (Zn)Katoda : batang karbon/gafit (C)Elektrolit : MnO2, NH4Cl dan serbuk karbon (C)
Anoda Zn (-) : Zn → Zn2+ + 2e–
Katoda C (+) : 2MnO2 + 2NH4+ + 2e- → Mn2O3 + 2NH3 + H2OReaksi total : Zn + 2MnO2 + 2NH4+ → Zn2+ + Mn2O3 + 2NH3 + H2O
a. Baterai Biasa

Dalam sel kering alkalin, padatan KOH atau NaOH digunakan sebagai ganti NH4Cl. Umur sel kering mangan (baterai biasa) diperpendek oleh korosi zink akibat keasaman NH4Cl. Sedangkan pada sel kering alkali bebas masalah ini karena penggantian NH4Cl yang bersifat asam dengan KOH/NaOH yang bersifat basa. Jadi umur sel kering alkali lebih panjang. Selain itu juga menyebabkan energi yang lebih kuat dan tahan lama.
b. Baterai Alkaline
Anoda Zn (-) : Zn → Zn2+ + 2e–
Katoda C (+) : 2MnO2 + H2O + 2e- → Mn2O3 + 2OH–
Reaksi total : Zn + 2MnO2 + H2O → Zn2+ + Mn2O3 + 2OH–

Mirip dengan baterai timbal, sel nikel-kadmium juga reversibel. Selain itu dimungkinkan untuk membuat sel nikel-kadmium lebih kecil dan lebih ringan daripada sel timbal. Jadi sel ini digunakan sebagai batu baterai alat-alat portabel seperti : UPS, handphone dll.
Anoda Cd (-) : Cd + 2OH– → Cd(OH)2 + 2e–
Katoda NiO2 (+) : NiO2 + 2H2O + 2e– → Ni(OH)2 + 2OH–
Reaksi total : Cd + NiO2 + 2H2O → Cd(OH)2 +Ni(OH)2
c. Baterai Nikel-Kadmium

PERBEDAAN SEL BASAH DAN SEL KERING:
• Pada sel basah:• elektroda negatif :logam timbal (Pb) • elektroda positifnya : timbal yang dilapisi timbal oksida (PbO2)
• elektrolit : asam sulfat (H2SO4). • Sedangkan dalam sel kering:• Katoda(elektroda positif) : Karbon/grafit (C)• Anoda(elektroda negatif) :Zn• Elektrolit : Campuran berupa pasta : MnO2 + NH4Cl + sedikit Air
2. Sel basah / Aki dapat diisi ulang, sedangkan pada sel baterai tidak bisa.