Model Atom Rutherfor
-
Upload
anessia-atika -
Category
Documents
-
view
225 -
download
5
description
Transcript of Model Atom Rutherfor

MODEL ATOM RUTHERFORD
Ernes Rutherford adalah seorang fisikawan kelahiran Selandia Baru yang bekerja sama meneliti atom dengan J.J Thomson di Universitas Cambridge. Ernes Rutherford lahir pada tanggal 30 Agustus 1871 di Brighwater, Selandia Baru dan meninggal dalam usia 66 tahun pada tanggal 19 Oktober 1937 di Cambridge, Cambridgeshire.
Rutherford menerima pendidikan dasarnya disekolah pemerintah dan pada usia 16 tahun ia masuk Nelson Collegiate School. Pada 1889, ia memenangkan beasiswa masuk University of New Zealand di Wellington. Ia meraih dua master gelar sekaligus, ilmu matematika dan fisika pada 1893. Ia kembali mendapatkan beasiswa untuk belajar di Cambridge University di Inggris. Di sini, ia melakukan riset di laboratorium dibawah bimbingan J.J Thomson, yang menjadi awal karier fisika atomnya.
Gambar.1 Ernes Rutherford
Pada 1909, Rutherford memulai percobaan yang mengubah wajah fisika. Ia menemukan inti atom dan membangun model atom yang mirip dengan sistem tata surya. Seperti planet, elektron-elektron mengorbit sebuah pusat, inti seperti matahari. Penerimaan model ini berkembang setelah dimodifikasi dengan teori kuantum dari Neils Bohr.
Untuk menghargai penelitiannya mengenai radiasi dan inti atom, Rutherford mendapatkan hadiah nobel bidang kimia pada tahun 1908. Ia diberi gelar bangsawan pada tahun 1914, Baron Rutherford of Nelson yang pertama.
1 | P a g e

Beberapa dalil dari model atom Rutherford dapat disimpulkan sebagai berikut:
Sebagian besar volume atom merupakan ruang hampa. Massa atom terpusat di inti atom. Muatan atom terkonsentrasi pada pusat atom dengan volume yang sangat kecil.
Kelipatan muatan ini sebanding dengan massa atom. Awan elektron tidak mempengaruhi penyebaran partikel alfa.
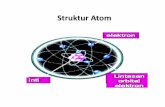
Hasil penelitian Rutherford sekaligus menggantikan model atom J.J Thomson, Rutherford mengajukan model atom yang menyatakan bahwa atom tersusun dari inti yang bermuatan positif dikelilingi elektron-elektron yang bermuatan negatif , seperti planet mengelilingi matahari. Massa atom terpusat pada inti dan sebagian besar volum atom merupakan ruang hampa/kosong. Karena atom bersifat netral, maka jumlah muatan positif dalam inti (proton) harus sama dengan jumlah elektron.
Tidak beberapa lama Rutherford mengajukan model atomnya, ternyata terdapat beberapa kelemahan. Model atom Rutherford bersifat tidak stbil karena bertentangan dengan hukum fisika klasik maxwell.
Gambar.2 Model Atom Rutherford
Pada tahun 1909, Hans Geiger dan Ernest Marsden dengan petunjuk dari Ernest Rutherford melakukan eksperimen di laboratorium fisika Universitas Manchester untuk membuktikan kebenaran dari teori atom yang dikemukakan oleh J.J Thomson
Pada tahun 1911, Ernest Rutherford bermaksud melanjutkan penelitian Philip Lenard, hanya saja Rutherford mengganti partikel elektron dengan partikel dan lempeng alumunium dengan lempeng emas.
2 | P a g e

Eksperimen ini melibatkan penembakan partikel alfa (inti atom helium atau ion helium yang bermuatan positif) yang diemisikan oleh unsur radium pada lempengan logam emas tipis dan kemudian mendeteksi partikel alfa yang telah melewati lempengan logam emas tersebut dengan menggunakan layar yang dilapisi seng sulfida (ZnS) sebagai detektor.
Rutherford berpendapat bahwa apabila struktur atom yang dikemukakan oleh thomson adalah benar maka sebagian besar berkas partikel alfa akan melewati lempengan logam emas dan sebagian kecil sekali yang akan didefleksi. Akan tetapi, hasil eksperimen Rutherford sangat mengejutkan, walaupun sebagian besar berkas partikel alfa melewati lempengan logam emas, terdapat banyak berkas partikel alfa yang didefleksi dengan sudut yang besar (lebih dari 900), bahkan terdapat berkas partikel alfa yang direfleksi kembali kearah sumber tanpa pernah menyentuh layar detektor.
Setelah merunut pola-pola partikel alfa yang ditembakkan kelempeng logam emas, maka rutherford mengambil kesimpulan bahwa sebagian besar ruang dalam atom adalah “ruang kosong” , dan terdapat massa yang terkonsentrasi pada pusat atom yang bermuatan positif dimana ukurannya 10.000 kali lebih kecil dibanding ukuran keseluruhan bagian atom, dan elektron mengelilingi inti atom tersebut seperti planet-planet mengeliligi matahari.
Gambar.3 Model Percobaan oleh Rutherford
3 | P a g e

Rutherford menyimpulkan struktur atom tersebut berlandaskan eksperimennya sebagai berikut :
1. Sebagian besar berkas partikel alfa yang dapat melewati lempengan logam emas menunjukkan bahwa partikel alfa ini melewati ruang kosong yang ada didalam atom sehingga dengan mudah partikel alfa ini melewati ruang kosong tersebut tanpa hambatan yang berarti.
2. Berkas partikel alfa yang didefleksi menunjukkan bahwa partikel alfa tersebut berada pada posisi yang dekat dengan inti atom yang bermuatan positif. Muatan positif dengan muatan positif akan saling tolak menolak, hal inilah yang menyebabkan partikel alfa dibelokkan dengan sudut yang besar.
3. Berkas partikel alfa yang direfleksi kembali (dipantulkan kembali) menunjukkan bahwa partikel alfa tersebut bertumbukkan dengan inti atom yang bermuatan positif. Inti atom emas mempunyai massa dan muatan positif yang lebih besar dibanding dengan massa dan muatan partikel alfa, hal inilah yang membuat partikel alfa dipantulkan kembali.
4. Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan.5. Jika lempeng emas tersebut dianggap sebagai satu lapisan atom-atom emas, maka
didalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.6. Partikel tersebut merupakan partikel yang menyusun suatu inti atom, berdasarkan
fakta bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka didapatkan ukuran inti atom kira-kira 10.000 lebih kecil dari pada ukuran atom keseluruhan.
Berdasarkan fakta-fakta yang didapatkan dari percobaan tersebut, Rutherford mengusulkan model atom yang dikenal dengan Model Atom Rutherford yaitu Atom yang terdiri dari inti atom yang sangat kecil dan bermuatan positif (+), dikelilingi oleh elektron yang bermuatan negatif (-).
Rutherford menduga bahwa didalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tdidak saling tolak-menolak.
Animasi percobaan oleh Rutherford
4 | P a g e

a. Kelebihan Model Atom Rutherford
Membuat hipotesa bahwa atom tersusun dari inti atom dan elektron yang mengelilingi inti. Rutherford menduga bahwa didalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak.
Berdasarkan hasil percobaan hamburan partikel alfa, Rutherford mengemukakan gagasannya tentang struktur atom yang menyatakan bahwa atom terdiri atas inti atom dengan elektron yang berputar mengelilinginya dalam lintasan atau orbit yang dibayangkan seperti tata surya, dimana inti atom sebagai matahari dengan elektron-elektron sebagai planet yang berputar mengelilinginya.
b. Kelemahan Model Atom Rutherford
Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
Model atom rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap inti atom.
Elektron memancarkan energi ketika bergerak, sehingga energi atom menjadi tidak stabil.
Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H)
5 | P a g e









![STRUKTUR ATOM - ashfar.staff.gunadarma.ac.idashfar.staff.gunadarma.ac.id/Downloads/files/50124/[KD_2016]_2... · MODEL ATOM DALTON Atom ialah bagian terkecil suatu zat yang tidak](https://static.fdokumen.com/doc/165x107/5ca134e888c993eb5d8bd6b0/struktur-atom-kd20162-model-atom-dalton-atom-ialah-bagian-terkecil-suatu.jpg)










