LAPORAN PENGARUH INHIBITOR DAN ENZIM.docx
-
Upload
keukeu-nurdianti -
Category
Documents
-
view
224 -
download
6
Transcript of LAPORAN PENGARUH INHIBITOR DAN ENZIM.docx
PENGARUH PH DAN INHIBITOR TERHADAP AKTIFITAS ENZIM
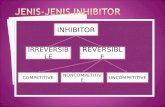
I. TUJUAN PERCOBAAN Dapat memahami pengaruh pH dan inhibitor terhadap aktivitas enzim.II. PRINSIP PERCOBAAN Enzim ptyalin (saliva amylase) dapat menghidrolisis amilum menjadi sakarida yang sederhana dan dekstrin. Pada awal hidrolisis warna amilum dengan iodine adalah biru, lambat laun warna itu berubah menjadi coklat merah dan akhirnya tidak berwarna sejalan dengan perubahan dekstrin yang dihasilkan. Satu jumlah larutan yang mengandung enzim tertentu yang dapat menghidrolisis 5 mL larutan amilum 1% dalam waktu 30 menit sampai mencapai titikakromik (tidak memberikan warna dengan iodine).III. TEORI DASAREnzim merupakan biokatalisator/katalisator organik yang diproduksi oleh makhluk hidup untuk mengkatalisis dan mengendalikan reaksi kimia yang penting dalam tubuh makhluk hidup tersebut. Berbeda dengan katalisator biasa, enzim mempunyai spesifisitas katalitik yang tinggi yang ditentukan oleh gugus fungsi pada situs aktifnya. Enzim hanya mengkatalisis reaksi secara termodinamika, yaitu berdasarkan pelepasan energi bebas. Katalisator ini terlibat dalam reaksi, tetapi kemudian kembali ke struktur asalnya.Enzim adalah sekelompok protein yang berperan sebagai pengkatalis dalam reaksi-reaksi biologis. Enzim dapat juga didefenisikan sebagai biokatalisator yang dihasilkan oleh jaringan yang berfungsi meningkatkan laju reaksi dalam jaringan itu sendiri. Semua enzim yang diketahui hingga kini hampir seluruhnya adalah protein.Berat molekul enzim pun sangat beraneka ragam, meliputi rentang yang sangat luas (Suhtanry & Rubianty, 1985). Enzim berperan untuk mempercepat reaksi kimia yang terjadi di dalam tubuh makhluk hidup, tetapi enzim itu sendiri tidak ikut bereaksi. Enzim berperan secara lebih spesifik dalam hal menentukan reaksi mana yang akan dipacu dibandingkan dengan katalisator anorganik sehingga ribuan reaksi dapat berlangsung dengan tidak menghasilkan produk sampingan yang beracun (Juryatin, 1997).Aktivitas enzim ternyata dipengaruhi banyak faktor. Faktor-faktor tersebut menentukan efektivitas kerja suatu enzim. Apabila faktor pendukung tersebut berada pada kondisi yang optimum, maka kerja enzim juga akan maksimal. Beberapa faktor yang mempengaruhi kerja enzim: 1. Substrat Enzim mempunyai spesifitas yang tinggi. Apabila substrat cocok dengan enzim maka kinerja enzim juga akan optimal. 1. pH (keasaman) Enzim mempunyai kesukaan pada pH tertentu. Ada enzim yang optimal kerjanya pada kondisi asam, namun ada juga yang optimal pada kondisi basa. Namun kebanyakan enzim bekerja optimal pada pH netral. 1. Waktu Waktu kontak/reaksi antara enzim dan substrat menentukan efektivitas kerja enzim. Semakin lama waktu reaksi maka kerja enzim juga akan semakin optimum.1. Konsentrasi / jumlah enzim Konsentrasi enzim berbanding lurus dengan efektivitas kerja enzim. Semakin tinggi konsentrasi maka kerja enzim akan semakin baik dan cepat. 1. Suhu Seperti juga pH. Semua enzim mempunyai kisaran suhu optimum untuk kerjanya.1. Produk Akhir Reaksi enzimatis selalu melibatkan 2 hal, yaitu substrat dan produk akhir. Dalam beberapa hal produk akhir ternyata dapat menurunkan produktivitas kerja enzim. Enzim tripsin memiliki pH optimum yang khas, yaitu pH yang menyebabkan aktivitas maksimal. Pemberi atau penerima proton yang penting pada sisi katalitik enzim berada dalam tingkat ionisasi yang diinginkan. pH optimum enzim tidak perlu sama dengan pH lingkungan normalnya, dengan pH yang mungkin sedikit berada diatas atau dibawah pH optimum. Aktivitas katalitik enzim didalam sel mungkin diatur sebagian oleh perubahan pada pH medium lingkungan. Enzim memiliki tenaga katalitik yang luar biasa dan biasanya lebih besar dari katalisator sintetik. Spesifitas enzim sangat tinggi terhadap substratnya. Tanpa pembentukan produk samping enzim merupakan unit fungsional untuk metabolisme dalam sel, bekerja menurut urutan yang teratur. Sistem enzim terkoordinasi dengan baik menghasilkan suatu hubungan yang harmonis diantara sejumlah aktivitas metabolic yang berbeda (Cartono,2004). Enzim dikatakan sebagai suatu kelompok protein yang berperan sangat penting dalam aktivitas biologis. Dalam jumlah yang sangat kecil, enzim dapat mengatur reaksi tertentu sehingga dalam keadaan normal tidak terjadi penyimpangan-penyimpangan hasil akhir reaksinya. Enzim ini akan kehilangan aktivitasnya akibat : Panas Asam atau basa kuat Pelarut organik Pengaruh lain yang bisa menyebabkan denaturasi protein(Campbell, 2000)Untuk aktivitasnya kadang-kadang enzim membutuhkan kofaktor yang bisa berupa senyawa organik atau logam. Senyawa organik itu terikat pada bagian protein enzim. Bila ikatan itu lemah maka kofaktor tadi disebut co-enzim dan dan jika terikat erat melalui ikatan kovalen maka dinamakan gugus prostetis. Pada umumnya dua kofaktor itu tidak dibedakan dan disebut co-enzim saja. Apabila enzim itu terdiri dari bagian seperti yang diterangkan diatas maka keseluruhan enzim itu dinamakan holo enzim. Bagian protein dinamakan apo-enzim dan bagian non proteinnya disebut co-enzim.fungsi logam pada umumnya adalah untuk memantapkan ikatan substrat pada enzim atau mentransfer electron yang timbul selama proses katalisis (Anna Poedjiadi, 1994).Aktivitas enzim juga berhubungan dengan keadaan ionik molekul terutama pada bagian proteinnya, karena rantai polipeptida mengandung kelompok-kelompok yang bisa mengion sampai ke satu tingkat yang tergantung pada pH yang ada. Seperti halnya yang berlaku pada protein umumnya. Enzim memiliki titik isoelektrik dengan muatan bebas bersihnya adalah nol. pH pada titik isoelektrik, sebagian patokan, berbeda dengan pH pada waktu aktivitas maksimal. pH optimal yang diperlihatkan pada tiap enzim berbeda-beda. Kebanyakan enzim menpunyai pH optimal antara 4-8, namun pada beberapa enzim yang bekerja baik pada daerah pH yang sempit. Jika enzim diberi pada pH yang ekstrim maka akan terdenaturasi. Kepekan enzim terhadap perubahan suhu merupakan salah satu sebab mengapa pengaturan pH tubuh dilakukan dengan sangat cermat. (Mentgomery,Rex. 1993)Terdapat 2 jenis utama penghambat enzim yaitu Enzim yang bekerja secara tidak dapat balik (iireversible). Penghambat ini golongan yang bereaksi dengan atau merusakkan suatu gugus fungsional pada molekul enzim yang penting untuk proses katalitiknya. Contohnya adalah diisiprofilflourofosfat(DFP) yang menghambat enzim asetilkolinesterase Enzim yang bekerja secara dapat balik (reversible) Suatu penghambat kompetitif berlomba dengan substrat untuk berikatan dengan sisi aktif enzim. Cirinya yaitu penghambatan ini dapat dibalikkan atau diatasi dengan penambahan konsentrasi substrat.penghambatan kompetitif biasanya menyerupai substrat normal pada struktur tiga dimensinya. Karena persamaan ini, penghambatan kompetitif menipu enzim untuk berikatan dengannya. Sebenarnya penghambatan kompetitif ini dapat dianalisa secara kuatitatif dengan mertode michaellis-menten. Penghambat kompetitif hanya berikatan secara dapat balik dengan enzim membentuk suatu kompleks. E + I EIContohnya adalah penghambatan kompetitif dehidrogenase suksinat oleh anion malonat. dehidrogenase suksinat adalah anggota golongan enzim yang mengkatalisis siklus asam sitrat. Enzim ini mengkatalisis pembebasan dua atom hidrogen dari suksinat. Penghambat non kompetitif : penghambat berikatan pada sisi enzim selain sisi substrat berikatan. Mengubah konformasi molekul enzim, sehingga inaktifasi katalitiknya. Penghambat non kompetitif berikatan secara balik padda kedua molekul enzim bebas dan kompleks ES, membentuk kompleks EI dan ESI yang tidak aktif : E + I EIES + I ESI(Thenawijaya, maggy. 1982)Enzim digolongkan menurut reaksi yang diikutinya, sedangkan masingmasing enzim diberi nama menurut nama substratnya, misalnya urease, arginase dan lain-lain. Di samping itu ada pula beberapa enzim yang dikenal dengan nama lama misalnya pepsin, tripsin dan lain-lain. Oleh Commision on Enzymes of the International Union of Biochemistry, enzim dibagi dalam enam golongan besar. Penggolongan ini didasarkan atas reaksi kimia di mana enzim memegang peranan. Enam golongan tersebut ialah (Poedjiadi, 2006):a)Golongan I OksidoreduktaseEnzim yang ternasuk dalam golongan ini dapat dibagi dalam dua bagian yaitu dehidrogenase dan oksidase.b)Golongan II TransferaseEnzim yang termasuk golongan ini bekerja sebagai katalis pada reaksi pemindahan suatu gugus dari suatu senyawa kepada senyawa lain. Beberapa contoh enzim yang termasuk golongan ini adalah meeetiltransferase, hidroksimetiltransferase, karboksiltransferase, asiltransferase dan aminotrandferase atau disebut juga transminase (Anna Poedjiadi, 1994).c)Golongan III HidrolaseEnzim ini bekerja sebagai katalis pada reaksi hidrolisis. Beberapa enzim dalam kelompok ini ialah esterase, lipase, pofatase, amylase, aminopepetidase, karboksipeptidase, pepsin, tripsin, kimotripsin (Anna Poedjiadi, 1994).d)Golongan IV LiaseEnzim yang termasuk golongan ini mempunyai peranan penting dalam reaksi pemindahan suatu gugus dari satu substrat (bukan cara hidrolisis) atau sebaliknya. Contoh enzim golongan ini natara lain dekarboksilase, aldolase, hidratase.e)Golongan V IsomeraseEnzim yang termasuk golongan ini bekerja pada reaksi perubahan intramolekuler, misalnya rekasi perubahan glukosa menjadi fruktosa, perubahan senyawa L menjadi senyawa D, senyawa sis menjadi senyawa trans dan lain-lain. Contoh enzim yang termasuk golongan ini antara lain ribolosafosfat ipomerase dan glukosafosfat isomerase.f)Golongan VI LigaseEnzim yang termasuk golongan ini bekerja pada reaksi-reaksi penggabungan dua molekul. Oleh karenanya enzim tersebut juga dinamakan sintesa. Ikatan yang terbentuk anatara penggabungan tersebut adalah ikatan C-O, C-S, C-N atau C-C. contoh enzim golongan ini antara lain glutamine sintetase dan piruvat karboksilase.Enzim meningkatkan laju sehingga terbentuk kesetimbangan kimia antara produk dan pereaksi. Pada keadaaan kesetimbangan, istilah pereaksi dan produk tidaklah pasti dan bergantung pada pandangan kita. Dalam keadaan fisiologi yang normal, suatu enzim tidak mempengaruhi jumlah produk dan pereaksi yang sebenarnya dicapai tanpa kehadiran enzim. Jadi, jika keadaan kesetimbangan tidak menguntungkan bagi pembentukan senyawa, enzim tidak dapat mengubahnya (Salisbury, 1995). Sebagai mana protein pada umumnya, molekul enzim juga mempunyai struktur tiga dimensi. Diantaranya jenis-jenis struktur tersebut, hanya satu saja yang mendukung fungsi enzim sebagai biokatalisator, diantaranya jenis-jenis struktur tersebut, diperlukan suhu dan pH yang sesuai. Apabila kedua faktor tersebut tidak terpenuhi, enzim akan kehilangan sifat dan kemampuannya (Sadikin, 2002). Secara dingkat, sifat-sifat enzim tersebut antara lain (Dwidjoseputro, 1992) :1. Berfungsi sebagi biokatalisator2. Merupakan suatu protein3. Bersifat khusus atau spesifik4. Merupakan suatu koloid5. Jumlah yang dibutuhkan tidak terlalu banyak6. Tidak tahan panasFungsi enzim sebagai katalis untuk reaksi kimia dapat terjadi baik didalam maupun diluar sel. Suatu enzim bekerja secara khas terhadap suatu substrat tertentu. Suatu enzim dapat bekerja 108sampai 1011kali lebih cepat dibandingkan laju reaksi tanpa katalis. Enzim bekerja sebagai katalis dengan cara menurunkan energi aktifasi, sehingga laju reaksi meningkat (Poedjadi, 2006). Enzim-enzim hingga kini diketahui berupoa molekul-molekul besar yang berat molekulnya ribuan. Karena enzim tersebut dilarutkandalam air, maka akan menjadi suatu koloid Beberapa enzim, diketahui memiliki kemampuan untuk mengubah substrat menjadi hasil akhir dan sebaliknya, yaitu mengubah kembali hasil akhir menjadi substrat jika kondisi lingkungan berubah. dari golongan protease dan urase serta beberapa jenis enzim lainnya (Dwidjoseputro, 1992).
IV. ALAT DAN BAHAN1. Alat Batang pengaduk Pipet tetes Pipet ukur 1 mL; 5 mL; 10 mL Stopwatch Tabung reaksi Water bath 38
1. Bahan Aquadest Kloroform Larutan buffer pH 8 ; 7,4; 6,8; 6;5,2 Larutan amilum 1% Larutan natrium klorida 0.1 M Larutan saliva (1:9) Larutan iodine Larutan toluen Larutan merkuri klorat 1% Larutan phenol Natrium florida Pereaksi benedict
V. PROSEDUR PERCOBAAN1. Pengaruh pH terhadap aktivitas enzim Larutan buffer disiapkan sebanyak 5 mL dengan pH 8 ; 7,4; 6,8; 6;5,2 dalam tabung reaksi yang terpisah. Kemudian ditambahkan 2,5 mL larutan amilum 1 %, 1 mL Natrium klorida 0,1 M dan 1 mL larutan saliva (1:9) pada tiap tabung reaksi. Lalu ditempatkan didalam waterbath 38 C. Setelah itu ditambahkan larutan iodine 2 tetes dan diaduk. Kemudian amati perubahan yang terjadi dan di inkubasikan pada waterbath 38 C hingga warna biru menghilang dan dicatat waktunya pada tiap tabung.
1. Pengaruh inhibitor tehadap aktivitas enzim 1 mL Larutan saliva (2:8) dimasukkan kedalam 6 buah tabung reaksi. Kemudian ditambahkan pada tabung yang terpisah yaitu 5 tetes larutan toluen, 5 tetes kloroform, 5 tetes larutan merkuri klorida 1%, 5 tetes larutan phenol 2 %, 0,5 g natrium florida, dan 5 tetes aquadest. Diamkan selama 10 menit dengan sesekali digojog. Kemudian ditambahkan 5 mL larutan amilum 1 % pada tiap tabung dan didiamkan pada waterbath 38 C selama 15 menit. Lalu bagi masing masing tabung menjadi dua bagian untuk dilakukan test iodine dan test benedict. Diamati yang terjadi.VI. DATA PENGAMATANNAMA PERCOBAANPROSEDURHASIL PENGAMATANGAMBAR
Pengaruh pH terhadap aktivitas enzim5 mL larutan buffer pH 8+ 5mL larutan amylum 1mL+ Natrium klorida 0,1 M + 1 mL saliva+ disimpan dalam water bath 38C+ asam asetat+ iodine 2 tetesDari biru menjadi bening 30 menit
5 mL larutan buffer pH 7,4+ 5mL larutan amylum 1mL+ Natrium klorida 0,1 M + 1 mL saliva+ disimpan dalam water bath 38C+ asam asetat+ iodine 2 tetesDari biru menjadi bening 29 menit
5 mL larutan buffer pH 6.8+ 5mL larutan amylum 1mL+ Natrium klorida 0,1 M + 1 mL saliva+ disimpan dalam water bath 38C+ iodine 2 tetesDari biru menjadi bening 31 menit
5 mL larutan buffer pH 6+ 5mL larutan amylum 1mL+ Natrium klorida 0,1 M + 1 mL saliva+ disimpan dalam water bath 38C+ iodine 2 tetesDari biru menjadi bening 32 menit
5 mL larutan buffer pH 5,2+ 5mL larutan amylum 1mL+ Natrium klorida 0,1 M + 1 mL saliva+ disimpan dalam water bath 38C+ iodine 2 tetesDari biru menjadi bening 33 menit
Pengaruh inhibitor terhadap aktivitas enzim1mL saliva+ 5 tetes toluen+ simpan 10 menit+ 5 mL larutan amylum 1%+ diamkan dalam water bath, 15 menit+ uji iodine dan benedictUji Iodine : warna larutan abu-abu endapan sedikitUji benedict : Biru muda
1mL saliva+ 5 tetes kloroform + simpan 10 menit+ 5 mL larutan amylum 1%+ diamkan dalam water bath, 15 menit+ uji iodine dan benedictUji Iodine : warna larutan hitam terdapat endapanUji benedict : Biru muda
1mL saliva+ 5 tetes mercuri klorida 1%+ simpan 10 menit+ 5 mL larutan amylum 1%+ diamkan dalam water bath, 15 menit+ uji iodine dan benedictUji Iodine : warna larutan kecoklatan endapan hitam sedikitUji benedict : Biru muda
1mL saliva+ phenol 2%+ simpan 10 menit+ 5 mL larutan amylum 1%+ diamkan dalam water bath, 15 menit+ uji iodine dan benedictUji Iodine : warna larutan abu-abu endapan hitam banyakUji benedict : Biru muda
1mL saliva+ 0,5 gram Natrium Florida+ simpan 10 menit+ 5 mL larutan amylum 1%+ diamkan dalam water bath, 15 menit+ uji iodine dan benedictUji Iodine : warna larutan coklat endapan sangat banyakUji benedict : Biru muda
1mL saliva+ 5 aquades + simpan 10 menit+ 5 mL larutan amylum 1%+ diamkan dalam water bath, 15 menit+ uji iodine dan benedictUji Iodine : warna larutan abu-abu endapan hitam banyakUji benedict : Biru muda
VII. DAFTAR PUSTAKA Campbell, N. A. 2000. Biologi Edisi Kelima.Penerbit Erlangga. Jakarta. Cartono, M.Pd. 2004. Biologi Umum, Bandung : PRISMA PRESS. Dwidjoseputro, D., 1992,Pengantar Fisiologi Tumbuhan, Gramedia Pustaka Utama, Jakarta Juryatin. 1997. Peran Enzim Amilase pada Tubuh Manusia. http://www.docstoc.com. Diakses 10.6.2012. Montgomery,rex,dkk. 1993. Biokimia. Gadjah Mada University Press: Yogyakarta. Poedjiadi, Anna dan Supriyatin, Titin. 1994. Dasar-dasar Biokimia. Jakarta : Universitas Indonesia. Poedjiadi, Anna, 2006.Dasar-dasar Biokimia, Universitas Indonesia PRESS,Jakarta. Sadikin M. 2002. Seri biokimia: biokimia enzim.Widya Medika. Jakarta. Salisbury, F.B. dan Ross, C.W., 1995,Fisiologi Tumbuhan Jilid 2, ITB Press, Bandung Suhtanry, Rubianty, 1985.Kimia Pangan. Badan Kerja Sama Perguruan Negeri Indonesia Bagian Timur, Makassar. Thenawidjaja,Dr. Ir. Maggy. 1982. Lehninger : Dasar Dasar Biokimia. Erlangga : Jakarta.