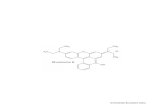
TUGAS JURNAL KUANTI
-
Upload
dessy-noorlia -
Category
Documents
-
view
89 -
download
6
Transcript of TUGAS JURNAL KUANTI

Nama: Dessy Noorlia
NIM: J0B111229
ASIDI ALKALIMETRI
Asidi alkalimetri termasuk reaksi netralisasi yakni reaksi antara ion hidrogen
yang berasal dari asam dengan ion hidroksida yang berasal dari basa untuk
menghasilkan air yang bersifat netral. Netralisasi juga dapat dikatakan sebagai reaksi
antara pemberi proton (asam) dengan penerima proton.
Asidimetri merupakan penetapan kadar secara kuantitatif terhadap senyawa-
senyawa yang bersifat basa dengan menggunakan baku asam. Sebaliknya, alkalimetri
merupakan penetapan kadar senyawa-senyawa yang bersifat asam dengan
menggunakan baku basa. Keasaman permukaan merupakan jumlah asam total (asam
Brønsted dan asam Lewis) pada permukaan padatan yang dinyatakan sebagai jumlah
milimol asam perberat sampel.
Suatu titrasi yang ideal adalah jika titik akhir titrasi sama dengan titik ekivalen
teoritis. Dalam kenyataannya selalu ada perbedaan kecil. Beda ini disebut dengan
kesalahan titrasi yang dinyatakan dengan mililiter larutan baku. Oleh karena itu,
pemilihan indikator harus dilakukan sedemikian rupa agar kesalahan ini sekecil-
kecilnya. Dalam larutan, kadar bahan yang terlarut (solut) dinyatakan dengan
konsentrasi.
Pada analisis titrimetri atau volumetrik, untuk mengetahui saat reaksi
sempurna dapat dipergunakan suatu zat yang disebut indikator. Indikator umumnya
adalah senyawa yang berwarna, dimana senyawa tersebut akan berubah warnanya
dengan adanya perubahan pH. Indikator dapat menanggapi munculnya kelebihan
titran dengan adanya perubahan warna.
Dalam proses titrasi, untuk mengetahui kemolaran asam (titran) dapat
diketahui setelah mengetahui volume titrat yang berkurang sampai proses akhir
titrasi. Pada saat itu, mol asam dan mol basa sama, sehingga kemolaran titrat dapat
dicari.

Titik ekivalen yaitu pH pada saat asam basa tepat ekivalen atau secara
stoikiometri tepat habis bereaksi. Titik ekivalen ini merupakan suatu kondisi dimana
terdapat kesetaraan mol titrat dengan mol titran. Pada saat tercapai titik ekivalen,
proses titrasi dihentikan kemudian kita mencatat volume titran yang diperlukan untuk
mencapai keadaan tersebut. Titik akhir titrasi yaitu pH pada saat indikator berubah
warna.