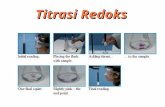
Titrasi Redoks
-
Upload
tri-dewi-yuliani -
Category
Documents
-
view
385 -
download
26
Transcript of Titrasi Redoks

Titrasi Redoks

Oksidasi adalah proses pemanbahan oksigen atau pengurangan hidrogen
Reduksi adalah proses penambahan hidrogen atau pengurangan oksigen
Oksidasi dan reduksi terjadi secara simultan dalam suatu reaksi, tidak bisa berdiri sendiri-sendiri,
Reaksi oksidasi yang kuantitaif (sempurna) dapat dipakai sebagai dasar penuntun volumetri, oksidator yang dipakai dalam volumetri adalah:
• KMnO4
• K2Cr2O7
• I2
• KIO3
• KbrO3
• Ce(SO4)3

Permanganometri
Reaksi yang terjadi sangat tergantung pada pH sistem
• Dalam keadaan asam kuatMnO4
- + 8H+ + 5e → Mn2+ + 4H2O EO = 1.51 V• Dalam keadaan netralMnO4
- + 4H+ + 3e → MnO2 + 2H2O EO = 1.67 V• Dalam keadaan basa kuatMnO4
- + e → MnO4-2 EO = 0.54 V

Faktor pH penting untuk menentukan stabilitas larutan baku permanganat, stabilitas maksimum dalam suasana netral.
Adanya MnO2 dapat mempercepat penguraian KMnO 4 dengan pembentukan lebih banyak MnO2.
Mn2+ + MnO4- ↔ MnO2 + Mn2+ terjadi dalam sistem
basa/netral.Indikator: KMnO4
Ta ditunjukan:• Warna rosaMemakai indikator Ferroin (o – Fenantrolin – FeSO4) yang
dalam bentuk reduksi merah jingga muda, bentuk oksidasi biru muda langit.
Bisa digunakan untuk penentuan asam oksalat dan garamnya, jarang untuk senyawa obat.

IODIMETRITitrasi langsung dengan I2
I2 + 2 e → 2 I-
I2 merupakan oksidator lemah jika dibandingkan dengan KMnO4 dan
hanya beberapa yang biasa dititrasi langsung dengan I2-
I2 sukar larut dalam air sehingga biasanya untuk membuat larutannya harus dilarutkan dalam KI Jenuh yang aka menghasilkan ion triodida.
I2 + I- → I3
Ion triodida (lar air)Penambahan KI juga dapat memperkecil pengupan I2
TA dapat dilihat tanpa indikator dengan melihat warna I2 (kuning muda), tetapi kadang sulit menentukan TA sehingga digunakan indikator spesifik amilun dengan adanya I- akan mengabsorpsi I2 membentuk komplek warna biru (jika tidak ada I- tidak akan ada warna biru).

Indikator lain:• Pelarut organik CHCl3 atau CCl4 yang tidak larut
air dan Bj-nya > air sehingga akan berada dibawah.
• CHCl3/CCl4 lebih mudah melarutkan I2 sehingga I2 lebih banyak terdistribusi dalam CHCl3/CCl4
membentuk warna violet.• CHCl3/CCl4 dapat dipakai dalam suasana asam
kuat, tidak dapat dipakai amilum karena akan tercapai terurai menjadi amilopektin dan amilosa (tidak akan terjadi warna biru).

Contoh senyawa obat yang dapat ditentukan:
1. Titrasi Novalgin
CH3 C C
N
N
CH3
CH2 SO3Na
C
H3C NO
+ 2I2
CH3 C C
N
N
CH3
CH2 SO3Na
C
H3C NO
I I

Titrasi harus dilakukan lambat, jika terlalu cepat dapat terjadi oksidasi :
─CH3─SO3Na → + NaHSO4 + 4HI
sulfonat tur as Karboksilat Na-bisulfit
Dapat juga dilakukan titrasi tidak langsung
CH3
N C
O
OH

2. Titrasi Koffein
Koffein Koffein tetraiodida
Titrasi koffein secara tidak langsung: kelebihan I2 ditirasi kembali dengan Na2S2O3
2S2O3 + I2 → S4O6 + 2I-
IO3- + 5I- + 6H+ → 3I- + 3H2O
C
N
N
O
CH
H3C
CH3C
HC
O
N
N
CH3
CH
+ 2I2C
N
N
O
C
H3C
CH3C
C
O
N
N
CH3
CH
I II
I

Catatan:I2 yang ditambhakan harus dalam batas tertentu
sehingga larutan Na2S2O3 0.1N yang ditambahkan diantara 4,5 – 6 mL (kelebihan I2 yang dipakai ± 0,01N) karena jika tidak seperti ini:
jika I2 kurang cukup (Na2S2O3 0,1N < 4,5 mL) addisi bisa diodida (tidak sempurna)
jika > 6 mL dapat terjadi pentaiodida atau lebih

3. Penentuan kadar senyawa tiol (-SH) R─SH + I2 → R─S─S─R + 2HI
Contoh : Dimerkarpol
CH SH
H2C
H2C
SH
OH
+ I2 HC S
H2C
CH3
S S
S
CH2
CH
CH3
+ 4HI

4. Penentuan kadar senyawa hidrokuinon
C6H4(OH)2 + I2 → C6H4O2 + 2I- + 2H2
Hidrokuinon Kuinon OH
OH
O
O

5. Titrasi Benzilpisilin• Hidrolisa dengan NaOH → asam penisiloat/penisilat• Hidrolisa lagi dengan asam → depisilin + asam benzepenilat• Asam benzepanilat akan teroksidasi oleh I2 → senyawa disulpida
HC
S
HC(H3C)2 C ONa
O
NH
O
NHCOCH2C6H5
NaOH HC
S
HC(H3C)2 C ONa
O
NH
COOHH
NHCOCH2C6H5
HC
SH
HC(H3C)2 C OH
O
NH2
H+
I2
HC
S
HC(H3C)2 C OH
O
NH2
S
H2C
HC(H3C)2 C OH
O
NH2

6. Titrasi Vitamin C
Vitamin C dehidro vitamin C
C
O
HC OH
HC
HC
OH
HC OH
H2C OH
O
+ I2
C
O
C O
C
HC
O
HC OH
H2C OH
O
+ 4HI

Aplikasi Penentuan Iodometri1. Penentuan angka Iod dalam minyakAngka Iod adalah berat I2 yang diadsorpsi oleh 100
bagian berat minyak dan merupakan ukuran senyawa tidak jenuh dalam minyak tersebut.
Penentuan didasarkan adanya adisi halogen pada ikatan rangkap (─C═C─)
Reaksi dengan I2 lambat maka sebagai reagen dipakai iodium monoklorida (ICI) atau Br2 didalam piridin.
+ ICI →
C CC C
I Cl

Kemudian ICI berlebih diubah menjadi I2 dengan penambahan KI dititrasi dengan S2O3
I- + ICI → I2 + Cl-
+ Br2 dalam piridin → + Br- + piridin
Br- + →
C C C C+
Br
C C+
Br
C C
Br
Br

Kelebihan Br2 + KI → IBr + Br-
I- + IBr → I2 + Br-
I2 + S2O32- → S4O6
2- + I-
Tahap-tahap titrasi Iodometri:Karena I2 merupakan larutan baku sekunder,
sehinga harus dibakukan dengan S2O32- . S2O3
2-
harus dibakukan dengan K2Cr2O4 sehingga kemungkinan kesalahan besar sehingga dipilih baku primer KIO3
(Iodatometri).

IODATOMETRILarutan baku: KIO3 (oksidator kuat)
Contoh yang dapat dititrasi: • KI• Fenilhidrazin HCl (C6H5NHNH2HCl)
Susana asam lemahC6H5NHNH2HCl + 2HIO3 → 3 C6H5OH + 3N2 + 3H2O + 2HI
2HI + 3HCl + HIO3 → 3KCl + 3H2O + 3I2
Suasana asam kuatC6H5NHNH2 + 3HCl + 2HIO3 → 3 C6H5OH + 3ICl + 3N2 + 6H2O
Penenuan KI secara iodatometri metode ANDREWSZat + HCl pekat dititrasi dengan KIO3
2I- + IO3- + HCl → 3 ICI + H2O + 3Cl-
indikator : CCl4/ CHCl3

BROMOMETRI DAN BROMATOMETRIBromometri: larutan baku Br2 sebagai pereaksi
(seperti I2)
Bromatometri: larutan baku KBrO3
Bromometri tidak pernah dilakukan titrasi langsung dengan Br2 untuk senyawa obat tetapi sering dilakukan titrasi tidak langsung
• Ditambahkan Br2 berlebih dalam sistem larutan asam
• Tambahkan KI, diamkan beberapa waktu (5 – 15’)• Br2 yang terjadi titrasi kembali dengan S2 O3
2-

Penggunaan Br2 sebagai reagen sudah berkurang karena mudah menguap sehingga selama titrasi normalitas selalu berubah sehingga Br2 dibuat segar (r.p : recenter paratus) dalam pelarutnya dengan penambahan KBrO3 dan KBr2 , sehingga diperoleh Br2 yang langsung bereaksi dengan sampelnya sehingga tidak menguap.
Metode bromatometri merupakan titrasi langsung dengan KBrO3
Keuntungan : KBrO3 merupakan baku primer

Tipe-tipe reaksi yang terjadi dalam brometri dan bromatomeri:1. Reaksi Subtitusi• Untuk senyawa fenol dan turunanya• Untuk senyawa amin aromatis dan turunannya
2. Reaksi Adisi
Terjadi pada senyawa obat yang mengandung gugus tidak jenuh (titrasi langsung)
Br
│
─C─C═C─C─ + Br2 ↔ ─C ─C ─C ─C ─
│
Br
OH
+ 3 Br
OH
Br Br
Br
+ 4HBr

3. Reaksi OksidasiTerjadi pada senyawa obat dengan gugus fungsi yang
mudah dioksidasi, misalnya Vitamin C, Isoniazid.
Tur asam karboksilat
N
C
O
HN NH2
+ Oksidatot
N
C
O
OH
+ N2 + H2

Cara Titrasi:1. Titrasi langsung dengan KBrO3 (Metoda Wojahn)
Sampel dalam air + HCl + KBr panaskan → titrasi dengan KBrO3
Indikator23: metil merah (sebetulnya merupakan indikator asam basa), merupakan indikator redoks destruktif dan irreversibel.
tidak berwarna
C O-
O
HN N N
CH3
CH3
+ Br2 + 2H2O
C O-
O
OH + N
CH3
CH3
HO + N2 + 2HBr

Metil red dirusak/terdestrusi oleh Br2 → tidak berwarna
Indikator lain : jingga metil Dapat juga dipakai indikator redoks biasa yang reversibel,
contoh: α – naftolflavon dari hijau daun → coklat seperti karat p – etoksikrisoidin HCl dari merah → kuning kuinolin kuning dari kuning → tidak berwarna
2. Titrasi tidak langsunga. Sampel + KBr + KBrO3 + HCl, diamkan 5-15 menit + KI →I2. I2
yang terbebtuk titrasi dengan Na2S2O3
b. sampel + HCl + KBrO3 + HCl + Na-arsenit (Na2AsO3), kocok sampai endapan larut, titrasi dengan KBrO3 dengan indikator metil merah

Contoh senyawa obat yang ditirasi dengan cara ini:1. Novakain (Prokain HCl)
Hasil reaksi Novakain dengan Br2 memberikan reaksi yang mengendap sehingga tidak dititrasi secara langsung karena yang mengendap akan mengabsorpsi indikator sehingga dipakai cara nomor b (ditambah Na2AsO3)
Na2AsO3 + KBrO3 berlebih + HCl → KBr + Na3AsO4 + 3 H2O
NH2
C
O
O (CH2)2-n(C2H5)HCl
+ Br2
NH2
C
O
O (CH2)2-n(C2H5)HCl
Br2 Br2
+ 2HBr

Benzokain (Anestesin)
NH2
C
O
O C2H5
+ Br2
NH2
C
O
O C2H5
Br2 Br2
+ 2HBr

Macam-macam indikator yang biasa digunakan: Metil orange : merah – kuning Metil red : pink – tak berwarna Naftol – blue back : Bordeaux : merah tua – tak berwarna Fuchsin : merah kuning – tak
berwarna Quinolin Yellow : kuning – tak berwarna Amilum : biru – tak berwarna

Zat – zat yang dapat ditentukan secara bromometri:
a. Tak langsung• Procain HCl• Fenol• Anesthesin• Resorsin• INH• Asam Salisilat
b. Langsung• Fenol• Resorcin• INH
Catatan :
Khusus untuk INH dengan bromometri langsung, menggunakan indikator metil red akan terjadi endapan gelatinous sehingga menggangu TA karena endapan menyerap indikator sehingga ditambahkan arsenik supaya terjadi kompleks yang larut.

SERIMETRISerium dapat berada dalam 2 tingkat oksidasi, yaitu
+4 dan +3. dalam tingkat oksidasi +4 merupakan oksidator kuat,
Ce4+ + e ↔ Ce3+ Ion seri sebagai pentitrasi biasanya digunakan
dalam larutan asam kuat karena dalam larutan asam lemah akan mengalami hidrolisis.

Keuntungan senyawa seri sebagai oksidator adalah:1. Hanya ada satu tingkat valensi yaitu ion seri (III) (Ce3+), pada waktu
ion seri (IV) direduksi, hingga stiokiometri tertentu dan sederhana.2. Merupakan oksidator kuat dan intensitas daya oksidasi dapat
diubah dengan pemilihan asam yang digunakan.3. Larutan asam sulfat ion seri (IV) adalah sangat stabil dan dapat
disimpan lama tanpa mengalami perubahan konsentrasi. Larutan dalam asam nitrit atau asam perklorat terurai lambat.
4. Ion klorida dalam konsentrasi sedang, tidak langsung teroksidasi walaupun dengan adanya besi. Larutan seri dalam asam klorida tidak stabil jika konsentrasi asamnya lebih dari 1N.
5. Walaupun ion seri (IV) berwarna kuning, warna ini tidak menyebabkan keukaran pada pembacaan buret, terkecuali jika konsentrasinya lebih besar dari 0,1 N ion besi (III) tidak berwarna.