tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
-
Upload
yudo-prabowo -
Category
Documents
-
view
237 -
download
3
Transcript of tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
1/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 1
SIE. PEND. FARMAKOLOGI DAN BIOKIMIA
(deFarbion)
deFarbions Crew
1. Ryan Arifin 6. Henry Hadianto2. Edina Theodora S. 7. Qory Irsan3. Eric Gibson 8. M. Arif Tri Hapsoro
4.
Mulyadi 9. Tajul Anshor F.H5. Edi Kurnawan
Kul Biokimia :1. K. PENGATURAN KESEIMBANGAN ASAM BASA
(dr. Virhan)
2. K. LARUTAN DAPAR (dr. Virhan)
3. K. KETIDAKSEIMBANGAN ELEKTROLIT DAN
CAIRAN (dr. Andriani)
Kul. Farmakologi :1. QUINOLONES AND URINARY TRACT
ANTISEPTICS (dr. Iit)
F KULT S KEDOKTER N UNIVERSIT S T NJUNGPUR
(Slide 1-11)PH
pH adalah derajat keasaman yang digunakan untuk
menyatakan tingkat keasaman atau kebasaan yang dimiliki
oleh suatu larutan. Ia didefinisikan sebagai kologaritma
aktivitas ion hidrogen (H+) yang terlarut. Koefisien aktivitas
ion hidrogen tidak dapat diukur secara eksperimental,
sehingga nilainya didasarkan pada perhitungan teoritis. Skala
pH bukanlah skala absolut. Ia bersifat relatif terhadap
sekumpulan larutan standar yang pH-nya ditentukan
berdasarkan persetujuan internasional.
Konsep pH pertama kali diperkenalkan oleh kimiawan
Denmark Sren Peder Lauritz Srensen pada tahun 1909.
Tidaklah diketahui dengan pasti makna singkatan "p" pada
"pH". Beberapa rujukan mengisyaratkan bahwa pberasal dari
singkatan untuk powerp (pangkat), yang lainnya merujuk kata
bahasa Jerman Potenz(yang juga berarti pangkat), dan ada
KULIAH BIOKIMIA (dr. Virhan)
PENGATURAN KESEIMBANGAN ASAM BASA
http://id.wikipedia.org/wiki/Asamhttp://id.wikipedia.org/wiki/Basahttp://id.wikipedia.org/wiki/Larutanhttp://id.wikipedia.org/w/index.php?title=Kologaritma&action=edit&redlink=1http://id.wikipedia.org/w/index.php?title=Aktivitas_%28kimia%29&action=edit&redlink=1http://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/w/index.php?title=Koefisien_aktivitas&action=edit&redlink=1http://id.wikipedia.org/wiki/Kimiawanhttp://id.wikipedia.org/wiki/Denmarkhttp://id.wikipedia.org/w/index.php?title=S%C3%B8ren_Peder_Lauritz_S%C3%B8rensen&action=edit&redlink=1http://id.wikipedia.org/wiki/Bahasa_Jermanhttp://id.wikipedia.org/wiki/Bahasa_Jermanhttp://id.wikipedia.org/w/index.php?title=S%C3%B8ren_Peder_Lauritz_S%C3%B8rensen&action=edit&redlink=1http://id.wikipedia.org/wiki/Denmarkhttp://id.wikipedia.org/wiki/Kimiawanhttp://id.wikipedia.org/w/index.php?title=Koefisien_aktivitas&action=edit&redlink=1http://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/w/index.php?title=Aktivitas_%28kimia%29&action=edit&redlink=1http://id.wikipedia.org/w/index.php?title=Kologaritma&action=edit&redlink=1http://id.wikipedia.org/wiki/Larutanhttp://id.wikipedia.org/wiki/Basahttp://id.wikipedia.org/wiki/Asam -
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
2/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 2
pula yang merujuk pada kata potential. Jens Norby
mempublikasikan sebuah karya ilmiah pada tahun 2000 yang
berargumen bahwa p adalah sebuah tetapan yang berarti
"logaritma negatif"
Air murni bersifat netral, dengan pH-nya pada suhu 25 C
ditetapkan sebagai 7,0. Larutan dengan pH kurang daripada
tujuh disebut bersifat asam, dan larutan dengan pH lebih
daripada tujuh dikatakan bersifat basa atau alkali.
Pengukuran pH sangatlah penting dalam bidang yang terkait
dengan kehidupan atau industri pengolahan kimia seperti
kimia, biologi, kedokteran,pertanian, ilmu pangan, rekayasa
(keteknikan), dan oseanografi. Tentu saja bidang-bidang
sains dan teknologi lainnya juga memakai meskipun dalam
frekuensi yang lebih rendah.
pH didefinisikan sebagai minus logaritma dari aktivitas ion
hidrogen dalam larutan berpelarut air. pH merupakan
kuantitas tak berdimensi.
dengan aHadalah aktivitas ion hidrogen.Alasan penggunaan
definisi ini adalah bahwa aH dapat diukur secara
eksperimental menggunakan elektrode ion selektif yang
merespon terhadap aktivitas ion hidrogen ion. pH umumnyadiukur menggunakan elektrode gelas yang mengukur
perbedaan potensial Eantara elektrode yang sensitif dengan
aktivitas ion hidrogen dengan elektrode referensi.
http://id.wikipedia.org/wiki/Logaritmahttp://id.wikipedia.org/w/index.php?title=Air_murni&action=edit&redlink=1http://id.wikipedia.org/wiki/Asamhttp://id.wikipedia.org/wiki/Basahttp://id.wikipedia.org/wiki/Alkalihttp://id.wikipedia.org/wiki/Kimiahttp://id.wikipedia.org/wiki/Biologihttp://id.wikipedia.org/wiki/Kedokteranhttp://id.wikipedia.org/wiki/Pertanianhttp://id.wikipedia.org/w/index.php?title=Ilmu_pangan&action=edit&redlink=1http://id.wikipedia.org/wiki/Rekayasahttp://id.wikipedia.org/wiki/Oseanografihttp://id.wikipedia.org/wiki/Logaritmahttp://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/wiki/Dimensihttp://id.wikipedia.org/w/index.php?title=Aktivitas_%28kimia%29&action=edit&redlink=1http://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/w/index.php?title=Elektrode_gelas&action=edit&redlink=1http://id.wikipedia.org/w/index.php?title=Elektrode_gelas&action=edit&redlink=1http://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/w/index.php?title=Aktivitas_%28kimia%29&action=edit&redlink=1http://id.wikipedia.org/wiki/Dimensihttp://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/wiki/Ion_hidrogenhttp://id.wikipedia.org/wiki/Logaritmahttp://id.wikipedia.org/wiki/Oseanografihttp://id.wikipedia.org/wiki/Rekayasahttp://id.wikipedia.org/w/index.php?title=Ilmu_pangan&action=edit&redlink=1http://id.wikipedia.org/wiki/Pertanianhttp://id.wikipedia.org/wiki/Kedokteranhttp://id.wikipedia.org/wiki/Biologihttp://id.wikipedia.org/wiki/Kimiahttp://id.wikipedia.org/wiki/Alkalihttp://id.wikipedia.org/wiki/Basahttp://id.wikipedia.org/wiki/Asamhttp://id.wikipedia.org/w/index.php?title=Air_murni&action=edit&redlink=1http://id.wikipedia.org/wiki/Logaritma -
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
3/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 3
Asam adalah donor H+.
Basa adalah akseptor H+, atau memberikan OH- pd
larutan.
Asam dan Basa disebut:
Kuat bila terdisosiasi secara sempurna dalam
larutan, contoh:
HCl, NaOH
Lemah hanya sebagian terdisosiasi dalam
larutan, contoh:
Asam laktat, asam karbonat
Homeostasis pH dikontrol secara ketat
pH cairan ekstraseluler = 7.4
pH darah= 7.357.45
< 6.8 atau > 8.0 menyebabkan kematian
Asidosis (acidemia) < 7.35
Alkalosis (alkalemia) > 7.45
Ginjal mengatur pH, konsentrasi ion mineral, dan
komposisi air dalam darah. Ginjal mempertahankan pH
plasma darah pada kisaran 7,4 melalui pertukaran ion
hidronium dan hidroksil. Akibatnya, urine yang dihasilkan
dapat bersifat asam pada pH 5 atau alkalis pada pH 8.
Kadar ion natrium dikendalikan melalui sebuah proses
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
4/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 4
homeostasis yang melibatkan aldosteron untuk
meningkatkan penyerapan ion natrium pada tubulus
konvulasi. Kenaikan atau penurunan tekanan osmotik
darah karena kelebihan atau kekurangan air akan segeradideteksi olehhipotalamus yang akan memberi sinyal pada
kelenjar pituitari dengan umpan balik negatif. Kelenjar
pituitari mensekresihormon antidiuretik (vasopresin, untuk
menekan sekresi air) sehingga terjadi perubahan tingkat
absorpsi air pada tubulus ginjal. Akibatnya konsentrasi
cairan jaringan akan kembali menjadi 98%.
Asam yang dihasilkan oleh tubuh:
1.Asam karbonat
2.Asam sulfat
3.Asam fosfat
4.Asam laktat
5.Asam sitrat
6. Ion amonium
7. Benda keton :
- Asam asetoasetat
- -hidroksi butirat
- Aseton
(slide 12-21)
Nah, asam yang dihasilkan oleh tubuh kita bisa dibagi jadi 3
kelompok nih :
a.Asam VolatilAsam volatil adalah asam yang dapat menguap,
contohnya kayak H2CO3 (asam karbonat). Nah, di
tubuh kita hampir semua CO2 nantinya akan diubah
menjadi asam karbonat. Tekanan CO2 ini berhubungan
http://id.wikipedia.org/wiki/Aldosteronhttp://id.wikipedia.org/wiki/Hipotalamushttp://id.wikipedia.org/wiki/Kelenjar_pituitarihttp://id.wikipedia.org/w/index.php?title=Hormon_antidiuretik&action=edit&redlink=1http://id.wikipedia.org/w/index.php?title=Hormon_antidiuretik&action=edit&redlink=1http://id.wikipedia.org/wiki/Kelenjar_pituitarihttp://id.wikipedia.org/wiki/Hipotalamushttp://id.wikipedia.org/wiki/Aldosteron -
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
5/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 5
terbalik dengan pH, sehingga tekanan CO2merupakan
faktor penting yang akan mempengaruhi pH tubuh.
b.Asam FixedAsam fixed adalah asam yang tidak terpisahkandengan larutan(biar gampang hapalnya, ingat aja
kalo asam ini udah fixedjadi asam ini udah tetap ke
satu hati aja yaitu si larutan makanya yang bedua ini
udah lengket banget dan tak terpisahkan :P)
contohnya H2SO4 dan H2PO4.
c.Asam OrganikAsam organik adalah asam hasil metabolisme
anaerob, contohnya si asam laktat.
SISTEM PENGATURAN KESEIMBANGAN ASAM-BASA
Gimana sih cara tubuh kita mempertahankan keseimbangan
asam-basa nya? Nah, ternyata semua itu bisa diatur dengan
cara mengatur keseimbangan ion hidrogen (H+).
Keseimbangan ini dikoordinasi oleh 3 sistem, yaitu paru,
ginjal, dan bufferyang masing-masing akan bekerja dalam
waktu yang berbeda.
a. Pengaturan Jangka PanjangProses yang terjadi disini adalah proses eliminasi,
bukan netralisasi kayak di buffer. Organ yang
berperan : Paru : mekanisme koreksinya dengan cara
mengatur kecepatan frekuensi pernapasan, nah
mekanisme ini butuh waktu beberapa menit
sampai jam.
Ginjal : mekanisme koreksinya dengan cara
mengatur keseimbangan asam-basa dengan
cara mengatur sekresi dan reabsorbsi dari H+
dan HCO3-. Mekanisme ini butuh waktu
beberapa jam sampai hari.
b. Pengaturan Jangka PendekMekanisme ini diatur oleh sistem buffer dalam bentuk
buffer bikarbonat, fosfat, dan protein yang akan
segera beraksi hampir seketika (instan) sampai
beberapa detik. Bagannya seperti ini :
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
6/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 6
1. Mekanisme ParuTugas paru disini adalah mengatur frekuensi
pernapasan atau yang kerennya disebut respiratory
rate(RR).
a.
Kalo tubuh sedang dalam keadaaan asidosis
metabolik (pH darah turun), respon paru adalah
mengurangi H2CO3 dalam darah dengan
meningkatkan RR sehingga akan lebih banyak
CO2 yang keluar melalui paru.
b. Kebalikannya kalo tubuh lagi alkalosis metabolik
(pH darah naik), respon paru adalah menurunkanRR sehingga CO2 ditahan dalam paru. Akibatnya,
pH darah bakalan turun.
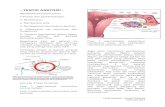
Penjelasan dari Gambar Kerja Paru dalam
Mempertahankan pH Darah
Ini slide maksudnya gambar paru loh yaa.. Nah, reaksi
metabolik sel akan menghasilkan ion H+kemudian dilepaskan
ke dalam darah, terjadilah kelimpahan ion H+ dalam darah.
Ion H+ini akan bereaksi dengan HCO3-membentuk H2CO3.
Lalu H2CO3 dibawa darah menuju ke kapiler paru dan
diuraikan menjadi H2O dan CO2. Si CO2akan dilepaskan ke
lingkungan luar melalui paru sedangkan H2O nya tetap berada
di dalam tubuh.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
7/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 7
Hubungan antara PCO2 dan pH Darah
Ketika tekanan CO2 meningkat, terjadilah penurunan
pH darah (akibat CO2 + H2O H2CO3) yang dapat
mengakibatkan asidosis. Tubuh akan berhomeostatis dengan
cara meningkatkan pH darah sehingga darahnya menjadi
lebih basa.
Mekanisme yang kebalikannya terjadi ketika tekanan
CO2menurun dengan drastis, terjadilah peningkatan pH darah
yang dapat menyebabkan alkalosis. Tubuh akan
berhomeostatis dengan cara menurunkan pH darah sehingga
menjadi lebih asam.
2. Mekanisme GinjalGinjal yang jadi topik utama di modul kita sekarang ini
juga punya peranan penting loh untuk ngatur keseimbangan
asam basa karena si ginjal ini merupakan regulator pH
yang efektif. Caranya gimana dong? Nah, tugas ginjal
adalah mengatur sekresi, ekskresi, dan reabsorbsi H+
juga mengatur sekresi dan reabsorbsi dari HCO3-,
makanya kalo ginjal gagal dalam tugas pentingnya ini,
homeostasis pH dalam tubuh kita bakalan gagal. Mekanisme
pengaturan oleh ginjal adalah dengan cara memproduksi
amonia, buffer asam karbonat/bikarbonat, dan buffer
fosfat.
(Slide 22-32)
Mekanisme pengaturanoleh ginjal kan ada 3, yaitu
dengan cara produksi ammonia, produksi buffer asam
karbonat/bikarbonat dan buferfosfat. Kita lihat satu persatu
yaaaa,,,,,.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
8/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 8
1.AmoniaGinjal berfungsi sebagai sumber utama amoniaurin.
Amonia (NH3) merupakan hasil deaminasi asam amino
glutamine (C5H10N2O3) dan reaksinya dikatalisis olehenzim glutaminase.
Amonia selanjutnya berikatan dengan H+ hasil
metabolism membentuk ion ammonium (NH4+) dan
diekskresikan bersama urin. Mekanisme ginjal
mengekskresikan proton (H+) yaitu ammonia berikatan
dengan H+ setelah berada di lumen tubulus distal,
tetapi dapat juga saat masih berada di dalam sel
tubulus distal.
Produksi amonia di tubulus distal yaitu sebagai berikut:2. Buffer asam karbonat/bikarbonat
Mekanisme ginjal untuk mempertahankan konsentrasi buffer
HCO3-dengan dua cara, yaitu:
HCO3- yang difiltrasi semuanya direabsorpsi di
tubulus proksimal.
HCO3-dibentuk lagi dalam tubulus distalis, untuk
menggantikan HCO3- yang dipakai oleh asam yang
H2O dan CO2 masuk ke sel tubulus distal
dan bereaksi dengan katalis karbonat anhydrase
membentuk asam karbonat (H2CO3). Karena ion
Na+ masuk ke tubulus distal, maka disertai
dengan pengeluaran ion H+ dari H2CO3 kefiltrate
tubular dan HCO3- masuk kedarah bersama Na+.
Karena di filtrate tubul ada ion H+ maka amonia
di tubulus distal keluar ke filtrate tubul secara
difusi dan berikatan dengan ion H+ membentuk
amonium. (ini semua dilakukan hanya untuk
menyeimbangkan keadaan asam-basa, so sweet
)(ini hanya berdasarkan gambar yaa,
sebenarnya prosesnya lebih kompleks).
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
9/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 9
tidak menguap (HCL, H3PO4, H2SO4 dan asam
organik) dalam darah hasil proses metabolisme.
Mobilisasi H+di tubulus proksimal yaitu seperti pada gambar
Sekresi H+ di tubulus proksimal
Terjadi proses yang sama dengan tubulus proksimal.
H+ dibentuk dari CO2 + H2O dan disekresi ke dalam lumen
tubulus ditukar dengan ion Na (Na+). Proses pertukaran
berlangsung sampai pH 4,5. Bila keadaan ini terjadi maka
sekresi H+terhenti oleh karena selisih H+filtrat dan sel tubulus
terlalu tinggi.
Kalo kita liat, reaksi pada tubulus proksimal ini
sama dengan tubulus distal, Cuma ada beberapa
perbedaan, yaitu disini yang berikatan dengan
H+ yaitu HCO3-yang ada di filtrate tubul dan
bukan ammonia dari tubulus. Setelah itu, ikatan
H2CO3 dipecah lagi menjadi H2O dan CO2 pada
filtrate tubul dan masuk ke dalam sel tubulus
distal, lalu bereaksi kembali membentuk H2CO3.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
10/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 10
Untuk mencegah tercapainya pH yang rendah dan
menjamin tersedianya HCO3-ada 2 mekanisme, yaitu:
a. Kerja buffer fosfat(HPO42-)
mekanismenya yaitu semua HCO3- diserap kembali dan H+
yang disekresi bereaksi dengan HPO42- membentuk H2PO4
-
akibat peningkatan keasaman urin atau penurunan pH urin.
b. Sekresi amonia oleh ginjal.
Dalam keadaan normal, setiap hari :
* 30-50 mEq H+ dibuang/diekskresi dengan cara
bergabung dengan amonia
* 10-30 mEq H+sebagai asam dititrasi oleh buffer fosfat
Ketidakseimbangan asam basa
Ketidakseimbangan asam basa dapat dibagi menjadi 2,yaitu pH bias kurang dari rentang normal dan bias lebih dari
rentang normal. Pada pH yang kurang dari 7.35, ini disebut
asidosis.Sedangkan pada pH yang lebih dari 7.45 disebut
alkalosis. Di dalam tubuh ada mekanisme atau respon untuk
menanggulangi ketidakseimbangan asam basa tersebut
(asidosis dan alkalosis), respon itu disebut kompensasi. Ada
2 sifat kompensasi, yaitu kompensasi sempurna dankompensasi parsial. Disebut kompensasi sempurna apabila pH
kembali kerentang normal, dan apabila pH berada di luar
rentang normal disebutkompensasi parsial.
Bila penyebab ketidakseimbangan dari metabolik, maka
dapat diatasi dengan kompensasi respiratorik dengan
hipo/hiperventilasi.Tetapi sebaliknya apabila penyebabnya
adalah respiratorik, dapat diatasi dengan kompensasi
metabolic oleh renal.
Respon terhadap penambahan H+(asidosis)
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
11/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 11
Respon terhadap Penambahan atau Pengurangan H+
Ok. Sambil lihat gambarnya ya
Yang ini saat terjadi Penambahan
Jadi intinya gini, ion H+ dalam tubuh akan dipake untuk 3
kejadian.
Pertama dia akan berikatan dengan karbonat membentuk
asam karbonat yang nantinya akan dipecah lagi menjadi CO2
dan H2O di paru (masing mempunyai tekanan dengan symbol
PH2O dan PCO2,tapi tekanan utama yang mempengaruhi pH
adalah PCO2), Kedua, ion H+ akan digunakan oleh system
buffer lain untuk menyeimbangkan pH dan ketiga, H+ juga
akan dieksresikan melalui ginjal. Nah, sehingga kalau terjadi
pengurangan ion H+akibat bernapas yang terlalu terburu-
buru (>>PCO2 ataupH,
and vice versa , ketika jumlah ion H+ bertambah akibat
bernapas yang terlalu lamber alias lama (pH)
makanya nanti akan ada respon pengurangan H+ (exactly like
in the picture below)
Berdasarkan gambar diatas, banyak sekali mekanisme yang
berperan untuk mengatasi masalah asidosis atau penambahan ion
H+ ini.Yang pertama cadangan bikarbonat (bufer) berikatan
dengan H+ membentuk asam karbonat lalu diubah menjadi H2O
dan CO2 kemudian dialirkan lewat darah dan dikeluarkan lewatpernapasan. Kemudian yang kedua ion H+ desekresi oleh ginjal
untuk berikatan dengan ion bikarbonat, selain itu kelebihan ion
H+ juga akan diserap oleh system buffer lain. Kompleks juga yaa,
.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
12/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 12
Kelainan-Kelainan Pengaturan Asam-Basa oleh Ginjal
Nah ,untuk menganalisis secara matematis mengenai
penjelasan buffer yang terdapat pada gambar di atas adalah
sebagai berikut.
PCO2 adalah tekanan dari gas CO2 dalam darah. Persamaan
di atas adalah alas an kenapa dapet langsung menggunakan
log [karbonat] per 0,03x PCO2, [asamkarbonat]
digantikanoleh [karbondioksida] karena [asamkarbonat]
dicerminkan oleh karbondioksida terlarut. Cara kerjanya
adalah dengan penambahan asam (peningkatan [H+]), akanterbentuk H2CO3 yang akan terurai menjadi air dan
karbondioksida, di mana karbondioksida selanjutnya akan
dieliminasi oleh paru.
GANGGUAN KESEIMBANGAN ASAM BASA
- pH darah adalah resultan 2 komponen: komponen
metabolik dan komponen respiratorik
- pH normal: 7.357.45
ASIDOSIS METABOLIK
Patogenesis :
- Produksi asam yg mningkat atau sekresi asam/H+ yg
mnurun byk asam d cairan tubuh ph turun.
- Khilangan ion bikarbonat pH turun.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
13/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 13
Kompensasi untuk menjaga homeostasis akibat pH yg
turun tsb, yakni :
- Kompensasi respiratorik :
hiperventilasi, yakni laju pernapasan naik (napas dalamdan cepat/kussmaul) yg berakibat PCO2menurun
(PCO2 mer. komponen respiratorik status asam basa.
Normal = 35 45 mmHg. Pada asidosis metabolik,
PCO2-nya meningkat akibat pH turun).
- Kompensasi renal :
meningkatkan sekresi asam, increased bicarbonate
generation
- Sistem buffer :
mengabsorbsi ion asam
ALKALOSIS METABOLIK
Etiologi :
- Kehilangan asam (muntah-muntah, drainase lambung)
-Kekurangan kalium yg berat
- Alkalosis posthiperkapnia
- Alkalosis kontraksi
- Sindroma kelebihan mineralokortikoid
- Pemberian alkali yg berlbhan
- Pengobatan diuretika
Patogenesis :- Byk bikarbonat ph naik.
- Khilangan ion asam pH naik.
Kompensasi untuk menjaga homeostasis akibat pH yg
naik tsb yakni :
- Kompensasi respiratorik :
hipoventilasi, yakni laju pernapasan turun yg berakibat
PCO2 meningkat (PCO2 mer. komponen respiratorik
status asam basa. Normal = 35 45 mmHg. Pada
asidosis metabolik, PCO2-nya menurun akibat pH naik).
- Kompensasi renal :
meningkatkan sekresi bikarbonat, increased acid
generation
-Sistem buffer :
mendonasikan ion asam
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
14/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 14
ASIDOSIS RESPIRATORIK
Etiologi :
-
Inhibisi pusat pernapasan : obat henti jantung, CentralSleep Apnea, kelebihan O2pada hiperkapnia kronik
- Penyakit neuromuskuler :
Neurologis: poliomielitis, sindroma Guillain Barre
Muskuler: hipokalemia, muskuler distrophy
-
Obstruksi jalan nafas : Asma bronkial, Penyakit ParuObstruktif Kronik (PPOK), Spasme laring, Aspirasi,
Obstructive sleep apnea
- Kelainan Restriktif :
Penyakit pleura : efusi pleura, empiema,
pneumothoraks, fibrothoraks
Kelainan dinding dada: kifoskoliosis
Kelainan restriktif paru: fibrosis pulmoner, pneumonia,
edema paru
- Mechanical underventilation
- Overfeeding
-
Patogenesis dan Kompensasinya
Produksi CO2> ekskresi CO2.
Hipoventilasi (PCO2 meningkat) menyebabkan asidosis
repiratorik dan stimulasi kemoreseptor arterial dan
cairan serebrospinal (yg trkhr ini bs diakibatkan oleh
asidosis respiratorik).
Untuk asidosis respiratorik ini, akan dikompensasi dgn
kompensasi renal (meningkatkan sekresi asam,
increased bicarbonate generation) dan sistem buffer
(mengabsorbsi ion asam).
Sedangkan arterial dan cairan serebrospinal yg
terstimulasi ini, akan dikompensasi dgn kompensasi
respiratorik (laju pernapasan naik yg berakibat PCO2
menurun).
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
15/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 15
ALKALOSIS RESPIRATORIK
Etiologi
- Rangsangan hipoksemik : peny paru dg kelainan A-a
gradien, peny jantung dg right to left shunt, peny
jantung dg edema paru, anemi gravis
- Stimulasi pusat pernapasan di medula : kelainan
neorologis, psikogenik mis. panik, nyeri, gagal hati dg
ensefalopati, kehamilan
-
Sepsis
- Pengaruh obat: salisilat, hormon progesteron
- Mechanical overventilation
Patogenesis dan Kompensasinya
Ekskresi CO2 melalui paru-paru berlebihan sehingga
pCO2
Hiperventilasi (PCO2 menurun) menyebabkan alkalosis
repiratorik dan inhibisi kemoreseptor arterial dan cairan
serebrospinal (yg trkhr ini bs diakibatkan oleh alkalosis
respiratorik).
Untuk alkalosis respiratorik ini, akan dikompensasi dgn
kompensasi renal (meningkatkan sekresi bikarbonat,
increased acid generation) dan sistem buffer (merilis
ion asam).
Sedangkan arterial dan cairan serebrospinal yg
terinhibisi ini, akan dikompensasi dgn kompensasirespiratorik (laju pernapasan turun yg berakibat PCO2
meningkat).
Sumber : slide pengaturan keseimbangan asam-basa, patofis
price wilson, sumber-sumber lain di internet.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
16/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 16
LARUTAN DAPAR/PENYANGGA
Hadeh.. terus terang ane jg kurang paham materi yg satu ini,
inti nya sc kamren ngejelasin bagaimana tubuh kita
mempertahankan kondisi homeostatis, biar gak jadi asidosis
atau alkalosis. Maka dokter nya ngejelasin lewat slide ini.
Nostalgia k SMA dulu. Jadi kalo ada yg salah silahkan
dikoreksi dan krim aja sarannya ke email yo! Semangat
membaca (Based on slide)
(slide 1-7)
Definisi
Larutan dapar/penyangga/buffer adalah larutan yang dapat
menahan perubahan pH bila ditambahkan sedikit asam atau
basa. Larutan ini terdiri dari asam lemah dan garamnya. Hal
ini berperan penting dalam menjaga pH cairan tubuh dan
jaringan. Banyak reaksi kimia termasuk yang melibatkan
enzim yang memerlukan kontrol pH yang melibatkan lar.
Dapar.
Umumnya pH cairan tubuh dipertahankan dengan ketat padakisaran 7,35-7,45. Agar pH yang diinginkan selalu terjaga
dalam eksperimen biokimia sering di gunakan lar. Dapar.
Untuk menghitung pH dapar digunakan persamaan
Handerson-Hasselbalch
Ini rumusanya: pH= pKa +log[A]
[HA]
pKa= -log Ka
Ka : konstanta dissosiasi asam
[A-] :konsentrasi basa
[HA]:konsentrasi asam
Kita latihan yuuk..
Bagaimana penyiapan dapar kalium fosfat 0,45 M pH 7,5 bila
diketahui pKa1= 2,12; pKa2 = 7,21; pKa3= 12,32 ?
KULIAH BIOKIMIA (dr. Virhan)
LARUTAN DAPAR/PENYANGGA + REAKSINYA
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
17/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 17
Jawab:
pH dapar ini sedikit di atas pKa2, bila dilihat dari kurva
titrasinya maka ada dua jenis ion yaitu H2PO4-(konjugat
asam) dan HPO42-(konjugat basa) yang dominan.
Kurva titrasi asam fosfat sebagai berikut
H3PO4 H++H2PO4
- Ka1
H2PO4-H++HPO42- Ka2
HPO42-H++PO43- Ka3
Dapar dapat dibuat dari beberapa cara
I.Dengan mencampur KH2PO4 dengan K2HPO4 (untuk
dapatkan H2PO4-dan HPO4
2-)
Pada dapar tersebut mengandung fosfat
1 L x 0,45 M = 0,45 mol
pH = pKa2 + log HPO42-/ H2PO4
-
7,5 = 7,2 + log HPO4
2-
/ H2PO4-
0,3 = log HPO42-/ H2PO4
-
HPO42-/ H2PO4- = anti log 0,3 = 2
HPO42-/ H2PO4- = 2/1
Karena itu dibutuhkan:
HPO42-=2/3 x 0,45=0.3 mol
H2PO4- = 1/3 x 0,45 = 0,15 mol
Jadi Kita timbang 0,30 mol K2HPO4 (52,8 g) dan 0,15 KH2PO4
(20,4 g) dan dilarutkan dalam air hingga volumenya 1 L
Utk koversi mol massa, massa = mol x Mr (massa molekul
relatif)
Ok.. tarik nafas dulu.. baca bismillah. Kita lanjut lagi.. ok..
Dapar itu ibarat spasang kekasih yang saling membantu dan
melengkapi. Ketika salah satu diganggu, yg lain akan
melindungi. n_n
Dapar dapat dibuat dengan 3 cara:
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
18/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 18
1.Asam lemah berlebih + basa kuat
2.Asam lemah + garamnya
3. Garam asam/basa + asam/basa lain
Sumber: pengalaman sendiri....hehe
(Slide 8-14)
Cara membuat dapar:
2. Dari H3PO4dan KOH (tuk buat dapar H2PO4-/HPO4
2-)
Jika tersedia H3PO415M dan KOH 1,5 M, maka berapa volume
masing-masing yang dibutuhhkan?
Reaksi setara:
Reaksi 1 :
H3PO4 + KOH KH2PO4
Awal : 0,45 0,45 -
Reaksi : -0,45 -0,45 +0,45
Akhir : - - 0,45
Reaksi 2:
KH2PO4 + KOH K2HPO4
Awal : 0,45 0,3 -
Reaksi :-0,3 -0,3 +0,3
Akhir :0,15 - 0,3
Anggap: jumlah mol(n) H3P04awal = 0,45 mol, maka n KOH
agar semua H3PO4gak bersisa = n H3PO4= 0,45 mol.
Maka V H3PO4= n/M = 0,45/15 = 0,03 L = 30 ml
V KOH = n/M = 0,45 + 0,3/1,5 = 0,5 L = 500 ml
Akhirnya zat yang bersisa pada reaksi 2 = KH2PO4 dan K2HPO4
yang merupakan komponen dapar asam (KH2PO4= asam,
K2HPO4= basa konjugasinya). Jumlah komponen masing-
masing sama besar yakni 0,3 mol , tujuannya agar diperoleh
kapasitas dapar max.
Jadi, dibutuhkan 30 ml H3PO415 M dan 500 ml KOH 1,5 M
tambah akuades hingga 1 liter
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
19/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 19
3. Dari KH2PO4dan KOH(tuk buat dapar H2PO4-/HPO4
2-)
Sedikit berbeda dengan yang di atas karena sediaan berada
dalam bentuk padatan, sehingga harus dicari masa masing-
masing komponen bukan volumenya. Lihat reaksi 2
Massa KH2PO4= n x BM(Berat Molekul) = 0,45 x 136 = 61,2
gr
Massa KOH = n x BM = 0,3 x 56 = 16,8 gr
Jadi, tuk buat dapar ini kita ambil dahulu 61,2 gr KH 2PO4 lalu
16,8 gr KOH, n campurkan keduanya dalam akuades hingga 1
liter.
4. Dari K2HPO4dan HCl(tuk buat dapar H2PO4-/HPO4
2-)
Reaksi 3:
K2HPO4 + HCL KH2PO4 + KCl
Awal : 0,45 0,15 -
Reaksi :-0,15 -0,15 +0,15
Akhir : 0,3 - 0,15
Cara kerja mundur dari akhir ke awal....karena kita
menginginkan perbandingan HPO42-/H2PO4
-= 2/1
Yang tersedia K2HPO4padat dan larutan HCl 2 M
Maka, massa K2HPO4= n x BM = 0,45 x 174 = 78,4 gr
Volume HCl = n/M = 0,15/2 = 0,075 L = 75 ml
Jadi, tuk buat dapar ini dibutuhkan 78,4 gr K2HPO
4dan 75 ml
HCl 2 M
5. Dari K3PO4dan HCl(tuk buat dapar H2PO4-/HPO4
2-)
Reaksi 4:
K3HPO4 + HCL K2HPO4 + KCl
Awal : 0,45 0,45 -
Reaksi :-0,45 -0,45 +0,45
Akhir :- - 0,45
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
20/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 20
Reaksi 3:
K2HPO4 + HCL KH2PO4 + KCl
Awal : 0,45 0,15 -
Reaksi :-0,15 -0,15 +0,15
Akhir : 0,3 0,15
Massa K3HPO4 = n x BM = 0,45 x 212 = 95,3 gr
Volume HCl = n/M = 0,45+0,3/M
Ket: Nilai M tdk tercantum di slide shg tidak dapat dikerjakan
6. Dari KH2PO4dan K3PO4
Reaksi 5:
KH2PO4+ K3PO4K2HPO4
Pada reaksi ini, H2PO4- bertindak sebagai asam yang
menyumbangkan ion H kepada PO43- yang bertindak sebagai
basa konjugasinya.
Ok.. de mdhan tentir ini bsa mmbantu tmen smua.. mhon
maaf jika ada kekurangan.. msukan dari tmen sngat
membantu.. neng kasih.. minum air kelapa muda.. terima
kasih dan sampai jumpa ..
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
21/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 21
Ketidak seimbangan cairan dan elektrolit
Cairan kompartemen dalam tubuh
2/3 atau 65 % dari total cairan tubuh adalah cairan
intraseluler
1/3 merupakan cairan ekstraseluler
25 % cairan interstitial
5- 8 % dalam plasma (cairan intra vaskular)
1- 2 % merupakan cairan transelulercairan
serebrospinal, intraocular , serous membranes,
dan pada sistem pencernaan, pernapasan dan
saluran kemih
Ini sedikit gambarnya...
KULIAH BIOKIMIA (dr. Andriani)
FLUID AND ELECTROLYTE IMBALANCE
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
22/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 22
Gambar juga ni, hampir samalah beda model aja...
intinya gini lah gimana cara mempertahankan keseimbangan
cairan dan elektrolit dalam tubuh
Neutral balance jika input = output
Positive balance jika input > output
Negative balance jika input < output
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
23/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 23
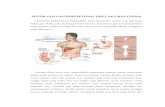
Penjelasan :
Gambar
a. Pemasukan air rata2 perharinya, dimana total
pemasukan 2.500 mL :
- Dari metabolisme 250 mL atau 10 %
- Dari makanan 750 mL atau 30 %
-Dari minuman 1.500 mL atau 60 %
b. Pengeluaran air rata2 perharinya 2.500 mL :
- Lewat keringat 50 mL atau 6 %
- Lewat feses 150 mL atau 6 %
- Melalui kulit dan paru-paru 700 mL atau 28 %
- Melalui urin 1.500 mL atau 60 %
Karakteristik cairan dalam tubuh kitaadalah
o Netral, jadi tidak mengandung muatan listrik
apapun
o Osmotiknya dipertahankan oleh jumlah
partikel yang spesifik per volume cairan.
Homeostasis cairan dan elektrolit dalam tubuh kita
akan dipertahankan olehtranspor ion, pergerakan air, danfungsi renal (ini hubungannya dengan fungsi filtrasi,
reabsorbsi, dan sekresi dari nefron yaa..). Lanjut, sekarang
kita bakalan belajar gambar sel
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
24/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 24
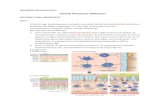
Gambar 2
Gambar 3
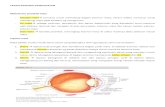
Pada gambar 1, cairan lingkungan berada dalam
keadaan isotonik sehingga eritrosit normal. Gambar 2,
lingkungan berada dalam keadaan hipertonik. Akibatnya,
cairan intraselular keluar menuju ke ekstraselular makanya
selnya tampak mengkerut. Gambar 3 kebalikan dari
gambar 2, lingkungan dalam keadaan hipotonik, akibatnya
banyak cairan ekstraselular yang masuk ke dalam sel
makanya bentuk sel menggembung.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
25/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 25
Pergerakan Cairan Tubuh, prinsip utamanya Kemana
sodium pergi, air akan mengikutinya
1. DifusiPergerakan partikel dari konsentrasi tinggi ke
konsentrasi rendah akibat adanya gradien konsentrasi.
2. OsmosisDifusi partikel dari konsentrasi rendah ke konsentrasi
tinggi yang melewati membran permeabel selektif.
3. Transpor aktifPergerakan partikel melawan gradien konsentrasi,
karena aktif jadi membutuhkan energi.
Regulasi Cairan Tubuh
Antidiuretic Hormone (ADH) + rasa haus
Mekanismenya adalah stimulasi osmoreseptor
pada hipotalamus akan mengakibatkan
pengeluaran ADH dari pituitari posterior yang
akan mengakibatkan meningkatnya rasa haus.
Hasil :
o Peningkatan konsumsi air
o Peningkatan jumlah air yang disimpan dalam
tubuh
o Peningkatan volume air dalam tubuh dan
penurunan konsentrasi Na+
Nah, mekanisme pengaturan dari hormon ADH bakalan
terganggu jika terjadi disfungsi atau trauma,
akibatnya terjadilah hal-hal berikut :
o Penurunan jumlah air dalam tubuh
o Peningkatan jumlah Na+dalam tubuh
o
Peningkatan osmolalitas daraho Penurunan jumlah volume darah di sirkulasi
Hayuk smgat.. kita lanjut lagi ke bahasan brikutnya..
(Slide 20)
Edema merupakan akumulasi dari cairan yang berada di
cairan interstisial. Jadi edema ini dapat menyebabkan :
Peningkatan tekanan hidrostatik
Penurunan tekanan osmotik plasma
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
26/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 26
Peningkatan permeabilitas membran kapiler
Obstruksi saluran limfatik
(slide 21)
Peningkatan tekanan hidrostatik meningkat dikarenakan :
Obstruksi Vena diantaranya disebabkan:
a. thrombophlebitisyaitu terjadinya
peradangan/inflamasi pada vena
b. obstruksi hepatik
c. Pakaian ketat pada bagian ekstremitas
halah,, bhaya juga ya.. :Dd. Kelamaan berdiri :D
Retensi garam dan air dapat disebabkan adanya :
a. Gagal Jantung Kongestif
b. Gagal Ginjal
(Slide 22)
Penurunan Tekanan Osmotik Plasma disebabkan :
penurunan albumin plasma Jadi, albumin memiliki
sifat menyerap air agar jumlah air di dalam plasma
menjadi sedikit. Tetapi jika terdapat gagal hati (inget
albumin kn dproduksi di hati) dan malnutrisi proteinmenyebabkan produksi albumin inadekuat. Kadar
Albumin yang sedikit dan kadar air dalam plasma
meningkat dapat menurunkan tekanan osmotik
plasma.
Protein plasma bisa hilang dalam keadaan seperti berikut
ini :
o Penyakit glomerular dari ginjal
o Perdarahan/hemorragic
o Luka Bakar
o Luka terbuka
o Sirosis hati
Peningkatan permeabilitas kapiler diakibatkan :
Inflamasi/peradangan
Respon imun
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
27/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 27
Saluran limfatik dihambat disebabkan :
Operasi
Infeksi yang meilbatkan sistem limfatik
Lymphedema
(Slide 24)
Akumulasi cairan dapat mengakibatkan :
Peningkatan jarak untuk difusi
Dapat mengganggu aliran darah = akibatnya
Keterlambatan penyembuhan
Peningkatan resiko terjadi infeksi
Tekanan luka lebih menonjol pada tulang
Mempengaruhi Efek Psikologis
(Slide 25)
Akibat Edema (retensi cairan)
Edema organ tertentu dapat mengancam kehidupan
(laring, otak, paru-paru)
Air terperangkap, akibatnya air tidak tersedia untuk
proses metabolisme. Hal tersebut dapat
mengakibatkan dehidrasi dan shock. (contohnya : luka
bakar)
Keseimbangan Elektrolit
Na +(Sodium)
90 % dari total cairan KATION ekstraseluler of
total ECF cations
Jumlah normal sekitar 136 -145 mEq / L
berpasangan dengan Cl-, HCO3-untuk
menetralkan muatan
Rendah konsentrasinya pada cairan intraseluler
Merupakan ion yang paling penting dalam
meregulasi keseimbangan cairan
Penting untuk mendukung fungsi saraf dan
fungsi otot
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
28/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 28
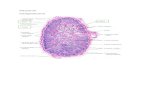
Gambar tersebut menjelaskan tentang konsentrasi relatif rasio
dari ion di cairan ekstraseluler dan cairan intraseluler.
Penjelasan sebagai Berikut :
Ion Cairan
Ekstraseluler
Cairan
Intraseluler
Rasio
(Ekstra :
Intra)
Na 140 10 14 : 1K 5 140 1 : 28
Ca 5 1 5 : 1
Mg 3 58 1 : 19
Cl 104 4 26 : 1
HCO3- 30 10 3 : 1
SO42- 1 2 1 : 2
Reabsorpsi Tubulus Renal dipengaruhi oleh hormon
berikut :
Aldosteroneakan meningkatkan reabsorpsi
dari Na dan H2O
Renin/angiotensinmengakibatkan
vasokonstriksi pembuluh darah dan menurunkan
reabsorpsi
Atrial Natriuretic Peptide (ANP)Memperlebar
volume dari kapiler glomerulus, sehingga terjadi
GFR. Akibatnya, reabsorpsi tubulus meningkat.
Potassium (Kalium)
Kation intraseluler terbanyak Major intracellular cation
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
29/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 29
Konsentrasi di dalam cairan intraseluler = 150- 160
mEq/ L
Potensial membran istirahat
Meregulasi cairan, menyeimbangkan ion di dalam sel
Regulates fluid, ion balance inside cell
Menyeimbangkan PH
(Slide 30)
Pengaturan Kalium dilakukan melalui organ ginjal yakni
dengan pengaturan hormon Aldosteron dan Insulin.
(Slide 31-32)
Perubahan Isotonik dalam keseimbangan air terjadi
ketika perubahan TBW(Total Body Water) disertai dengan
perubahan dalam elektrolit seperti:
hilangnya plasma/ECF hilangnya cairan isotonik
Menyebabkan turunnya volume ECF, hilangnya BB,
kulit dan membran mukosa kering, menurunnya urin
output, dan hipovolemia(detak jantung meningkat,
vena leher mengempis, dan tekanan darah normal atau
menurun/syok)
kelebihan cairan isotonik, bisa akibat kelebihan cairan
IV, hipersekresi aldosteron, dan efek obat(kortison)
Hipervolemia(gejala: BB meningkat, hematokrit
menurun, mengencernya protein plasma, pelebaran
vena leher, dan tekanan darah meningkat). Dapat
mengarah ke edema (tekanan hidrostatik kapiler
meningkat), edema paru, dan gagal jantung.
(Slide 33-40)
Ketidakseimbangan elektrolit: natrium
Terdiri dari hipernatremia dan hiponatremia.
Hipernatremia ( kadar ion natrium yang tinggi)
Syarat :
1. Na plasma > 145 mEq/L
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
30/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 30
2. Berkaitan dengan peningkatan Na atau penurunan air
3.Air berpindah dari ICF ke ECF
4. Dehidrasi sel
Hipernatremia berkaitan dengan hal-hal berikut:
1. Larutan IV hipertonik
2. Oversekresi aldosteron
3. Hilangnya air murni
Berkeringat jangka panjang disertai demam
kronik
Infeksi saluran napashilangnya uap air
Diabetespoliuria
4. Kurangnya pemasukan air/hipodipsia
Manifestasi Klinik:
1. Rasa haus
2. Letargi
3. Disfungsi neurologikal berkaitan dengan dehidrasi sel
otak
4.Volume vaskular menurun
Treatment: dengan menurunkan kadar Na serum seperti
dengan menggunakan cairan IV isotonik bebas garam dan
larutan oral tersedia.
Hiponatremia (menurunnya kadar Na dalam ECF)
Ada 2 tipe: deplesi dan dilusi
Tipe deplesi berhubungan dengan hilangnya ion Na, bisa
akibat obat diuretik, muntah kronik, diare kronik, Aldosteron
menurun, dan pemasukan Na menurun.
Tipe dilusi berhubungan dengan :
1. disfungsi renal dengan peningkatan pemasukan cairan
hipotonik
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
31/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 31
2. keringat berlebihrasa haus meningkatpemasukan
air murni dalam jumlah berlebih
3. sindrom of inappropriate ADH (SIADH) atau gagal
ginjal oliguria, gagal jantung kongestif, sirosis hati,
yang semuanya itu bermuara pada gangguan ekskresi
air pada ginjal.
4. Hiperglikemiamenarik air
Manifestasi klinik:
1. Gejala neurologik
Seperti letargi, sakit kepala, bingung, rasa takut,refleks menurun, kejang, dan koma.
2. Gejala otot
Seperti kram, kelemahan, capek.
3. Gejala GI
Mual, muntah, kram perut, dan diare
Terapi dengan membatasi pemasukan air atau menghentikan
pengobatan
Slide 41-51
Pada Kesempatan ini, kita akan membahas tentang
imbalances dari Kalium dan Kalsium, yaitu Hipo-Hiper-kalemia
dan hipo-hiper-calcemia.
Mulai dari Hipokalemia dulu ya..
Hipokalemia itu adalah suatu keadaan dimana konsentrasi
kalium dalam darah kurang dari 3.8 mEq/L darah. Nah,
kondisi hipokalemia ini sangat dihindarkan pada pasien
diabetes, karena terapi hormon insulin bisa menyebabkan
influks K+
ke dalam sel (intravaskular ke intraseluler, kadarkalium darah menjadi rendah), dan kondisi ketoasidosis yang
menyebabkan ion H+ digantikan oleh K+, yang akan
dikeluarkan lewat urine. Kondisi Hipokalemia ini terutama
disebabkan oleh obat golongan adrenergic drugs atau
epinephrine.
Penyebab hipokalemia ini :
- penurunan pemasukan ion K+ ,
- peningkatan pengeluaran ion K+ yang bisa disebabkan
oleh diuretik kronik, ketidaksetimbangan asam/basa,
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
32/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 32
trauma and stress, peningkatan aldosterone,
Redistribusi antara ICF (intracellular fluid) dan ECF.
Manifestasi klinis dari Hipokalemia antara lain adalah:
- gangguan neuromuskular (kelemahan, flaccid
paralysis-kelemahan/kehilangan tonus otot, respiratory
arrest-henti paru (napas), dan konstipasi)
- disritmia, ditandai dengan munculnya gelombang U
(mungkin maksudnya pada EKG)
- Hipotensi postural (penurunan tekanan darah seiring
dengan perubahan posisi tubuh menuju lebih vertikal,misalnya dari duduk berdiri, atau berbaring ke duduk)
- Henti jantung
Pengobatannya : menambah asupan K+, namun secara
perlahan, dianjurkan melalui makanan.
(boleh dibaca boleh nggak) Berdasarkan sumber yg saya
dapat patofisiologi hipokalemia ini bisa terjadi melalui
beberapa hal, yaitu:1,2,3
Perpindahan trans-selular, intinya yaitu
perpindahan kalium dari intravaskular ke intraseluler yang
bisa disebabkan beban glukosa, insulin, obat adrenergik,
bikarbonat, dsb. Insulin dan obat katekolamin simpatomimetik
diketahui merangsang influks kalium ke dalam sel otot.
Sedangkan aldosteron merangsang pompa Na+/K+ ATP ase
yang berfungsi sebagai antiport di tubulus ginjal. Efek
perangsangan ini adalah retensi natrium dan sekresi kalium.
Deplesi Kalium. Hipokalemia juga bisa merupakan
manifestasi dari deplesi cadangan kalium tubuh. Dalam
keadaan normal, kalium total tubuh diperkirakan 50
mEq/kgBB dan kalium plasma 3,5--5 mEq/L. Asupan K+yang
sangat kurang dalam diet menghasilkan deplesi cadangankalium tubuh.
Kehilangan K+ Melalui Jalur Ekstra-renal.
Misalnya Kehilangan melalui feses (diare) dan keringat bisa
terjadi bermakna, drainase lambung (suction), muntah-
muntah, fistula, dan transfusi eritrosit. Pencahar dapat
menyebabkan kehilangan kalium berlebihan dari tinja. Ini
perlu dicurigai pada pasien-pasien yang ingin menurunkan
berat badan.
Kehilangan K+ Melalui Ginjal. Diuretik boros kalium
dan aldosteron merupakan dua faktor yang bisa menguras
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
33/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 33
cadangan kalium tubuh. Tiazid dan furosemid adalah dua
diuretik yang terbanyak dilaporkan menyebabkan hipokalemia
Derajat Hipokalemia. Hipokalemia moderat
didefinisikan sebagai kadar serum antara 2,5 - 3 mEq/L,
sedangkan hipokalemia berat didefinisikan sebagai kadar
serum < 2,5 mEq/L. Hipokalemia yang < 2 mEq/L biasanya
sudah disertai kelainan jantung dan mengancam jiwa.
Tatalaksana Hipokalemia. Untuk bisa
memperkirakan jumlah kalium pengganti yang bisa diberikan,
perlu disingkirkan dulu faktor-faktor selain deplesi kaliumyang bisa menyebabkan hipokalemia, misalnya insulin dan
obat-obatan. Status asam-basa mempengaruhi kadar kalium
serum. Jumlah Kalium. Walaupun perhitungan jumlah
kalium yang dibutuhkan untuk mengganti kehilangan tidak
rumit, tidak ada rumus baku untuk menghitung jumlah kalium
yang dibutuhkan pasien. Namun, 40100 mmol K+suplemen
biasa diberikan pada hipokalemia moderat dan berat. Pada
hipokalemia ringan (kalium 33,5 mEq/L) diberikan KCl oral
20 mmol per hari dan pasien dianjurkan banyak makan
makanan yang mengandung kalium. KCL oral kurang
ditoleransi pasien karena iritasi lambung. Makanan yang
mengandung kalium cukup banyak dan menyediakan 60
mmol kalium.
1Zwanger M. Hypokalemia.
emedicine.com/emerg/topic273.html
2Cohn JN, Kowey PR, Whelton PK, Prisant LM. New
Guidelines for potassium Replacement in Clinical
Practice. Arch Intern Med 2000;160:2429-2436.
3Halperin ML, Goldstein MB. Fluid Electrolyte and
Acid-Base Physiology.A problem-based approach.
WB Saunders Co. 2nd ed., p 358
Hiperkalemia
Adalah peningkatan kadar ion K serum >5,5mEq/L.
Hiperkalemia adalah suatu keadaan darurat medis yang perlu
segera dikenali dan ditangani untuk menghindari disritmia dan
henti jantung (cardiac arrest).
Penyebabnya bermacam-macam:
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
34/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 34
Cek penyakit ginjal
Trauma masif seluler
Defisiensi insulin
Penyakit Addison
Potassium sparing diuretics
Penurunan pH darah
Latihan menyebabkan K+bergerak keluar sel
Manifestasi klinis dari hiperkalemia:
Tahap awalotot hiperactive , parestesia
Tahap akhirkelemahan otot, flaccid paralysis Perubahan pola
Dysrhythmias
Bradycardia , heart block (gangguan pada sistem
elektrik pada jantung), henti jantung
Pengobatan:
Penurunan pemasukan dan peningkatan eksresi renal
Insulin + glukose
Bicarbonate
Ca++yang berefek pada jantung
(ini juga boleh dibaca boleh gak ^^)
Ada 2 mekanisme terjadinya hiperkalemia, yaitu1,2,3 :
Kelebihan asupan kalium melalui makanan.
Buahbuahan dan sayursayuran banyak mengandung
kalium. Campuran garam dapat mengandung kalium, dan
kelebihan asupan dapat terjadi pada pemberian makanan
enteral.
Keluarnya kalium dari intra sel ke ekstrasel.
Keadaan asidosis metabolik, selain yang disebabkan oleh KAD
atau asidosis laktat, defisisensi insulin, pemakaian beta
blocker, dan pseudohiperkalemia akibat pengambilan sampeldarah yang lisis. Kelainan klinik bergantung kepada kadar
kalsium, dan keseimbangan asam-basa. Berkurangnya
ekskresi melalui ginjal. Terjadi pada keadaan
hiperaldosteronisme, gagal ginjal, deplesi volume sirkulasi
efektif pada CHF dan pemakaian siklosporin. Dewasa ini
diketahui pemakaian ACE inhibitor juga faktor resiko untuk
hiperkalemia.
Pada hiperkalemia, terjadi peningkatan kepekaan
membran sel, sehingga dengan sedikit perubahan
depolarisasi, potensial aksi dapat dengan mudah terjadi. Hal
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
35/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 35
ini menimbulkan kelemahan otot sampai paralisis dan gagal
nafas. Gejala yang paling buruk adalah penurunan kecepatan
sistem konduksi miokard dan meningkatkan repolarisasi
miokard.
1Darwis D, Munajat Y, Nur MB, Madjid SA, Siregar P,
Aniwidyaningsih, W, dkk. Gangguan Keseimbangan Air,
Elektrolit dan Asam Basa. Edisi 2. Jakarta : Balai Penerbit
FKUI; 2010
2 Weiner DI, Wingo SC. Hyperkalemia : A Potential Silent
Killer. J Am Soc Nephrol. 1998; 9: 1535-433 Grabber AM. Terapi Cairan, Elektrolit dan Metabolik. Edisi ke
2. Jakarta: Framedia; 2003
Ketidaksetimbangan Kalsium
Ion kalsium (Ca) merupakan elektrolit yang banyak terdapat
di ekstraseluler, dimana 99 % disimpan di tulang. Kadar
normal kalsium plasma adalah 8,1 10,5 mmol/L. Ca
berfungsi pada sistem neuromuskular, konduksi saraf,
kontraksi otot, relaksasi otot, dan juga penting untuk
mineralisasi tulang dan merupakan kofaktor penting untuk
sekresi hormon pada organ endokrin. Pada tingkat sel, Ca
merupakan regulator penting untuk transpor ion dan
integritas membran. Tulang berperan ganda, dimana
berperan sebagai yang mengambil kalsium untuk stabilitas
dan sebagai depot untuk keadaan suplai kalsium yang rendah
Kalsium diregulasi oleh:
Parathyroid hormone
Ca++darah dengan menstimulasi osteoklast
absorpsi GI dan retensi renal Calcitonin dari Kelenjar tiroid
Merangsang pembentukan tulang
eksresi renal
Hipercalcemia
Merupakan hasil dari :
Hyperparathyroidism
Kondisi Hypothyroid
Penyakit ginjal
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
36/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 36
Konsumsi Vitamin D yang berlebihan
Sindrome susu-alkalis
Obat-obat tertentu
Tumor Malignant (hypercalcemia of malignancy)
Tumor memproduksi promosi pemecahan/penguraian
tulang, pertumbuhan tumor di tulang menyebabkan
dilepaskannya Ca++dalam darah.
Kondisi hipercalcemia selalu diikuti oleh hiperphospatemia.
Efek/gejala dari hipercalcemia ini antara lain:
Banyak dan nonspesifik seperti kelelahan, lemas, danletargi
Peningkatan pembentukan batu ginjal dan batu
pankreas
Kejang otot
Bradicardia, henti jantung
Nyeri
Pada aktivitas GI biasanya timbul: mual, kram
abdominal, diare/konstipasi
Kalsifikasi metastatis
Hipocalcemia
Keseimbangan kalsium diatur oleh hormon paratiroid (PTH)
dan Vitamin D. Hormon paratiroid bergantung kepada
Calsium-sensing reseptor (CSR), untuk mendeteksi adanya
kelebihan kalium serum, dan merangsang PTH yang akan
meningkatkan kadar kalsium darah. Apabila CSR ini tidak ada
maka akan terjadi hipokalsemia.
Pada hipocalcemia terjadi refleks hiperaktif dan
neuromuskuler tetani yang membedakannya dari
hypercalcemia. Pada beberapa kasus terjadi kejang-kejangyang hebat.
Penyebab hipocalemia:
Gagal ginjal
Kekurangan vitamin D
Supresi/penurunan fungsi Paratiroid
Hipersekresi dari kalsitonin
Keadaan malabsorpsi
Keasaman/basa intestinal yang abnormal
Infeksi yang menyebar atau inflamasi peritoneal.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
37/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 37
Diagnosis ditegakan berdasarkan:
Chvosteks sign: dapat muncul dengan cara mengetok
pada titik tertentu pada wajah, yang ditandai dengan
adanya respon berupa twitching. Mekanisme terjadinya
adalah adanya stimulasi mekanik langsung serabut
motorik wajah.
Trousseaus sign: terjadi peningkatan eksitabilitas saraf
di tangan dan lengan, yang disebabkan oleh
hipokalsemia, dan bila iskemia dibuat, yaitu dengan
menggunakan sfigmomanometer, akan muncultwitching.
Pengobatan:
Kalsium IV untuk keadaan akut
Kalsium oral dan Vitamin d untuk keadaan kronik
(tambahan aja)
Paratiroid Hormon (PTH), adalah suatu faktor yang
penting dalam regulasi keseimbangan kalsium dengan
menurunkan ekskresi dan meningkatkan absorpsi kalsium di
ginjal dengan bantuan 1,25 COH2 Vitamin D3 (calcitrol), dan
merangsang osteoklas melepaskan kalsium dari tulang. Efek
PTH di tubulus adalah merangsang aktifitas 1 alfa hidroksilase
yang akan memicu produksi calcitrol. PTH meningkatkan
reabsorpsi Ca di TAL, dan begitu juga pada tubulus distal.
Selain itu, calcitrol juga akan meningkatkan absorpsi kalsium
di intestinal. PTH bergantung kepada Calsium Sensing
Reseptor (CSR) untuk mendeteksi adanya kelebihan kalium
serum, dan menghambat sekresi PTH. PTH disekresikan oleh
chief cells pada kelenjar paratiroid yang akan meningkatkan
kadar kalsium darah.
1,2
Reasorbsi kalsium terjadi pada semua tubulus ginjal.
60 70 % terjadi di tubulus proksimal, 30 % di Thick
Ascending Limb (TAL) dari ansa henle. Karena reasorpsi Ca
pada TAL bergantung kepada reabsorpsi NaCl, maka pada
loop diuretic, kalsium diinhibisi untuk direabsorpsi. Asidosis
menghambat reabsorpsi kalsium dengan mekanisme yang
belum dapat dipahami.2,3,4
1 Siregar P. Gangguan Keseimbangan Cairan dan Elektrolit.
Dalam : Buku Ajar Ilmu Penyakit Dalam. Edisi 4, Jilid I.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
38/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 38
Jakarta : Pusat Penerbitan Ilmu Penyakit Dalam FKUI; 2006 :
529-37
2 Ziegler R. Hypercalcemic Crisis. J Am Soc Nephrol. 2001;
(12) S3-S9
3 Bindels JMR. 2009 Homer Smith Award : Minerals in Motion:
From New Ion Transporters to New Conceots. J Am Soc
Nephrol 2008; 19: 764-770
4 Orson W, Bony O. Genetic Hypercalciuria. J Am Soc
Nephrol. 2005; 16: 729-45
FLUOROQUINOLONES
Obat yang lebih tua: asam nalidiksat (nonfluorinated)
Tidak efektif terhadap infeksi sistemik
Mekanisme antibiotic
- Masukkan sel dengan difusi pasif melalui berisi air
saluran protein (Porins)
- Menghambat replikasi DNA bakteri dengan
mengganggu aksi DNA gyrase (topoisomerase II)
selama pertumbuhan dan replikasi
- Menyebabkan kematian sel dengan DNA merangsang
pembelahan
AM Spectrum
- Bakterisida
-Gram (-): enterobacteria, pseudomonas, HI, M
catarrhalis, Legionella, Chlamydia, mikobakteri
- Efektif terhadap gonore, bukan untuk sifilis
KULIAH FARMAKOLOGI (dr. Iit)
QUINOLONES AND URINARY TRACT ANTISEPTICS
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
39/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 39
- Beberapa gram (-)
- Anaerob: Miskin
- Profilaksis: operasi transurethral
Ciproflokxacin
- paling ampuh
- Pseudomonas infeksi
- Tingkat serum dicapai: efektif terhadap infeksi
sistemik, kecuali MRSA (methicillin-Resistant
Staphylococcus aureus), enterococci, pneumococci
-Enterobacteraceae, gram (-) bacili
- Sinergis dengan beta laktam Norflokxacin
- Efektif terhadap bakteri gram (-); P aeruginosa dan
gram (+), ISK rumit dan tidak rumit dan prostatitis
- Tidak untuk infeksi sistemik
(Slide 12-22)
OFLOXACIN
Hampir sama dgn norfloxacin
Bys utk prostatitis krna e.coli
Obat alternatif utk gonnorhea
Bermanfaat jg utk kulit dan sistem pernapasan atas
Tidak utk sifilis
LOMEFLOXACIN
Utk ISK krna Haemophilus influenza/Moraxella catarrhalis
Tdk utk bakteremia pseudomonal
Resistensi dalam obat gol. Fluoroquinolon :
Tak termediasi oleh plasmid.
Resisten thdp bakteri kromosomal, seperti MRSA,
Pseudomonas, coagulase-negative staphylococci dan
enterococci.
Dapat terjadi resistensi jika digunakan bersamaan dgn obat
dlm satu gol. quinolon.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
40/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 40
Mekanismenya :
- ALTERED TARGET : terjadi modifikasi di DNA girase
bakteri yg menyebabkan afinitas obat gol.
fluoroquinolon berkurang
- DECREASED ACCUMULATION : jumlah porin
berkurang, sistem efluks
Farmakokinetik obat gol. Fluoroquinolon :
1.Absorpsi.
Per oral/PO (cipro, o, lome, nor), intravena/IV (cipro,
o)
Bioavailabilitas bysny tercapai utk yg o dan lome
2. Distribusi
Berikatan dgn protein plasma (10-40%)
Terdistribusi baik di smua jar. dan cairan tubuh,
terutama di tulang, urin, ginjal dan jar. prostatik
Terpenetrasi rendah di cairan serebrospinal (CSF),
kecuali ofloxacin
Terakumulasi di makrofag dan PMN
3. Metabolisme
Akan termetabolisme lebih jika aktivitas antimikrobanya
kecil
4. Ekskresi
Waku paruh (T ) = 3-5 jam. Lomefloxacin = 8 jam
Efek samping obat gol. Fluoroquinolon :
- Muntah, sakit kepala, rasa silau berlebih
- Kristaluria
- Fototoksisitas\
Kontra indikasi obat gol. Fluoroquinolon :
- Ibu hamil, ibu menyusui, anak umur
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
41/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 41
Interaksi obat gol. Fluoroquinolon dgn obat lain :
- Dpt terganggu jika diberi bersama dgn al/mg dan antacid
- Theofilin, warfarin dan siklosporin dapat meningkat
konsentrasi serumnya (di hati/p-450) jika diberi bersama
cipro dan oflo.
- Eliminasi dpt terganggu dgn simetidin
QUINOLONE
ASAM NALIDIKSAT (NALIDIXIC ACID) merupakan
nonfluorinated quinolone yang memiliki mekanisme aksi yang
sama dengan fluorokuinolon. Obat ini efektif untuk Infeksi
Saluran Kemih akibat gram negatif dan bakteri gram
positif (+) yang udah resisten. Penggunaan klinik obat ini
relatif terbatas karena sering ditemukannya strain yang
resisten. Absorpsi pada pemberian oral baik, >90% terikat
pada protein, sedangkan kadar obat bebas dalam darah tidak
cukup adekuat untuk mengatasi infeksi sistemik.
Efek samping obat ini meliputi mual, muntah, nyeri
abdominal, fototoksik dan demam. Pemberian lebih dari 2
minggu dapat mempengaruhi fungsi hepar.
URINARY TRACT ANTISEPTIC
Antiseptik saluran kemih biasanya digunakan untuk penyakit
sistitis akut yang tak disertai komplikasi dan pyelonefritis.
Obat ini dapat membasmi bakteri kayak E. Coli yaitu
patogen yang menyebabkan 80 % infeksi saluran
kemih atas dan bawah tanpa komplikasi. Selain itu juga
bisa basmi S. saphrophyticus, Klebsiella pneumoniae,
Proteus mirabilis
Contoh obatnya : Methenamine dan Nitrofurantoin
Obat ini Tidak dapat mencapai level di sirkulasi (artinya
tidak dapat digunakan untuk efek sistemik)dan
terkonsentrasi pada urin.
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
42/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 42
METHENAMINE
Metabolisme Antibiotik : Methenamine harus diuraikan padapH 5,5 atau
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
43/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 43
Didistribusikan disepanjang cairan tubuh, tetapi
tidak akan terurai jika pH 7,4 (basa). *ya iyalah
kan g efektif kalo suasana basa.
Efek Samping
Distres pada saluran Gastrointestinal
Jika diberikan pada dosis tinggi akan
menyebabkan : Albuminaria, hematuria, dan lesi
kulit
Presipitasi asam mandelic dapat menyebakan
Gagal Ginjal
Sulfonamid akan bereaksi dengan formaldehid.
NITROFURANTOIN
Kurang umum digunakan karena spektrum
sempit dan sangat tinggi toksisitasnya.
Metabolisme Nitrofurantoin akan meningkat
aktivitasnya pada urin suasana asam dan
bersifat merusak DNA dan Enzim
Activity is greater in acidic urine
Damages DNA and enzymes
Spectrum Antibiotik
Bersifat Bacteriostatik dan efektif untuk
membunuh bakteri E. Coli dan Gram (+)
yang sensitif (rapuh). Hehe..
Klo untuk bakteri gram negatif (-) kokus
kemungkinan resisten.
Farmakokinetik
Obat Nitrofurantoin diabsorpsi secara
sempurna setelah diberikan per oral.
Kemudian secara cepat dieksresikan oleh
proses filtrasi glomerulus. Nah, biasanya
-
7/22/2019 tentir deFarbion ed. 3 Modul Ginjal dan Cairan Tubuh.pdf
44/44
Tentir deFarbion (2010 et Farmakologi n Biokimia Division) Modul Ginjal dan Cairan Tubuh 44
setelah minum obat ini urinnya akan
berubah menjadi coklat.
Efek samping
Gangguan pada saluran Gastrointestinal
seperti Muntah, mual, dan diare.
Gangguan dalam makan dan sulit minum
susu
pneumonitis akut, fibrosis interstitial
saluran pernapasan
Permasalahan pada persarafan seperti
sakit kepala, nystagmus,
polyneuropathies with demyelination
Anemia Hemolitik : pada defisiensi G6PD,
neonatus, dan wanita hamil
Ok.. de akhirnya slesai juga ni tentir deFarbion.. ttap
semangat teman. Mudhan kita smua sukses bwt ujian
mendatang.. mohon masukannya ya klo ada kekurangan atau
keliru mengenai materinya. Klo ad yg kurang langsung aj
smpein sama deFarbions Crew ok... trims.. v GENDERMAN
2010 lulus semua ! smpai jmpa lagi di the tentir deFarbion ed.
Modul2 mendatang..