tentir biokimia ginjal
-
Upload
eda-alfiansyah -
Category
Documents
-
view
326 -
download
5
Transcript of tentir biokimia ginjal

BI
DIS
HUSNI F
RABIU
KIMIA
ISUSUN OLEH:
I FAUZAL RAMDAN
IUL PRIYANTONO
1
IA
AN
O

2
Hai teman-teman.. (malas basa-basi soalnya ntar kepanjangan di pembukaannya.. trus ntar
kalian kebanyakan nge-printnya lagi gara-gara banyak cuap-cuap di awal tentir. Jdi
pembukaannya dikit ajj ya, aq juga lagi malas buat pembukaannya..)
Nah di tentir ini ada 3 pokok bahasan yang akan diangkat, antara lain:
• Pengaturan Imbangan Asam Basa oleh tubuh
• Komponen dan fungsi bufer kimiawi
• Kelainan Imbangan Asam Basa: asidosis and alkalosis
Sebelum masuk ke pembahasan di atas, kita akan me-review ulang tentang asam, basa dan
pH. pH adalah satuan yang digunakan untuk menunjukkan derajat keasaman atau kebasaan
suatu larutan, nilai pH didapatkan dari perhitungan:
pH= - log [H+]
masih inget kan pelajaran SMA??
H+ adalah suatu proton (ion hydrogen). Nilai pH berkisar antara 0-14. Jika suatu larutan
memiliki [H+] tinggi, maka larutan tersebut bersifat asam dan memiliki pH <7. Sebaliknya, jika
suatu larutan memiliki [H+] rendah, maka larutan tersebut bersifat basa dan memiliki pH>7.

3
Asam adalah donor proton ([H+]) sedangkan basa adalah penerima proton ([H+]) atau yang
memberikan [OH-] dalam larutan. Asam kuat (misalnya HCL, H2SO4) terdisosiasi secara
sempurna menjadi anion dan kation di dalam larutan. Asam lemah terdisosiasi hanya
sebagian dari larutan asam (contohnya asam laktat dan asam karbonat). Hampir sama
dengan konsep asam kuat dan asam lemah, basa kuat (seperti KOH atau NaOH) terdisosiasi
secara sempurna dalam larutan. Contoh basa lemah adalah Ca(OH)2.1
Setelah memahami konsep pH, sekarang kita masuk membahas tentang pH di dalam
tubuh… (yang belum ngerti tentang pH, baca lagi sebelum masuk ke pembahasan
berikutnya, biar lebih nyambung)
pH cairan tubuh baik ekstrasel, intrasel maupun darah, dijaga dengan ketat melalui proses
homeostasis. pH cairan ekstrasel dijaga supaya nilai pH-nya konstan yaitu 7,4 sedangkan di
darah, rentang nilai pH yang dikatakan normal adalah berkisar antara 7,35-7,45 (kecil banget
kan rentangnya). Nah jika pH dalam cairan tubuh itu <6,8 atau >8,0 maka akan menyebabkan
kematian.. (nah lo!!). Suatu keadaan yang dinamakan asidosis terjadi apabila pH dalam
cairan tubuh <7,35 dan keadaan yang dinamakan alkalosis terjadi apabila pH dalam cairan
tubuh >7,45.

4
Kemudian sekarang kita akan mempelajari tentang imbangan asam basa.. apa tuh?? Nah
imbangan asam basa itu adalah keadaan dimana [H+] yang diserap selalu setara dengan
[H+] yang dilepaskan. Tujuannya ya udah pasti, untuk mempertahankan pH cairan tubuh
supaya tetap berada dalam rentang normal (pH darah 7,35-7,45). Hasil metabolism didalam
tubuh menyebabkan terbentuknya asam dan basa (terutama asam, cth: asam laktat dari
respirasi anaerob) dan sebagian besar enzim bekerja pada pH tertentu (kerja optimal di pH
optimal). Oleh karena itu, pH cairan di dalam tubuh harus dijaga ekstra ketat supaya kerja
normal tubuh dapat berlangsung dengan baik.
Pengaruh perubahan pH selain mempengaruhi kerja enzim di dalam tubuh, juga
mempengaruhi kerja organ tertentu seperti otak dan jantung. Eksitabilitas saraf dan otot
juga dipengaruhi oleh perubahan pH. Jika pH menurun maka eksitabilitas saraf dan otot juga
akan menurun, begitu juga sebaliknya.

Dalam kondisi fisiologis, tubuh
banyak makanan yang lebih as
NaHCO3 yang juga bisa ditemu
protein bisa menghasilkan asam
polipeptidanya banyak) dan asa
keton (contoh: aseton, asam
anaerob menghasilkan asam lak
dan reaksi metabolisme seluler
ngebentuk asam karbonat H2CO
segera terurai menjadi HCO3- da
asam trikarboksilat) dan ion am
kesan asam-nya?
uh kita itu cenderung jadi asam. Kenapa? Pert
asam (jarang lah makanan bersifat basa, palin
emui di obat antasida kan bisa bikin alkalosis)
sam sulfat (sebenarnya gak ada di asam aminony
asam fosfat, metabolisme asam lemak mengh
am asetoasetat, sama asam beta-hidroksibuti
laktat, dan yang terakhir CO2 dihasilin sama
luler. Perlu diingat bahwa CO2 bisa bereaksi sa
2CO3 yang dikatalisis oleh enzim karbonat anhidr
dan H+. Ada juga asam sitrat (salah satu kompo
amonium Keliatan kan dari yang semua disebu
5
Pertama makanan
alingan soda kue
sis), metabolisme
onya tapi di rantai
nghasilkan badan
butirat). Glikolisis
a glikolisis aerob
si sama H2O yang
hidrase dan sangat
mponen dari siklus
ebutin tadi itu ada

6
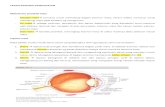
Dari gambar bisa dilihat gimana metabolism glukosa, asam lemak dan asam amino
menghasilkan CO2 yang bisa mengakibatkan perubahan pH tubuh.
Asam karbonat atau H2CO3 disebut juga sebagai asam volatil (Latin: volare – terbang). Ini
satu-satunya asam yang volatil dalam tubuh karena bisa menguap � dapat dikeluarkan
lewat paru – jadi mekanisme untuk “mengeliminasi”-nya bisa melalui paru – dan CO2 diubah
jadi H2CO3�berhubungan sama konsentrasi H2CO3 dan secara langsung menggambarkan
PCO2 yang berhubungan scr terbalik sama pH (inget rumus HH: ; dan jenis asam lainnya
adalah asam non-volatil (H2SO4 dan H2PO4) yang ga bisa dikeluarkan lewat paru. Di slide
ditulis sebagai asam fixed (tidak terpisahkan di dalam larutan, seperti asam sulfat dan
fosfat); sama asam organik (hasil metabolisme anaerob, seperti asam laktat yang
merupakan hasil dari asam piruvat).
Nah, setelah kita belajar dasar-dasarnya, sekarang kita akan belajar gimana sih tubuh kita
mmpertahankan pH nya..
Imbangan asam-basa dipertahankan di dalam tubuh dilakukan deng ancara melakukan
pengaturan imbangan ion hidrogen (H+). Bagaimana cara mengatur ini? Nah tubuh
melakukan 3 mekanisme untuk menjaga agar ion hydrogen di dalam tubuh tetap seimbang.
3 mekanisme itu melalui system Buffer (penyangga), Paru dan Ginjal. Ketiganya diurutkan
berdasarkan waktu kerjanya dalam merespons ketidakseimbangan asam-basa (buffer
kimiawi: instan, hitungan detik saja; paru: hitungan menit; ginjal: hitungan jam sampai hari).
Buffer disebut juga pengaturan jangka pendek yang hanya MENETRALISIR dari perubahan
pH bukan mengeliminasi agen dari penyebab perubahan pH. Sedangkan paru dan ginjal
disebut juga pengaturan jangka panjang yang melakukan proses ELIMINASI agen2 penyebab
perubahan pH, bukan menetralisirkan perubahan tersebut.

7
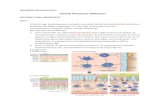
Coba lihat gambar/skema di atas.. bisa dilihat bahwa tubuh melakukan mekanisme utk
menjaga agar pH tetap seimbang (bahasa kerennya tawazun) dengan dua lini yaitu buffer
kimiawi dan buffer fisiologis.. buffer kimiawi dibagi menjadi 3 yaitu system buffer
bikarbonat, fosfat dan protein. Lah bedainnya gimana?? Kalo bikarbonat itu kerjanya di
ekstraseluler makanya bikarbonat banyak terdapat di ekstraseluler. Sedangkan fosfat itu
kerjanya di intraseluler makanya ion fosfat banyak di intraseluler kayak yg dijelasin shiddig
kmren tuh.. lah kalo gitu si protein kerjanya dimana? Di kantoran? Di rumah sakit? Teettt
jawabannya salah, yang bener itu system buffer protein kerjanya di dalam dan di luar sel.
Untuk yang lini kedua, kami akan coba jelasin per bagian…
Paru
Bagaimana paru bisa mengatur pH dalam tubuh? Paru melakukan mekanisme homeostasis
pH tubuh dengan cara mengatur tingkat pernapasan (respiratory rate). Caranya seperti ini
nih:
• Saat pH darah turun (kadar CO2 di darah tinggi � H2CO3 juga tinggi), paru
meningkatkan RR-nya sehingga akan lebih banyak CO2 yang akan dibuang melalui
paru.
• Saat pH darah naik (kadar CO2 di darah rendah � H2CO3 juga rendah), paru
menurunkan RR-nya sehingga akan lebih banyak CO2 yang akan tertahan di dalam
tubuh yang kemudian menyebabkan penurunan pH.

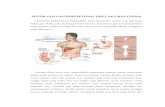
Gambar diatas itu maksudnya P
CO2 dikeluarkan.. CO2 diangkut d
bergabung dengan ion hydrog
karbonat anhidrase, asam karb
dikeluarkan melalui ekspirasi par
Yang perlu dipegang erat-erat su
penurunan pH darah.
ya Paru-Paru.. Ilustrasi diatas menjelaskan baga
ut dalam bentuk ion bikarbonat. Ion bikarbonat
rogen membentuk asam karbonat.. dengan b
karbonat akan dipecah menjadi air dan CO2
paru.
t supaya ngerti gambar di atas, peningkatan CO
8
agaimana caranya
nat tersebut akan
n bantuan enzim
seterusnya CO2
CO2 menyebabkan

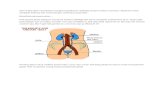
Ginjal
Ginjal merupakan regulator pH
serta mengatur sekresi, ekskres
Jawabannya adalah dengan
bikarbonat dan buffer fosfat. K
banyak HCO3- dalam urine yang
(banyak H+ dalam urine yang di
dan buffer fosfat. Beuh, penting
ngk bisa mmpertahankan homeo
Ginjal menghasilkan amonia dar
glutaminase. Nah, inget kan kon
mengalami asidosis? Nah H+ ini
masih berada di dalam tubulus d
ginjal). Jadilah H+ dikeluarin mel
Nah tadi udah dibilang bahwa g
Gimana caranya? Sebenernya di
pH yang efektif. Ginjal mengatur sekresi dan re
kresi dan reabsorpsi H+. bagaimana ginjal bisa
n produksi ammonia, produksi buffer asam
Kalo terjadi alkalosis maka otomatis pH urine
ng ga semuanya tereabsoprsi); sementara kalo a
g dikeluarin). Ginjal juga berperan dalam mengha
ting bener fungsi ginjal yak?? Gimana kalo ginjal
meostasis pH tubuh donk.. (ini salah efeknya)
dari deaminasi glutamin (as amino) yang dikatal
kondisi dimana H+ tadi banyak terdapat di urine
ini keiket sama amonia di lumen tubulus dista
us distal (inget lagi H+ yang lagi kita bicarain ada
melalui urin dalam bentuk ion amonium (NH4+).
a ginjal itu berfungsi mengatur sekresi dan rea
a di fisiologi udah dijelasin, tpi diulang lagi deh
9
reabsorpsi HCO3-
isa mengatur pH?
sam karbonat/ion
rine naik (lantaran
lo asidosis pH urin
ghasilkan amonia
jal rusak? Ya, ginjal
atalisis oleh enzim
ine lantaran tubuh
istal ataupun saat
adanya di tubulus
+).
reabsorpsi HCO3-.
eh supaya ngerti..

Ion bikarbonat direabsorpsi di tu
ini.
Di tubulus distal HCO3- dibentu
menguap (HCL, H3PO4, H2SO4
metabolisme.
Gambar di atas merupakan skem
Sekresi H+ hampir sama dengan
akan bergabung menjadi H2CO
yang tidak stabil dan langsung m
i tubulus proksimal dengan cara seperti pada ga
uk lagi, utk menggantikan HCO3- yg dipakai ole
4 dan as. organik) dalam darah yang merupaka
kema sekresi H+ di dalam tubulus distal.
gan yang terjadi di tubulus proksimal. Pertama
CO3 dengan bantuan enzim CA, bentuk ini meru
g menjadi ion-ion yaitu H+ dan HCO3-. Ion hydrog
10
gambar di bawah
i oleh asam yg tdk
akan hasil proses
ama, H2O dan CO2
erupakan bentuk
rogen akan keluar

11
ke dalam urin dan menggantikan kedudukan satu ion natrium yang berada dalam urin
(dalam bentuk senyawa Na2HPO4-. Ion natrium yang ditukar tadi akan masuk ke dalam sel.
Akibat dari pergantian dua ion tersebut, pH urin menjadi turun dari 7,4 sampai 6,0. Proses
pertukaran tersebut berlangsung sampai pH 4,5. Bila keadaan ini terjadi maka sekresi H+
TERHENTI oleh karena selisih H+ filtrat dan sel tubulus terlalu tinggi. Nah kalo gitu berarti
seharusnya urin asam donk.. koq urin normal pH nya sekitar 7?? Jadi, untuk mencegah
terjadinya pH yang rendah dan menjamin tersedianya HCO3- ginjal melakukan dua
mekanisme, yaitu:
• Untuk menjamin tersedianya HCO3- dilakukan dengan cara semua HCO3
- diserap
kembali dan H+ yang disekresi berikatan dengan HPO4 2- → H2PO4
- dengan akibat
↑ keasaman urin dan ↓ pH urin.
• Untuk mencegah rendahnya pH, ginjal mensekresikan ammonia. Kenapa ammonia?
Karena NH3 itu kan basa, dan dia berperan sebagai buffer – Ya, dalam kondisi
asidosis, H+ banyak harus dikeluarin ke urine. Dengan adanya buffer, kan H+
dikeluarin dalam bentuk NH4+, sehingga lebih banyak lagi H+ yang dikeluarin sebelum
pH urine turun. Kalo ga di-buffer, H+ bakalan banyak di urine dan sangat menurunkan
pH urine. Kalo pH turun mendekati nilai 4.5, mekanisme segala macam pompa ion
yang ada di lumen tubulus bakalan rusak dan terganggu. Cara lain tubuh mengakali
supaya banyak H+ yang bisa dikeluarin adalah dengan buffer fosfat yang membantu
di dalam urine. Sekitar 30-50 mEq H+ digabungin sama amonia; sedangkan sekitar 10-
30 mEq H+ dinetralisir sama buffer fosfat. Amonia disekresi di sel tubular (rasanya di
tubulus bagian distal) dan laju sekresinya tergantung jumlah ion H+ yang harus
dieksreksi melalui sel tubular.
Di awal-awal udah dijelaskan ttg pengertian asidosis dan alkalosis. Asidosis terjadi jika pH
tubuh <7,35 sedangkan alkalosis terjadi jika pH tubuh >7,45. Kenapa bisa tubuh
mempertahankan pH nya? Bagaimana respon tubuh untuk mengatasi keadaan yang
menyimpang? Caranya seperti ini.. tubuh melakukan kompensasi yang merupakan respon
tubuh untuk menanggulangi ketidakseimbangan asam basa di dalam tubuh. Ada dua macam

12
kompensasi yang dilakukan oleh tubuh, yaitu kompensasi parsial dan sempurna.
Kompensasi dikatakan parsial jika pH setelah kompensasi masih diluar rentang normal, dan
dikatakan sempurna jika setelah kompensasi pH berada di rentang normal. Ditinjau dari
siapa yang melakukan kompensasi, terbagi menjadi kompensasi respiratorik apabila paru
melakukan modifikasi aktivitasnya untuk mengubah laju nafas misalnya (hiperventilasi,
hipoventilasi). Penyebabnya berarti dari metabolik – sementara itu kalo penyebebabnya itu
respiratorik, kompensasinya adalah kompensasi metabolik yang dilakukan terutama melalui
ginjal.
Gambar di atas menjelaskan mengenai kompensasi ketika terdapat kelebihan H+ di dalam
tubuh. Seperti yang dijelaskan sebelumnya, terdapat tiga cara untuk mengembalikan
keasaman tubuh ke tingkat yang normal, yaitu melalui system buffer tubuh, paru-paru, dan
ginjal.
System buffer akan mengikat kelebihan H+ yang ada di dalam tubuh. Paru-paru akan
mengkompensasi kelebihan asam dengan mengeluarkan CO2 ke luar tubuh. Sedangan ginjal
akan mengkompensasinya dengan banyak mensekresikan H+ dan dikeluarkan bersama urin.

13
Kalo gambar ini sebaliknya dari gambar yang tadi, yapz gambar ini menjelaskan mekanisme
tubuh ketika mengalami alkalosis (pengurangan kadar H+ di dalam tubuh). Nggak jauh
berbeda ma yang dilakuin ma tubuh ketika mendapatkan kelebihan asam yang tadi udah
dijelasin. Intinya mekanismenya ada tiga, yaitu yang pake buffer, paru, ma ginjal. Sistem
buffer berusaha buat melepaskan ion H +, paru akan berusaha buat negeluarin CO2 yang
sedikit, terus ginjal akan mengurangi sekresi H+nya.
kan ada rumus gini: pH = 6,10 + log �����
��
��, hubungannya ma asidosis / alkalosis metabolic/
respiratorik:
kalo asidosis atau alkalosis metabolic tu disebabkan oleh meningkat atau menurunnya kadar
HCO3 di dalam darah. Kalo asidosis atau alkalosis respiratorik disebabkan oleh penigkatan
atau penurunan tekanan CO2 di dalam darah.
Diitung2, dengan pH darah 7,4, didapetin bahwa log ( [HCO3-] / [H2CO3] ) itu 1,3. Karena
antilog 1,3 itu mendekati 20 jadinya konsentrasi HCO3- 20 kali lipat konsentrasi H2CO3. Nah,
nilai 1,3 perbandingan log ini bisa berubah kan? Kalo berubah maka pH ga lagi 7,4. Jadi, kalo
nilai [HCO3-]/[H2CO3] berkurang dari 20 (bisa karena HCO3- yang turun atau justru H2CO3 =
CO2 yang naek,), maka nilai log dari ini kurang dari 1,3 sehingga penjumlahan dengan 6,1
akan kurang dari 7,4 � asidosis. Sebaliknya, terjadi alkalosis. Ventilasi paru memegang
peranan yang besar dalam menciptakan kondisi asidosis/alkalosis respiratorik.

14
Gangguan asidosis/alkalosis metabolik paling umum sih karena: (1) produksi as. fixed/
organik yang ga bener , misal asidosis laktat (hipoksia jaringan berkepanjangan �
metabolisme anaerob � jadilah laktat dihasilin), misalnya pada pendaki gunung; selain
asidosis laktat bisa disebabin karena ketoasidosis (badan keton meningkat karena kelaparan
/ DM defisiensi insulin sehingga glukosa ga dimanfaatkan dan badan menghasilkan energi
dari metabolisme lipid dan keton yang disebut ketoasidosis); terus penyebab yang relative
jarang karena (2) gangguan ginjal contohnya glomerulonefritis yang nyebabin H+ enggak
disekresi; 3) kehilangan bikarbonat misalnya akibat diare kronik dan berkepajangan. Inget
pula bahwa HCO3- banyak dikeluarin ke lumen saluran cerna terutama oleh pankreas dan
empedu untuk netralisir efek H+ asam lambung kalo ga diserep karena tinja terlalu cepet
lewat akibatnya menurunkan ketersediaan buffer ini.
Kalo penyebab asidosis metabolic di slide dibagi menjadi yang disebabin oleh (1) anion yang
tidak terukur meningkat ma (2) anion yang tidak terukur normal. Anion yang tidak terukur
itu kayak albumin, fosfat, ma sulfat, nah kadar mereka tu meningkat dalam darah. Anion
yang tidak terukur meningkat itu bisa disebabin oleh Ketoasidosis diabetes, Payah ginjal
azotemia, Asidosis laktat , and Keracunan akibat salisilat, metil alkohol, paraldehid, etilen
glikol. Terus asidosis metabolic juga nggak hanya disebabkan oleh peningkatan anion yang
tidak terukur, tapi bisa oleh penyebab lain, antara lain: Diare dan fistula yg bersekresi,
Pemberian amonium klorida, Tubulus ginjal asidosis (proksimal & distal),
Uterosigmoidoskopi, Inhibitor karbonat anhidrase, Asidosis “expansion”.
Terus ada niy yang disebut dengan anion gap. Katanya konsep anion gap ini penting untuk
diagnosis keseimbangan asam basa. A = { [Na+] + [K+ ] } - { [Cl-] + [HCO3 - ] } . rumus ini buat
mengukur anion gap. Normalnya jumlah konsentrasi kation (Na+ ma K=) pasti lebih besar
daripada kadar anion (Cl- ma HCO3-). Pertanyaannya, kenapa yang digunakan Cuma
konsentrasi natrium, kalium, klorida, ma bikarbonat saja? Mana kayak ion fosfat dll? Itu
karena ion-ion ini adalah ion-ion yang terukur dalam pemeriksaan laboratorium. Normalnya
nilai dari anion gap adalah 12-16 mEq/L. terus bisa juga nilainya 8-12 mEq/L, tapi dengan syarat
kadar ion kaliumnya ga dihitung.

15
Tadi udah ngomongin tentang asidosis, sekarang saatnya ngomongin tentang alkalosis.
Penyebab alkalosis antara lain adalah kehilangan asam (muntah-muntah, drainase lambung),
pengobatan diuretika, alkalosis posthiperkapnia, sindroma kelebihan mineralo kortikoid:
aldosteronism, sindrom Cushing, sindrom Bartter, tumor yg mengekskresi ACTH, keracunan
licorice, pemberian alkali yangg berlebihan, kekurangan kalium yang berat, dan yang terakhir
karena alkalosis kontraksi.
Itulah dia tentir biokimia yang bisa kami buat.. kalo ad yang salah tolong langsung beritahu
ya..