Soal soal dan pembahasan struktur atom,materi dll
-
Upload
nabila-arifannisa -
Category
Education
-
view
4.812 -
download
7
description
Transcript of Soal soal dan pembahasan struktur atom,materi dll

Materi Pembelajaran :
SOAL STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR
REVIEW STRUKTUR ATOM DAN SPU KELAS X
1. Suatu unsur terdiri atas bagian terkecil yang tidak dapat dibagi-bagi lagi, dinamakan atom. Partikel dasar penyusun atom ada 3, yaitu proton, netron, dan elektron. Massa dan muatan dari ketiga partikel ini berturut-turut adalah ....
a. 1, +1; 1, 0; 0, -1
b. 1, -1; 1, +1; 0, +1
c. 1, 0; 0, 1; 0, -1
d. 0, +1; 1, 0; 0, -1
e. 0, -1, 1, 0; 1, -1
2. Suatu unsur X memiliki nomor atom 17 dan nomor massa 35, jumlah proton, netron, dan elektronnya berturut-turut adalah ....
a. 17, 17, 18
b. 17, 18, 17

c. 17, 18, 18
d. 18, 17, 17
e. 18, 17, 18
3. Menurut Niels Bohr, elektron mengelilingi inti pada tingkat-tingkat energi tertentu. Pernyataan yang sesuai dengan teori atom ini adalah ....
a. elektron paling dekat dengan inti memiliki tingkat energi terendah
b. makin tinggi tingkat energi suatu elektron, jaraknya terhadap inti makin dekat
c. elektron makin sulit lepas, jika kulit valensinya jauh dari inti atom
d. jumlah elektron maksimum pada setiap kulit adalah n2
e. n = 1 sebagai kulit K, merupakan tingkat energi tertinggi
4. Menurut Niels Bohr, konfigurasi elektron unsur-unsur A-17 dan B-19 adalah ....
a. (2,8,7) dan (2,8,9)
b. (2,8,2,5) dan (2,8,8,1)
c. (2,8,7) dan (2,8,8,1)
d. (2,2,8,5) dan (2,8,7)
e. (2,8,7) dan (2,9,8)
5. Secara umum, unsur-unsur dapat dikelompokkan menjadi logam dan non logam. Konfigurasi elektron atom dapat membedakan antara atom logam dan non logam. Konfigurasi elektron logam dan non logam berturut-turut adalah ....
a. (2,1) dan (2,8,1)
b. (2,8,1) dan (2,8,2)
c. (2,8,2) dan (2,8,7)
d. (2,8,7) DAN (2,8,8)
e. (2,1) dan (2,8,1)
6. Sistem periodik modern disusun berdasarkan kenaikan nomor atom, yang menunjukkan kenaikan jumlah proton. Karena suatu atom itu netral, maka jumlah elektron = jumlah proton. Sehingga dapat dikatakan bahwa ....
a. dalam satu perioda dari kiri ke kanan jumlah proton berkurang
b. dalam satu perioda dari kiri ke kanan jumlah netron tetap
c. dalam golongan dari atas ke bawah jumlah elektron bertambah

d. dalam satu golongan dari atas ke bawah nomor massa tetap
e. adanya kenaikan nomor atom mengakibatkan penurunan jumlah proton
7. Pernyataan berikut yang benar mengenai sistem periodik modern adalah ....
a. bentuknya memanjang karena golongan A dan B digabungkan
b. terdapat 7 perioda yang masing-masing berisi unsur-unsur yang sifatnya sama
c. unsur-unsur yang jumlah elektron valensinya sama terdapat dalam golongan yang sama
d. golongan A adalah golongan utama, sedang golongan B merupakan non logam
e. menurut IUPAC terdapat 8 golongan A dan 8 golongan B dengan jumlah unsur 16.
8. Suatu unsur tergolong logam, terdapat pada perioda ke tiga dalam sistem periodik. Kemungkinan untuk itu adalah ....
a. jumlah kulitnya 2
b. elektron valensinya 3
c. konfigurasi elektronnya (3,3)
d. nomor atomnya 11
e. nomor massanya = 22
9. Unsur X dengan nomor atom 19 dalam sistem periodik terletak pada ....
a. perioda 2 golongan VIIA
b. perioda 3 golongan IIIA
c. perioda 3 golongan VIIIB
d. perioda 4 golongan IA
e. perioda 4 golongan IB
10. Unsur-unsur dengan nomor atom 11, 12, 13 berturut-turut ....
a. jari-jarinya makin kecil
b. elektron valensinya berkurang
c. energi ionisasinya berkurang
d. sifat kelogamannya bertambah
e. makin mudah melepaskan elektron

SOAL REAKSI SENYAWA KARBON
1. Perhatikan persamaan reaksi berikut :(i) CH4 + Cl2 (UV) --> CHCl3 + HCl(iI) CH2 = CH-CH3 + HBr --> CH3-CHBr-CH3
(iiI) CH3 - CH2Cl + KOH (alkohol) --> CH2 = CH2 + KCl +H2OKetiga reaksi di atas berturut-turut adalah ....a. adisi, eliminasi, oksidasib. substitusi, adisi, eliminasic. eliminasi, oksidasi, substitusid. substitusi, oksidasi, reduksie. esterifikasi, adisi, reduksi
2. Jika etena diadisi dengan Br2 akan menghasilkan ....a. bromo etenab. dibromo etenac. dibromo etanad. 1,1-dibromo etanae. 1,2-dibromo etana
3. Suatu senyawa hidrokarbon tak jenuh mempunyai 4 atom C dan sebuah ikatan rangkap. Jika senyawa itu direaksikan dengan Cl2, menghasilkan 1,2-dikloro butana, maka senyawa alkena itu adalah ....a. n-butenab. 1-butenac. 2-butenad. cis 2-butenae. 2-metil propena
4. Adisi HBr pada 1-butena menghasilkan senyawa dengan rumus struktur ....a. CH3CHBrCH2CH3b. CH2Br(CH2)2CH3c. CH2BrCHBrCH2CH3d. CHBr2(CH2)2CH3e. CH3CBr2CH2CH3
5. Suatu senyawa hidrokarbon tak jenuh, X memiliki sebuah ikatan kovalen ganda. Pada adisi senyawa ini dengan Cl2 memerlukan 2 mol Cl2 untuk setiap mol senyawa tersebut. Pada reaksi ini tidak ada zat yang tersisa dan juga tidak ada hasil samping. Kemungkinan besar senyawa X adalah ....a. alkanab. alkenac. alkadienad. alkunae. sikloalkena
6. Ketika CH3CH2CH2OH direaksikan dengan PCl3, maka kemungkinan hasil reaksinya adalah ....a. propanol primerb propanol skunderc. 2-propanold. 1-kloro propanae. 2-kloro propana
7. Untuk membedakan alkohol dari eter, kedua bahan masing-masing direaksikan dengan zat X. Ternyata tabung yang berisi alkohol membentuk gas yang tidak berwarna dan tidak berbau. Sedang tabung yang berisi eter, setelah ditunggu beberapa saat, tidak terjadi perubahan. Dapat disimpulkan bahwa zat X adalah ....a. suatu logamb. suatu non logam

c. natrium atau magnesiumd. suatu larutan asam e. larutan garam
8. Ketela pohon jika diragikan akan menjadi makanan yang terkenal dengan nama 'tape' (bahasa Jawa). Jika tape ini dibiarkan, lama-lama rasanya menjadi masam. Pernyataan yang sesuai dengan kejadian di atas adalah .... a. perubahan di atas merupakan proses fermentasib. tape mengalami oksidasi menjadi asam asetatc. proses itu menunjukkan banyaknya kadar alkohol dalam taped. CH3COOH yang terdapat dalam tape berubah menjadi alkohole. Zat tepung dari ketela pohon semuanya berubah menjadi glukosa
9. Seseorang memeriksakan air kencingnya untuk mengetahui apakah dia terkena diabet (kencing manis). Untuk menguji adanya gula dalam air kencing tersebut digunakan larutan Fehling A dan B. Ternyata terjadi endapan merah bata. Endapan ini menunjukkan adanya gugus … dalam gula.a. -O-b. -OHc. -CHOd. -CO-e. -COO-
10. Pereaksi Tollens dapat digunakan untuk mengenal suatu bahan yang mengandung senyawa aldehid. Jika pereaksi ini dicampurkan ke bahan tersebut, kemudian dipanaskan perlahan-lahan, maka terbentuk suatu zat yang berkilau. Zat ini terkenal dengan sebutan ....a. cermin perakb. oksida perakc. garam perak d. perak beramoniake. tabung berwarna keperakan
11. Suatu senyawa karbon dengan rumus molekul C2H6O dapat bereaksi dengan logam natrium dan juga dengan PCl3. Berdasarkan hal ini, senyawa karbon tersebut mengandung gugus fungsi ....
a. – OH
b. – O –
c. – CO –
d. – COH
e. – CO2 –
12. Suatu senyawa X jika dioksidasi menghasilkan aseton. Kemungkinan terbesar senyawa X adalah ….
a. asetilen
b. propanol primer
c. asetaldehid

d. propanol skunder
e. asam asetat
13. Suatu senyawa X dioksidasi dengan KMnO4 suasana asam, menghasilkan suatu senyawa asam Y yang dapat bereaksi dengan NaOH membentuk senyawa garam Z. Kemungkinan senyawa-senyawa X, Y, Z berturut-turut adalah ....
a. kloro etana, asam asetat, natrium asetat
b. etanol, asam asetat, natrium asetat
c. etanol, asam etanoat, garam natrium
d. 1-propanol, asam propanoat, natrium asetat
e. 2-propanol, asam propanoat, natrium propanoat
14. Suatu senyawa karbon dengan rumus molekul C3H8O. Bila direaksikan dengan asam etanoat menghasilkan senyawa beraroma buah pir yang memiliki gugus fungsi ....
a. – OH an
b. – O –
c. – CO –
d. – COH
e. – CO2 –
15. Jika asam asetat direaksikan dengan alkohol yang memiliki 3 atom C, maka hasil reaksinya adalah ....
a. metil asetat
b. etil asetat
c. propil etanoat
d. etil propanoat
e. propil propanoat

SOAL HUKUM DASAR KIMIA
REVIEW HUKUM DASAR KIMIA
1. Hukum dasar kimia terdiri atas 3 (tiga) hukum tentang massa dan 2 (dua) hukum tentang volum gas serta jumlah molekul. Lavoisier, dalam hukum kekekalan massa, menyatakan bahwa dalam suatu reaksi kimia, massa zat-zat hasil reaksi sama dengan massa zat-zat yang bereaksi. Jika 10 gram kapur, CaCO3 dibakar di udara, massanya menjadi 5,6 gram. Kejadian ini disebabkan oleh ....
a. pada waktu kapur dibakar, menyerap gas CO2 dari udara
b. CO2 berwujud gas, sehingga tidak memenuhi hukum Lavoisier
c. semua reaksi pembakaran tidak mengikuti hukum Lavoisier
d. massa zat hasil reaksi lebih kecil, karena ada massa yang hilang
e. m CaCO3(s) 10g = m CaO(s) 5,6g + m CO2(g) 4,4g
2. Apabila serbuk besi dan serbuk belerang dicampur, ternyata besi masih dapat ditarik magnet. Namun pada waktu campuran itu dipanaskan, tampak ada bara yang menjalar sehingga terjadi zat baru berwarna hitam, yaitu besi sulfida. Jika 5,6 gram besi dicampur dengan 4 gram belerang, terdapat sisa belerang dan zat yang terbentuk massanya 8,8 gram. Alasan bahwa belerang tidak bereaksi semua adalah ....
a. serbuk belerang lebih ringan
b. belerang sukar bereaksi
c. belerang dan besi sama-sama padat
d. berapapun massa besi, selalu bereaksi semua
e. m Fe : m S yang membentuk besi sulfida selalu tetap
3. Ketika 6,5 gram seng dimasukkan ke dalam ruang berisi gas oksigen murni yang berlebihan, terbentuk 8,1 gram seng oksida. Pernyataan yang sesuai dengan kejadian ini adalah ....
a. massa oksigen yang bereaksi = massa seng oksida - massa seng
b. reaksi di atas memenuhi hukum Proust namun tidak mengikuti hukum Lavoisier
c. massa sebelum reaksi 6,5 g, sedang massa sesudah reaksi 8,1 g
d. oksigen berwujud gas, massanya tidak dapat diukur
e. massa zat sesudah reaksi = 8,1 gram
4. Sekelompok siswa melakukan percobaan hukum perbandingan tetap. Mereka mereaksikan tembaga dan belerang dengan massa yang sama. Dari data percobaan, mereka menyimpulkan bahwa ....
a. massa Cu : massa S berubah-ubah, karena m Cu diubah, m S juga berubah
b. m Cu : m S = 2 : 1, karena sisa massa S = setengah massa mula-mula

c. terbentuk zat berwarna hitam kekuningan, berarti semua zat habis bereaksi
d. massa hasil reaksi = massa tembaga + massa belerang yang dicampurkan
e. reaksi di atas memenuhi hukum perbandingan tetap, walaupun massa zat sebelum dan sesudah reaksi tidak sama
5. Karbon dan oksigen dapat membentuk dua macam senyawa, yaitu CO dan CO2. Menurut hukum kelipatan perbandingan dari Dalton, maka dinyatakan bahwa ...
a. massa karbon dan massa oksigen dalam kedua senyawa berbeda
b. massa karbon sama, massa oksigen dalam CO = 2 x massa oksigen dalam CO2
c. perbandingan massa karbon dan oksigen dalam kedua senyawa tetap
d. jika massa karbon sama, massa oksigen dalam CO dan CO2 berbanding sebagai bilangan bulat dan sederhana
e. massa gas CO dan gas CO2 sebanding dengan volumnya
6. Dua senyawa NO dan NO2, massa NO = 30 g dan massa NO2 = 46 g. Jika massa N dalam kedus senyawa 14 g, maka dapat disimpulkan bahwa ....
a. massa oksigen dalam NO sama dengan massa oksigen dalam NO2
b. massa oksigen dalam NO = 2 x massa oksigen dalam NO2
c. massa oksigen dalam NO : massa oksigen dalam NO2 = 1 : 2
d. massa oksigen dalam NO dan NO2 selalu dapat berubah
e. massa nitrogen dalam NO dan NO2 selalu tetap
7. Seorang kimiawan melakukan percobaan dengan membakar gas hidrogen dengan gas klor dalam volum yang sama pada temperatur tertentu. Beliau membuat pernyataan yang mengacu pada hukum perbandingan volum dari Gay Lussac. Pernyataan yang sesuai dengan hukum Gay Lussac adalah ....
a. perbandingan volum gas yang terlibat dalam reaksi = perbandingan massa
b. volum gas pereaksi dan volum gas produk berbanding sebagai bilangan bulat dan sederhana, jika diukur pada P dan T yang sama
c. V gas hidrogen : V gas klor : V gas hidrogen klorida = 2 : 2 : 1
d. volum gas klor yang bereaksi = 2 x volum gas hidrogen
e. reaksi di atas tidak memenuhi hukum perbandingan volum, karena kedua gas habis bereaksi
8. Jika 100 cm3 H2(g) dicampur dengan 200 cm3 I2(g) pada (T, P) tertentu, maka data yang dapat diperoleh adalah ....
a. terbentuk 300 cm3 HI(g)

b. terdapat sisa I2(g) sebanyak 100 cm3 (P, T)
c. H2(g) yang bereaksi = 50 cm3 (P, T)
d. kedua gas habis bereaksi
e. setelah reaksi terdapat 200 cm3 gas (P, T)
9. Suatu senyawa hidrokarbon CH4xHy(g) sebanyak 2 dm3 (P, T) terbakar sempurna dengan 5 dm3 gas oksigen dan membentuk 4 dm3 gad CO2. Rumus kimia CxHy adalah ....
a. CH4
b. C2H2
c. C2H4
d. C2H6
e. C3H6
10. Sejumlah gas N2 dicampur dengan gas H2 membentuk gas NH3 pada T dan P tertentu, Jika volum kedua gas yang dicampur sama, maka gas NH3 yang terbentuk sebesar 2 x 1020 molekul. Ini berarti bahwa ....
a. V setelah reaksi = N2 : V H2 : V NH3 = 1 : 1 : 2
b. N2(g) dan H2(g) masing-masing mengandung 1020 molekul
c. V N2 : V H2 yang bereaksi = 1 : 2
d. jumlah gas yang dicampur sebelum reaksi = 6 x 1020 molekul
e. jumlah gas setelah reaksi = 3 x 1020 molekul
SOAL STRUKTUR ATOM KELAS X
SOAL PILIHAN GANDASTRUKTUR ATOM KELASX
1.Belerang dengan notasi S, berarti dalam atom unsur tersebut terdapat ….a.16 proton, 14 elektron dan 14 netronb.14 proton, 16 elektron dan 30 netronc.30 proton, 30 elektron dan 16 netrond.16 proton, 16 elektron dan 14 netrone.16 proton, 16 elektron dan 30 netron
2.Suatu unsur X; jika membentuk ion X3+, maka terdapat ....a.76 elektron di sekitar intib.76 proton di dalam intic.79 elektron di sekitar intid.79 netron di dalam intie.82 proton di dalam inti

3.Perhatikan atom-atom berikut: 8P15; 7Q15; 6R14; dan 7S14. Atom yang merupakan isotop adalah ….a.P dan Qb.R dan Sc.P dan Rd.Q dan Se.A dan D
4.Unsur 17A mempunyai kulit elektron sebanyak ….a.1b.2c.3d.4e.5
5.Ion X2+ mempunyai konfigurasi elektron 2, 8, 8. Nomor atom X adalah ….a.16b.18c.19d.20e.22
6.Ion X-2 mempunyai konfigurasi elektron 2, 8, 8. Nomor atom X adalah ….a.16b.17c.18d.20e.22
7.Jika atom X mempunyai elektron valensi 7 pada kulit N, maka nomer atom X adalah ….a.25b.27c.32d.35e.38
8.Suatu atom A dengan konfigurasi elektron 2, 8, 8, 2, maka ….a.nomer atom A = 10b.massa atom A = 20c.ion A2+ mempunyai 20 elektrond.nomer atom dan nomer massa A = 20e.nomer atom A = 20
9.Suatu atom mempunyai tiga kulit elektron dan lima elektron valensi serta mempunyai 16 netron, maka nomor atom dan nomor massa unsur tersebut adalah ….a.15 dan 16b.13 dan 31c.15 dan 31d.31 dan 13e.16 dan 15
10.Konfigurasi elektron berikut yang tidak dijumpai pada suatu atom adalah ….a.2e, 8e, 5e d. 2e, 8e, 8eb.2e, 8e, 6e e. 2e, 8e, 9ec.2e, 8e, 7e
11.Atom Al memiliki 13 elektron, kofigurasi elektron ion Al3+ adalah ….a.2e, 8e d.2e, 8e, 3eb.2e, 8e, 1e e.2e, 8e, 6e

c.2e, 8e, 2e
12.Unsur boron yang terdapat di alam terdiri atas dua jenis isotop dengan kelimpahan isotop I = 20% dan isotop II = 80%. Massa atom relatif yang memungkinkan adalah ….a. 10,0 b. 10,2 c. 10,5d. 10,8e. 11,0
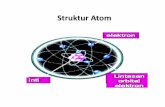
Struktur Atom...
Struktur Lewis
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
Langsung ke: navigasi, cari
Contoh model titik Lewis yang menggambarkan ikatan kimia anatara karbon C, hidrogen H, dan oksigen O. Penggambaran titik lewis adalah salah satu dari usaha awal kimiawan dalam menjelaskan ikatan kimia dan masih digunakan secara luas sampai sekarang.
Struktur Lewis adalah diagram yang menunjukkan ikatan-ikatan antar atom dalam suatu molekul. Struktur Lewis digunakan untuk menggambarkan ikatan kovalen dan ikatan kovalen koordinat.
Struktur Lewis dikembangkan oleh Gilbert N. Lewis.

Ikatan kimia
Ikatan kimia adalah sebuah proses fisika yang bertanggung jawab dalam interaksi gaya tarik menarik antara dua atom atau molekul yang menyebabkan suatu senyawa diatomik atau poliatomik menjadi stabil. Penjelasan mengenai gaya tarik menarik ini sangatlah rumit dan dijelaskan oleh elektrodinamika kuantum. Dalam prakteknya, para kimiawan biasanya bergantung pada teori kuantum atau penjelasan kualitatif yang kurang kaku (namun lebih mudah untuk dijelaskan) dalam menjelaskan ikatan kimia. Secara umum, ikatan kimia yang kuat diasosiasikan dengan transfer elektron antara dua atom yang berpartisipasi. Ikatan kimia menjaga molekul-molekul, kristal, dan gas-gas diatomik untuk tetap bersama. Selain itu ikatan kimia juga menentukan struktur suatu zat.
Kekuatan ikatan-ikatan kimia sangatlah bervariasi. Pada umumnya, ikatan kovalen dan ikatan ion dianggap sebagai ikatan "kuat", sedangkan ikatan hidrogen dan ikatan van der Waals dianggap sebagai ikatan "lemah". Hal yang perlu diperhatikan adalah bahwa ikatan "lemah" yang paling kuat dapat lebih kuat daripada ikatan "kuat" yang paling lemah.
Tinjauan
Dalam gambaran yang paling sederhana dari ikatan non-polar atau ikatan kovalen, satu atau lebih elektron, biasanya berpasangan, ditarik menuju sebuah wilayah diantara dua inti atom. Gaya ini dapat mengatasi gaya tolak menolak antara dua inti atom yang positif, sehingga atraksi ini menjaga kedua atom untuk tetap bersama, walaupun keduanya masih akan tetap bergetar dalam keadaan kesetimbangan. Ringkasnya, ikatan kovalen melibatkan elektron-elektron yang dikongsi dan dua atau lebih inti atom yang bermuatan positif secara bersamaan menarik elektron-elektron bermuatan negatif yang dikongsi.
Dalam gambaran ikatan ion yang disederhanakan, inti atom yang bermuatan positif secara dominan melebihi muatan positif inti atom lainnya, sehingga secara efektif menyebabkan satu atom mentransfer elektronnya ke atom yang lain. Hal ini menyebabkan satu atom bermuatan positif dan yang lainnya bermuatan negatif secara keseluruhan. Ikatan ini dihasilkan dari atraksi elektrostatik di antara atom-atom dan atom-atom tersebut menjadi ion-ion yang bermuatan.
Semua bentuk ikatan dapat dijelaskan dengan teori kuantum, namun dalam prakteknya, kaidah-kaidah yang disederhanakan mengijinkan para kimiawan untuk memprediksikan kekuatan, arah, dan polaritas sebuah ikatan. Kaidah oktet (Bahasa Inggris: octet rule) dan teori VSEPR adalah dua contoh kaidah yang disederhanakan tersebut. Ada pula teori-teori yang lebih canggih, yaitu teori ikatan valens yang meliputi hibridisasi orbital dan resonans, dan metode orbital molekul kombinasi linear orbital atom (Bahasa Inggris: Linear combination of atomic orbitals molecular orbital method) yang meliputi teori medan ligan. Elektrostatika digunakan untuk menjelaskan polaritas ikatan dan efek-efeknya terhadap zat-zat kimia.

Sejarah
Spekulasi awal dari sifat-sifat ikatan kimia yang berawal dari abad ke-12 mengganggap spesi kimia tertentu disatukan oleh sejenis afinitas kimia. Pada tahun 1704, Isaac Newton menggarisbesarkan teori ikatan atomnya pada "Query 31" buku Opticksnya dengan mengatakan atom-atom disatukan satu sama lain oleh "gaya" tertentu.
Pada tahun 1819, setelah penemuan tumpukan volta, Jöns Jakob Berzelius mengembangkan sebuah teori kombinasi kimia yang menekankan sifat-sifat elektrogenativitas dan elektropositif dari atom-atom yang bergabung. Pada pertengahan abad ke-19 Edward Frankland, F.A. Kekule, A.S. Couper, A.M. Butlerov, dan Hermann Kolbe, beranjak pada teori radikal, mengembangkan teori valensi yang pada awalnya disebut "kekuatan penggabung". Teori ini mengatakan sebuah senyawa tergabung berdasarkan atraksi kutub positif dan kutub negatif. Pada tahun 1916, kimiawan Gilbert N. Lewis mengembangkan konsep ikatan elektron berpasangan. Konsep ini mengatakan dua atom dapat berkongsi satu sampai enam elektron, membentuk ikatan elektron tunggal, ikatan tunggal, ikatan rangkap dua, atau ikatan rangkap tiga.
Dalam kata-kata Lewis sendiri:
“ An electron may form a part of the shell of two different atoms and cannot be said to belong to either one exclusively. ”
Pada tahun yang sama, Walther Kossel juga mengajukan sebuah teori yang mirip dengan teori Lewis, namun model teorinya mengasumsikan transfer elektron yang penuh antara atom-atom. Teori ini merupakan model ikatan polar. Baik Lewis dan Kossel membangun model ikatan mereka berdasarkan kaidah Abegg (1904).
Pada tahun 1927, untuk pertama kalinya penjelasan matematika kuantum yang penuh atas ikatan kimia yang sederhana berhasil diturunkan oleh fisikawan Denmark Oyvind Burrau.[1] Hasil kerja ini menunjukkan bahwa pendekatan kuantum terhadap ikatan kimia dapat secara mendasar dan kuantitatif tepat. Namun metode ini tidak mampu dikembangkan lebih jauh untuk menjelaskan molekul yang memiliki lebih dari satu elektron. Pendekatan yang lebih praktis namun kurang kuantitatif dikembangkan pada tahun yang sama oleh Walter Heitler and Fritz London. Metode Heitler-London menjadi dasar dari teori ikatan valensi. Pada tahun 1929, metode orbital molekul kombinasi linear orbital atom (Bahasa

Inggris: linear combination of atomic orbitals molecular orbital method), disingkat LCAO, diperkenalkan oleh Sir John Lennard-Jones yang bertujuan menurunkan struktur elektronik dari molekul F2 (fluorin) dan O2 (oksigen) berdasarkan prinsip-prinsip dasar kuantum. Teori orbital molekul ini mewakilkan ikatan kovalen sebagai orbital yang dibentuk oleh orbital-orbital atom mekanika kuantum Schrödinger yang telah dihipotesiskan untuk atom berelektron tunggal. Persamaan ikatan elektron pada multielektron tidak dapat diselesaikan secara analitik, namun dapat dilakukan pendekatan yang memberikan hasil dan prediksi yang secara kualitatif cukup baik. Kebanyakan perhitungan kuantitatif pada kimia kuantum modern menggunakan baik teori ikatan valensi maupun teori orbital molekul sebagai titik awal, walaupun pendekatan ketiga, teori fungsional rapatan (Bahasa Inggris: density functional theory), mulai mendapatkan perhatian yang lebih akhir-akhir ini.
Pada tahun 1935, H. H. James dan A. S. Coolidge melakukan perhitungan pada molekul dihidrogen.Berbeda dengan perhitungan-perhitungan sebelumnya yang hanya menggunakan fungsi-fungsi jarak antara elektron dengan inti atom, mereka juga menggunakan fungsi yang secara eksplisit memperhitungkan jarak antara dua elektron.[2] Dengan 13 parameter yang dapat diatur, mereka mendapatkan hasil yang sangat mendekati hasil yang didapatkan secara eksperimen dalam hal energi disosiasi. Perluasan selanjutnya menggunakan 54 parameter dan memberikan hasil yang sangat sesuai denganhasil eksperimen. Perhitungan ini meyakinkan komunitas sains bahwa teori kuantum dapat memberikan hasil yang sesuai dengan hasil eksperimen. Namun pendekatan ini tidak dapat memberikan gambaran fisik seperti yang terdapat pada teori ikatan valensi dan teori orbital molekul. Selain itu, ia juga sangat sulit diperluas untuk perhitungan molekul-molekul yang lebih besar.
Teori ikatan valensi
Pada tahun 1927, teori ikatan valensi dikembangkan atas dasar argumen bahwa sebuah ikatan kimia terbentuk ketika dua valensi elektron bekerja dan menjaga dua inti atom bersama oleh karena efek penurunan energi sistem. Pada tahun 1931, beranjak dari teori ini, kimawan Linus Pauling mempublikasikan jurnal ilmiah yang dianggap sebagai jurnal paling penting dalam sejarah kimia: "On the Nature of the Chemical Bond". Dalam jurnal ini, berdasarkan hasil kerja Lewis dan teori valensi ikatan Heitler dan London, dia mewakilkan enam aturan pada ikatan elektron berpasangan:
1. Ikatan elektron berpasangan terbentuk melalui interaksi elektron tak-berpasangan pada masing-masing atom.2. Spin-spin elektron haruslah saling berlawanan.3. Seketika dipasangkan, dua elektron tidak bisa berpartisipasi lagi pada ikatan lainnya.4. Pertukaran elektron pada ikatan hanya melibatkan satu persamaan gelombang untuk setiap atom.5. Elektron-elektron yang tersedia pada aras energi yang paling rendah akan membentuk ikatan-ikatan yang paling kuat.6. Dari dua orbital pada sebuah atom, salah satu yang dapat bertumpang tindih paling banyaklah yang akan membentuk ikatan paling kuat, dan ikatan ini akan cenderung berada pada arah orbital yang terkonsentrasi.

Buku teks tahun 1939 Pauling: On the Nature of Chemical Bond menjadi apa yang banyak orang sebut sebagai "kitab suci" kimia modern. Buku ini membantu kimiawan eksperimental untuk memahami dampak teori kuantum pada kimia. Namun, edisi 1959 selanjutnya gagal untuk mengalamatkan masalah yang lebih mudah dimengerti menggunakan teori orbital molekul. Dampak dari teori valensi ini berkurang sekitar tahun 1960-an dan 1970-an ketika popularitas teori orbital molekul meningkat dan diimplementasikan pada beberapa progam komputer yang besar. Sejak tahun 1980-an, masalah implementasi teori ikatan valensi yang lebih sulit pada program-program komputer telah hampir dipecahkan dan teori ini beranjak bangkit kembali.
Teori orbital molekulTeori orbital molekul (Bahasa Inggris: Molecular orbital tehory), disingkat MO, menggunakan
kombinasi linear orbital-orbital atom untuk membentuk orbital-orbital molekul yang menrangkumi seluruh molekul. Semuanya ini seringkali dibagi menjadi orbital ikat, orbital antiikat, dan orbital bukan-ikatan. Orbital molekul hanyalah sebuah orbital Schrödinger yang melibatkan beberapa inti atom. Jika orbital ini merupakan tipe orbital yang elektron-elektronnya memiliki kebolehjadian lebih tinggi berada di antara dua inti daripada di lokasi lainnya, maka orbital ini adalah orbital ikat dan akan cenderung menjaga kedua inti bersama. Jika elektron-elektron cenderung berada di orbital molekul yang berada di lokasi lainnya, maka orbital ini adalah orbital antiikat dan akan melemahkan ikatan. Elektron-elektron yang berada pada orbital bukan-ikatan cenderung berada pada orbital yang paling dalam (hampir sama dengan orbital atom), dan diasosiasikan secara keseluruhan pada satu inti. Elektron-elektron ini tidak menguatkan maupun melemahkan kekuatan ikatan.
Perbandingan antara teori ikatan valensi dan teori orbital molekul
Pada beberapa bidang, teori ikatan valensi lebih baik daripada teori orbital molekul. Ketika diaplikasikan pada molekul berelektron dua, H2, teori ikatan valensi, bahkan dengan pendekatan Heitler-London yang paling sederhana, memberikan pendekatan energi ikatan yang lebih dekat dan representasi yang lebih akurat pada tingkah laku elektron ketika ikatan kimia terbentuk dan terputus. Sebaliknya, teori orbital molekul memprediksikan bahwa molekul hidrogen akan berdisosiasi menjadi superposisi linear dari hidrogen atom dan ion hidrogen positif dan negatif. Prediksi ini tidak sesuai dengan gambaran fisik. Hal ini secara sebagian menjelaskan mengapa kurva energi total terhadap jarak antar atom pada metode ikatan valensi berada di atas kurva yang menggunakan metode orbital molekul. Situasi ini terjadi pada semua molekul diatomik homonuklir dan tampak dengan jelas pada F2 ketika energi minimum pada kurva yang menggunakan teori orbital molekul masih lebih tinggi dari energi dua atom F.
Konsep hibridisasi sangatlah berguna dan variabilitas pada ikatan di kebanyakan senyawa organik sangatlah rendah, menyebabkan teori ini masih menjadi bagian yang tak terpisahkan dari kimia organik. Namun, hasil kerja Friedrich Hund, Robert Mulliken, dan Gerhard Herzberg menunjukkan bahwa teori orbital molekul memberikan deskripsi yang lebih tepat pada spektrokopi, ionisasi, dan sifat-sifat magnetik molekul. Kekurangan teori ikatan valensi

menjadi lebih jelas pada molekul yang berhipervalensi (contohnya PF5) ketika molekul ini dijelaskan tanpa menggunakan orbital-orbital d yang sangat krusial dalam hibridisasi ikatan yang diajukan oleh Pauling. Logam kompleks dan senyawa yang kurang elektron (seperti diborana) dijelaskan dengan sangat baik oleh teori orbital molekul, walaupun penjelasan yang menggunakan teori ikatan valensi juga telah dibuat.
Pada tahun 1930, dua metode ini saling bersaing sampai disadari bahwa keduanya hanyalah merupakan pendekatan pada teori yang lebih baik. Jika kita mengambil struktur ikatan valensi yang sederhana dan menggabungkan semua struktur kovalen dan ion yang dimungkinkan pada sekelompok orbital atom, kita mendapatkan apa yang disebut sebagai fungsi gelombang interaksi konfigurasi penuh. Jika kita mengambil deskripsi orbital molekul sederhana pada keadaan dasar dan mengkombinasikan fungsi tersebut dengan fungsi-fungsi yang mendeskripsikan keseluruhan kemungkinan keadaan tereksitasi yang menggunakan orbital tak terisi dari sekelompok orbital atom yang sama, kita juga mendapatkan fungsi gelombang interaksi konfigurasi penuh. Terlihatlah bahwa pendekatan orbital molekul yang sederhana terlalu menitikberatkan pada struktur ion, sedangkan pendekatan teori valensi ikatan yang sederhana terlalu sedikit menitikberatkan pada struktur ion. Dapat kita katakan bahwa pendekatan orbital molekul terlalu ter-delokalisasi, sedangkan pendekatan ikatan valensi terlalu ter-lokalisasi.
Sekarang kedua pendekatan tersebut dianggap sebagai saling memenuhi, masing-masing memberikan pandangannya sendiri terhadap masalah-masalah pada ikatan kimia. Perhitungan modern pada kimia kuantum biasanya dimulai dari (namun pada akhirnya menjauh) pendekatan orbital molekul daripada pendekatan ikatan valensi. Ini bukanlah karena pendekatan orbital molekul lebih akurat dari pendekatan teori ikatan valensi, melainkan karena pendekatan orbital molekul lebih memudahkan untuk diubah menjadi perhitungan numeris. Namun program-progam ikatan valensi yang lebih baik juga tersedia.
Ikatan dalam rumus kimia
Bentuk atom-atom dan molekul-molekul yang 3 dimensi sangatlah menyulitkan dalam menggunakan teknik tunggal yang mengindikasikan orbital-orbital dan ikatan-ikatan. Pada rumus molekul, ikatan kimia (orbital yang berikatan) diindikasikan menggunakan beberapa metode yang bebeda tergantung pada tipe diskusi. Kadang-kadang kesemuaannya dihiraukan. Sebagai contoh, pada kimia organik, kimiawan biasanya hanya peduli pada gugus fungsi molekul. Oleh karena itu, rumus molekul etanol dapat ditulis secara konformasi, 3-dimensi, 2-dimensi penuh (tanpa indikasi arah ikatan 3-dimensi), 2-dimensi yang disingkat (CH3–CH2–OH), memisahkan gugus fungsi dari bagian molekul lainnnya (C2H5OH), atau hanya dengan konstituen atomnya saja (C2H6O). Kadangkala, bahkan kelopak valensi elektron non-ikatan (dengan pendekatan arah yang digambarkan secara 2-dimensi) juga ditandai. Beberapa kimiawan juga menandai orbital-orbital atom, sebagai contoh anion etena−4 yang dihipotesiskan (\
/C=C/\ −4) mengindikasikan kemungkinan pembentukan ikatan.
Ikatan kuat kimiaPanjang ikat dalam pmdan energi ikat dalam kJ/mol.Panjang ikat dapat dikonversikan menjadi Ådengan pembagian dengan 100 (1 Å = 100 pm).

Data diambil dari [1].
IkatanPanjang
(pm)Energi
(kJ/mol)
H — Hidrogen
H–H 74 436
H–C 109 413
H–N 101 391
H–O 96 366
H–F 92 568
H–Cl 127 432
H–Br 141 366
C — Karbon
C–H 109 413
C–C 154 348
C=C 134 614
C≡C 120 839
C–N 147 308
C–O 143 360
C–F 135 488
C–Cl 177 330
C–Br 194 288
C–I 214 216
C–S 182 272
N — Nitrogen
N–H 101 391

N–C 147 308
N–N 145 170
N≡N 110 945
O — Oksigen
O–H 96 366
O–C 143 360
O–O 148 145
O=O 121 498
F, Cl, Br, I — Halogen
F–H 92 568
F–F 142 158
F–C 135 488
Cl–H 127 432
Cl–C 177 330
Cl–Cl 199 243
Br–H 141 366
Br–C 194 288
Br–Br 228 193
I–H 161 298
I–C 214 216
I–I 267 151
S — Belerang
C–S 182 272
Ikatan-ikatan berikut adalah ikatan intramolekul yang mengikat atom-atom bersama menjadi molekul. Dalam pandangan yang sederhana dan terlokalisasikan, jumlah elektron yang

berpartisipasi dalam suatu ikatan biasanya merupakan perkalian dari dua, empat, atau enam. Jumlah yang berangka genap umumnya dijumpai karena elektron akan memiliki keadaan energi yang lebih rendah jika berpasangan. Teori-teori ikatan yang lebih canggih menunjukkan bahwa kekuatan ikatan tidaklah selalu berupa angka bulat dan tergantung pada distribusi elektron pada setiap atom yang terlibat dalam sebuah ikatan. Sebagai contohnya, karbon-karbon dalam senyawa benzena dihubungkan satu sama lain oleh ikatan 1.5 dan dua atom dalam nitrogen monoksida NO dihubungkan oleh ikatan 2,5. Keberadaan ikatan rangkap empat juga diketahui dengan baik. Jenis-jenis ikatan kuat bergantung pada perbedaan elektronegativitas dan distribusi orbital elektron yang tertarik pada suatu atom yang terlibat dalam ikatan. Semakin besar perbedaan elektronegativitasnya, semakin besar elektron-elektron tersebut tertarik pada atom yang berikat dan semakin bersifat ion pula ikatan tersebut. Semakin kecil perbedaan elektronegativitasnya, semakin bersifat kovalen ikatan tersebut.
Ikatan kovalen
Ikatan kovalen adalah ikatan yang umumnya sering dijumpai, yaitu ikatan yang perbedaan elektronegativitas (negatif dan positif) di antara atom-atom yang berikat sangatlah kecil atau hampir tidak ada. Ikatan-ikatan yang terdapat pada kebanyakan senyawa organik dapat dikatakan sebagai ikatan kovalen. Lihat pula ikatan sigma dan ikatan pi untuk penjelasan LCAO terhadap jenis ikatan ini.
Ikatan polar kovalen
Ikatan polar kovalen merupakan ikatan yang sifat-sifatnya berada di antara ikatan kovalen dan ikatan ion.
Ikatan ion
Ikatan ion merupakan sejenis interaksi elektrostatik antara dua atom yang memiliki perbedaan elektronegativitas yang besar. Tidaklah terdapat nilai-nilai yang pasti yang membedakan ikatan ion dan ikatan kovalen, namun perbedaan elektronegativitas yang lebih besar dari 2,0 bisanya disebut ikatan ion, sedangkan perbedaan yang lebih kecil dari 1,5 biasanya disebut ikatan kovalen.[3] Ikatan ion menghasilkan ion-ion positif dan negatif yang berpisah. Muatan-muatan ion ini umumnya berkisar antara -3 e sampai dengan +3e.
Ikatan kovalen koordinat
Ikatan kovalen koordinat, kadangkala disebut sebagai ikatan datif, adalah sejenis ikatan kovalen yang keseluruhan elektron-elektron ikatannya hanya berasal dari salah satu atom, penderma pasangan elektron, ataupun basa Lewis. Konsep ini mulai ditinggalkan oleh para kimiawan seiring dengan berkembangnya teori orbital molekul. Contoh ikatan kovalen koordinat terjadi pada nitron dan ammonia borana. Susunan ikatan ini berbeda dengan ikatan ion pada perbedaan elektronegativitasnya yang kecil, sehingga menghasilkan ikatan yang kovalen. Ikatan ini biasanya ditandai dengan tanda panah. Ujung panah ini menunjuk pada akseptor elektron atau asam Lewis dan ekor panah menunjuk pada penderma elektron atau basa Lewis
Ikatan pisang

Ikatan pisang adalah sejenis ikatan yang terdapat pada molekul-molekul yang mengalami terikan ataupun yang mendapat rintangan sterik, sehingga orbital-orbital ikatan tersebut dipaksa membentuk struktur ikatan yang mirip dengan pisang. Ikatan pisang biasanya lebih rentan mengalami reaksi daripada ikatan-ikatan normal lainnya.
Ikatan 3c-2e dan 3c-4e
Dalam ikatan tiga-pusat dua-elektron, tiga atom saling berbagi dua elektron. Ikatan sejenis ini terjadi pada senyawa yang kekurangan elektron seperti pada diborana. Setiap ikatan mengandung sepasang elektron yang menghubungkan atom boron satu sama lainnya dalam bentuk pisang dengan sebuah proton (inti atom hidrogen) di tengah-tengah ikatan, dan berbagi elektron dengan kedua atom boron. Terdapat pula Ikatan tiga-pusat empat-elektron yang menjelaskan ikatan pada molekul hipervalen.
Ikatan tiga elektron dan satu elektron
Ikatan-ikatan dengan satu atau tiga elektron dapat ditemukan pada spesi radikal yang memiliki jumlah elektron gasal (ganjil). Contoh paling sederhana dari ikatan satu elektron dapat ditemukan pada kation molekul hidrogen H2
+. Ikatan satu elektron seringkali memiliki energi ikat yang setengah kali dari ikatan dua elektron, sehingga ikatan ini disebut pula "ikatan setengah". Namun terdapat pengecualian pada kasus dilitium. Ikatan dilitium satu elektron, Li2
+, lebih kuat dari ikatan dilitium dua elektron Li2. Pengecualian ini dapat dijelaskan dengan hibridisasi dan efek kelopak dalam. [4]
Contoh sederhana dari ikatan tiga elektron dapat ditemukan pada kation dimer helium, He2
+, dan dapat pula dianggap sebagai "ikatan setengah" karena menurut teori orbital molekul, elektron ke-tiganya merupakan orbital antiikat yang melemahkan ikatan dua elektron lainnya sebesar setengah. Molekul oksigen juga dapat dianggap memiliki dua ikatan tiga elektron dan satu ikatan dua elektron yang menjelaskan sifat paramagnetiknya.[5]
Molekul-molekul dengan ikatan elektron gasal biasanya sangat reaktif. Ikatan jenis ini biasanya hanya stabil pada atom-atom yang memiliki elektronegativitas yang sama.[5]
Ikatan aromatik
Pada kebanyakan kasus, lokasi elektron tidak dapat ditandai dengan menggunakan garis (menandai dua elektron) ataupun titik (menandai elektron tungga). Ikatan aromatik yang terjadi pada molekul yang berbentuk cincin datar menunjukkan stabilitas yang lebih.
Pada benzena, 18 elektron ikatan mengikat 6 atom karbon bersama membentuk struktur cincin datar. "Orde" ikatan antara dua atom dapat dikatakan sebagai (18/6)/2=1,5 dan seluruh ikatan pada benzena tersebut adalah identik. Ikatan-ikatan ini dapat pula ditulis sebagai ikatan tunggal dan rangkap yang berselingan, namun hal ini kuranglah tepat mengingat ikatan rangkap dan ikatan tunggal memiliki kekuatan ikatan yang berbeda dan tidak identik.
Ikatan logam

Pada ikatan logam, elektron-elektron ikatan terdelokalisasi pada kekisi (lattice) atom. Berbeda dengan senyawa organik, lokasi elektron yang berikat dan muatannya adalah statik. Oleh karena delokalisai yang menyebabkan elektron-elektron dapat bergerak bebas, senyawa ini memiliki sifat-sifat mirip logam dalam hal konduktivitas, duktilitas, dan kekerasan.
Ikatan antarmolekul
Terdapat empat jenis dasar ikatan yang dapat terbentuk antara dua atau lebih molekul, ion, ataupun atom. Gaya antarmolekul menyebabkan molekul saling menarik atau menolak satu sama lainnya. Seringkali hal ini menentukan sifat-sifat fisik sebuah zat (seperti pada titik leleh).
Dipol permanen ke dipol permanen
Perbedaan elektronegativitas yang bersar antara dua atom yang berikatan dengan kuat menyebabkan terbentuknya dipol (dwikutub). Dipol-dipol ini akan saling tarik-menarik ataupun tolak-menolak.
Ikatan hidrogen
Ikatan hidrogen bisa dikatakan sebagai dipol permanen yang sangat kuat seperti yang dijelaskan di atas. Namun, pada ikatan hidrogen, proton hidrogen berada sangat dekat dengan atom penderma elektron dan mirip dengan ikatan tiga-pusat dua-elektron seperti pada diborana. Ikatan hidrogen menjelaskan titik didih zat cair yang relatif tinggi seperti air, ammonia, dan hidrogen fluorida jika dibandingkan dengan senyawa-senyawa yang lebih berat lainnya pada kolom tabel periodik yang sama.
Dipol seketika ke dipol terimbas (van der Waals)
Dipol seketika ke dipol terimbas, atau gaya van der Waals, adalah ikatan yang paling lemah, namun sering dijumpai di antara semua zat-zat kimia. Misalnya atom helium, pada satu titik waktu, awan elektronnya akan terlihat tidak seimbang dengan salah satu muatan negatif berada di sisi tertentu. Hal ini disebut sebagai dipol seketika (dwikutub seketika). Dipol ini dapat menarik maupun menolak elektron-elektron helium lainnya, dan menyebabkan dipol lainnya. Kedua atom akan seketika saling menarik sebelum muatannya diseimbangkan kembali untuk kemudian berpisah.
Interaksi kation-pi
Interaksi kation-pi terjadi di antara muatan negatif yang terlokalisasi dari elektron-elektron pada orbital π dengan muatan positif.
Elektron pada ikatan kimia
Banyak senyawa-senyawa sederhana yang melibatkan ikatan-ikatan kovalen. Molekul-molekul ini memiliki struktur yang dapat diprediksi dengan menggunakan teori

ikatan valensi, dan sifat-sfiat atom yang terlibat dapat dipahami menggunakan konsep bilangan oksidasi. Senyawa lain yang mempunyai struktur ion dapat dipahami dengan menggunakan teori-teori fisika klasik.
Pada kasus ikatan ion, elektron pada umumnya terlokalisasi pada atom tertentu, dan elektron-elektron todal bergerak bebas di antara atom-atom. Setiap atom ditandai dengan muatan listrik keseluruhan untuk membantu pemahaman kita atas konsep distribusi orbital molekul. Gaya antara atom-atom secara garis besar dikarakterisasikan dengan potensial elektrostatik kontinum (malaran) isotropik.
Sebaliknya pada ikatan kovalen, rapatan elektron pada sebuah ikatan tidak ditandai pada atom individual, namun terdelokalisasikan pada MO di antara atom-atom. Teori kombinasi linear orbital yang diterima secara umum membantu menjelaskan struktur orbital dan energi-energinya berdasarkan orbtial-orbital dari atom-atom molekul. Tidak seperti ikatan ion, ikatan kovalen bisa memiliki sifat-sifat anisotropik, dan masing-masing memiliki nama-nama tersendiri seperti ikatan sigma dan ikatan pi.
Atom-atom juga dapat membentuk ikatan-ikatan yang memiliki sifat-sifat antara ikatan ion dan kovalen. Hal ini bisa terjadi karena definisi didasari pada delokalisasi elektron. Elektron-elektron dapat secara parsial terdelokalisasi di antara atom-atom. Ikatan sejenis ini biasanya disebut sebagai ikatan polar kovalen. Lihat pula elektronegativitas.
Oleh akrena itu, elektron-elektron pada orbital molekul dapat dikatakan menjadi terlokalisasi pada atom-atom tertentu atau terdelokalisasi di antara dua atau lebih atom. Jenis ikatan antara dua tom ditentukan dari seberapa besara rapatan elektron tersebut terlokalisasi ataupun terdelokalisasi pada ikatan antar atom.