Sel Bahan Bakar Hidrogen.pdf
description
Transcript of Sel Bahan Bakar Hidrogen.pdf
-
Sel Bahan Bakar Hidrogen
Diajukan untuk melengkapi salah satu tugas mata kuliah Kimia
Anorganik I
Dosen Pengampu : Setia Budi, M.Si
Disusun Oleh :
Ade Nurul Hidayat (3315122112)
Program Studi Pendidikan Kimia
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Negeri Jakarta
2013
-
1
1. OVERVIEW
Hidrogen , unsur yang paling melimpah di alam semesta , memiliki
potensi besar sebagai sumber energi . Tidak seperti minyak bumi , dapat dengan
mudah dihasilkan dari sumber energi takterbarukan, dan hydrogen juga
nonpolluting , dan membentuk air sebagai produk sampingan tak berbahaya saat
digunakan .
Satu gram gas hidrogen menempati sekitar 11 liter ( 2,9 galon ) ruang
pada tekanan atmosfer , sehingga untuk kenyamanan gas harus intens
bertekanan untuk beberapa ratus atmosfir dan disimpan dalam bejana tekan .
Dalam bentuk cair , hidrogen hanya dapat disimpan di bawah suhu
kriogenik(sangat rendah) .
Solusi untuk kesulitan-kesulitan ini adalah penyimpanan hidrogen dalam
bentuk hidrida . Metode ini menggunakan sebuah paduan yang dapat menyerap
dan menyimpan sejumlah besar hidrogen dengan ikatan dengan hidrogen dan
membentuk hidrida . Sebuah paduan penyimpanan hidrogen mampu menyerap
dan melepaskan hidrogen tanpa mengorbankan struktur sendiri .
gas tak berwarna dengan nyala ungu dalam keadaan plasma
Gambar 1 : Garis spektrum Hidrogen
Lain-lain
Struktur kristal heksagonal
Pembenahan
magnetik diamagnetik
Konduktivitas
termal 180,5 m Wm1K1
Kecepatan
suara
(gas, 27 C) 1310
ms1
-
2
G
Gas hidrogen termasuk gas yang mudah terbakar. Gas hidrogen dapat
bersifat eksplosif jika membentuk campuran dengan udara dengan perbandingan
volum 4%-75%, sedangkan dengan klorin perbandingan volumnya yaitu 5%-95%.
Akibat dari gas hidrogen yang sangat ringan maka api yang disebabkan
pembakaran oleh gas hidrogen cenderung bergerak ke atas dengan cepat
sehingga dapat mengakibatan kerusakan yang sangat sedikit jika dibandingkan
dengan api yang berasal dari pembakaran hidrokarbon. Hidrogen sangatlah larut
dalam berbagai senyawa yang terdiri dari logam tanah nadir dan logam transisi
dan dapat dilarutkan dalam logam kristal maupun logam amorf.
Sifat fisika
Fase gas
Massa
jenis
(0 C, 101.325 kPa)
0,08988 g/L
Massa
jenis
cairan
pada t.l.
0.07 (0.0763 solid)gcm3
Titik lebur 14,01 K, 259,14 C,
434,45 F
Titik didih 20,28 K, 252,87 C,
423,17 F
Kalor
peleburan (H2) 0,117 kJmol
1
Kalor
penguapan (H2) 0,904 kJmol
1
Sifat kimia
Panas Fusi 0,117 kJ/mol H2
Energi ionisasi 1312 kJmol
Afinitas electron 72,7711 kJ/mol
Jumlah kulit 1
Biloks minimal -1
Elektronegatifitas 2,18 (skala Pauli)
onfigurasi
elektron 1s1
jari-jari atom 25 pm
Struktur hcp (hexagonal close
packed)
-
3
Sumber Hidrogen di Alam
Di alam bebas sangat jarang ditemukan hidrogen dalam bentuk unsurnya
yang tunggal, misalnya H saja. Pada umumnya hidrogen terdapat dalam bentuk
gas diatomik yaitu H2 yang dapat keluar dari atmosfer bumi karena disebabkan
berat molekulnya yang ringan. Hidrogen dalam keadaan bebas banyak
ditemukan pada gas yang dikeluarkan oleh gunung berapi atau di tempat
penyulingan gas alam. Akibat hidrogen adalah unsur yang reaktif maka pada
umumnya hidrogen di alam ditemukan dalam bentuk senyawaanya misalnya
dalam bentuk hidrokarbon seperti metana (CH4) dan air (H2O).
INFORMASI
Kelimpahan Hidrogen di Alam
Dalam Tabel Periodik Unsur terdapat satu unsur yang memiliki lambing
huruf H. Unsur ini kemudian dikenal dengan nama Hidrogen. Nama hidrogen
tersebut diberikan oleh Lavoiser pada tahun 1783 dan berasal dari bahasa Yunani
yaitu Hydro yang artinya air dan Genes yang artinya membentuk atau
mengasilkan. Jadi, hidrogen dapat diartikan sebagai unsur pembentuk air atau
yang menghasilkan air. Hidrogen merupakan unsur yang paling ringan di antara
unsur lainnya dalam tabel periodik dan merupakan unsur yang paling banyak
terdapat di alam semesta yang kelimpahannya mencapai 75% berat atau 93%
mol. Hidrogen ialah unsur ketiga yang terbanyak terdapat di bumi yaitu kadar
hidrogen di alam mencapai 1400 ppm (0,14% berat) atau 2,9% mol.
Hidrogen dapat berupa gas diatomik (H2). Gas ini tidak berwarna, tidak
berbau, dan bersifat mudah terbakar dengan adanya oksigen. Terdapat dua
bentuk molekuler yaitu orthohidrogen dan parahidrogen, kedua bentuk
molekular ini berbeda dalam hal spin relatif elektron dan inti atomnya. Pada
ortohidrogen spin dua protonnya adalah paralel sehingga membentuk keadaan
olekular yang disebut sebagai triplet dengan bilangan kuantum spin 1 (1/2+1/2),
sedangkan pada parahidrogen spin protonya antiparalel sehingga membentuk
keadaan singlet dan bilangan kuantum spinnya 0 (1/2-1/2). Pada keadaan STP
-
4
(Standard Temperature Pressure) gas hidrogen tersusun dari 25% bentuk para
dan 75% bentuk ortho.
Di alam hidrogen memiliki 3 buah isotop yaitu 1H, 2H, dan 3H. Isotop 1H
adalah isotop hidrogen yang kelimpahannya mencapai 99,98% yang disebut juga
dengan Protium. Isotop stabil yang lain adalah 2H (Deuterium) dan intinya terdiri
dari 1 proton dan 1 neutron. Deuterium bukanlah radioaktif dan tidak berbahaya
digunakan sebagai penanda dalam sintesis senyawa organik. Deuterium dalam
bentuk 2H2O sering juga digunakan sebagai pendingin dalam reaktor nuklir dan
reaksi fusi. Sedangkan isotop 3H disebut sebagai Tritium mengandung 2 netron
dan 1 proton dalam intinya dan bersifat radioaktif dan meluruh menjadi Helium-
3 dengan memancarkan sinar beta. Banyak dimanfaatkan sebagai pelacak dalam
bidang geokimia dan penanda dalam eksperimen kimia maupun biologi.
Gambar 2 : Isotop Hidrogen
Senyawa Hidrogen
Hidrida merupakan nama yang diberikan untuk ion negatif hidrogen H.
Walaupun ion ini tidak akan ada tanpa kondisi yang khusus, istilah hidrida digunakan
secara luas untuk menyebut sebuah senyawa hidrogen dengan unsur lain, terutama
untuk unsur golongan 116. Senyawa-senyawa yang dibentuk oleh hidrogen sangatlah
banyak, melebihi senyawa yang dapat dibentuk oleh unsur lain.
Ion hidrida
Ion hidrida merupakan anion paling sederhana yang dapat terbentuk,
yakni terdiri dari dua elektron dan sebuah proton. Hidrogen memiliki afinitas
elektron yang cukup rendah, 72.77 kJ/mol, sehingga hidrida bersifat sangat basa
-
5
dan tidak akan ditemukan dalam larutan. Walaupun demikian, reaksi yang
melibatkan hidrida dalam larutan tetap ada, sama seperti proton yang sangat
asam sehingga tidak bisa ditemukan dalam larutan. Reaktivitas ion hidrida
hipotetis didominasi oleh protonasi eksotermik, menghasilkan dihidrogen:
H + H+ H2; H = 1676 kJ/mol
Oleh karena itu, ion hidrida merupakan salah satu basa paling kuat yang dikenal.
Ia akan menarik proton dari hampir seluruh senyawa yang mengandung
hidrogen. Afinitas elektron hidrogen yang rendah dan ikatan HH bond (HBE =
436 kJ/mol) yang kuat berarti ion hidrida juga merupakan reduktor yang kuat:
H2 + 2e 2H; Eo = 2.25 V
Hidrida ionik
Hidrida ionik atau salin, hidrogen dianggap sebagai pseudohalida. Hidrida
salin tidak larut dalam pelarut konvensional, yang merefleksikan struktur
nonmolekul senyawa ini. H mempunyai konfigurasi elektron helium yang stabil
dengan orbital 12 yang penih. Hidrida ionik juga mempunyai sifat logam
elektropositif, biasanya logam alkali atau logam alkali tanah.
Hidrida-hidrida ini disebut sebagai biner jika ia melibatkan dua unsur
termasuk hidrogen. Rumus kimia untuk hidrida biner ionik umumnya adalah MH
(seperti pada LiH). Semakin tinggi muatan logam meningkat, semakin kovalen
ikatan M-H, seperti yang terdapat pada MgH2 dan AlH3. Hidrida ionik umumnya
ditemukan sebagai reagen basa dalam sintesis organik:
C6H5C(O)CH3 + KH C6H5C(O)CH2K + H2
Reaksi seperti ini heterogen karena KH tidak larut. Pelarut yang umumnya
digunakan dalam reaksi seperti ini adalah eter. Air tidak dapat digunakan sebagai
media hidrida ionik murni atau LAH karena ion hidrida merupakan basa yang
-
6
lebih kuat daripada hidroksida. Gas hidrogen dilepaskan pada reaksi asam-basa
ini:
NaH + H2O H2 (gas) + NaOH H = 83.6 kJ/mol, G = 109.0 kJ/mol
Hidrida logam alkali bereaksi dengan logam halida. Litium aluminium
hidrida (sering disingkat sebagai LAH) didaptakan dari reaksi LiH dengan
aluminium klorida.
4 LiH + AlCl3 LiAlH4 + 3 LiCl
hidrida kovalen
hidrida kovalen, hidrogen berikatan secara kovalen dengan unsur yang
lebih positif, seperti pada unsur boron, aluminium, dan unsur golongan 4-7 serta
berilium. Senyawa yang umumnya ditemukan meliputi hidrokarbon dan amonia.
Hidrida kovalen netral yang berupa molekul biasanya mudah menguap pada
suhu kamar dan tekanan atmosfer. Beberapa hidrida kovelan tidak mudah
menguap karena hidrida tersebut bersifat polimerik, seperti pada hidrida
aluminium dan berilium. Dengan menggantikan beberap atom hidrogen pada
senyawa ini dengan ligan yang lebih besar, bisa didapatkan turunan senyawa
molekuler. Sebagai contoh, diisobutilaluminium hidrida (DIBAL) terdiri dari duan
pusat aluminium yang berjembatan dengan ligan hidrida. Hidrida yang larut
dalam pelarut umum sering digunakan dalam sintesis organik, misalnya natrium
borohidrida (NaBH4), litium aluminium hidrida, dan DIBAL.
Struktur
Jika dua atau lebih atom terikat dengan ikatan primer, baik berupa ikatan
ion ataupun ikatan kovalen, mereka membentuk molekul yang diskrit. Dalam
membentuk padatan kristal, ikatan yang terjadi antar molekul sub-unit ini berupa
ikatan yang kurang kuat. Kristal yang terbentuk pada situasi ini adalah kristal
molekul, yang sangat berbeda dari kristal unsur dan kristal ionik. Pada es (H 2O),
-
7
ikatan primernya adalah ikatan kovalen dan ikatan sekunder antar sub-unit
adalah ikatan dipole yang lemah. Atom O [He] 2s 2 2 p4 memiliki enam elektron
di kulit terluar dan akan mengikat dua atom H 1 s1 . Oleh karena itu molekul air
terdiri dari satu atom oksigen dengan dua ikatan kovalen yang dipenuhi oleh dua
atom hidrogen dengan sudut antara dua atom hidrogen adalah 104 o. Dalam
bentuk kristal, atom-atom hidrogen mengikat molekul-molekul air dengan ikatan
ionik atau ikatan dipole hidrogen.
Pada tekanan rendah, molekul hidrogen padat dikenal melalui direct x-ray
pengukuran difraksi menjadi dekat heksagonal isolasi dikemas padat dengan
molekul bebas berputar di situs hcp. kesulitan eksperimental, terutama karena
ukuran sampel makin kecil, sejauh ini mencegah penentuan langsung dari
struktur kristal pada tekanan tinggi. Namun demikian, berdasarkan spektrum
fonon akustik, diyakini bahwa molekul tetap berpusat pada situs kisi hcp sampai
dengan dan melalui transisi fase III. pencarian untuk struktur energi terendah
karenanya dapat cukup terbatas pada molekul berbeda berorientasi berpusat
pada situs hcp.
Gambar : Gambar Struktur
Hidrogen
(Hexagonal Closed Packed)
Gambar : Setiap sphere dalam gambar adalah molekul hidrogen (H2).
-
8
-
9
Elektrolisis
Elektrolisis berarti melewati sebuah arus listrik melalui air untuk
memisahkan air menjadi terpisah menjadi hidrogen dan oksigen. Elektrolisis
telah menjadi perhatian karena hanya menyumbang sebagian kecil dari
produksi hidrogen dan air yang melimpah. Saati ini, teknik hanya digunakan
pada tanaman yang relative kecil dengan biaya 2,40-3,60 $/kg hidrogen yang
dihasilkan.
6. Fotobiologis
Teknik hanya dapat dilakukan pada siang hari, yaitu ketika adanya matahari.
Hal ini dikarenakan mikroba fotosintetik menggunakan energi dari sinar matahari
sebagai sumber energi mereka.
7. Teknik Fermentasi
Teknik ini berlangsung pada siang (seperti Rhodopseudomonas, Rhodobacter,
Anabaena, Chlamydomonas, Chromatium dan Thicapsa) maupun malam hari
(dalam keadaan gelap seperti Clostridium, Enterobacter, Azetobacter,
Metanobacteria dan Eschericia coli). Hal ini tergantung pada tipe mikroba yang
digunakan dalam fermentasi. Sebagian besar bakteri aerob dan anaerob
memproduksi biohidrogen dengan pendekatan fotosintesis dan fermentasi
(fotofermentasi).
Keunggulan dari biohidrogen antara lain :
Dapat diperbaharui (renewable energy) dan ramah lingkungan (green energy)
Hasil samping pembakarannya berupa uap air sehingga tidak menimbulkan efek
rumah kaca, hujan asam, dan penipisan lapisan ozon
Proses produksi dapat berlangsung pada tekanan dan suhu normal[16]
Biaya produksi lebih rendah dibandingkan dengan cara fisik dan kimia
Dapat memanfaatkan limbah dan sampah organic sebagai substrat fermentasi
2 H2O(aq) 2 H2(g) + O2(g)
-
10
8. Off-gas cleanup
Beberapa industri melepaskan konsentrasi hidrogen yang begitu pekat dari
aliran limbah kilang minyak, dapur tinggi, dan beberapa tanaman kimia. Dengan
mengumpulkan dan memurnikan gas ini maka akan dapat menghemat biaya
berkisar 80-120/kg. kebanyakan off-gas hidrogen digunakan oleh industry
tersebut sehingga off-gas cleanup adalah fitur penting saat ini. Tampaknya hal itu
tidak mungkin bahwa bisa diperluas untuk memenuhi peningkatan permintaan
yang akan dihasilkan dari meluasnya penggunaaan hidrogen sebagai bahan
bakar.
9. Photo Process
Menggunakan energi khusus dan sifat cahaya lainnya (biasanya sinar
matahari) untuk menghasilkan hidrogen dari air atau biomassa. Ada tiga kategori
photo process yaitu :
Photo Biological Technique
Didasarkan pada siklus fotosintesis yang digunakan oleh tanaman dan beberapa
bakteri dan ganggang. Efisiensi produksi hidrogen hanya mencapai 1-5% namun
para peneliti berharap untuk meningkatkan hingga 10% atau lebih
Photo Chemical Process
Meniru fotosinesis secara alami dengan menggunakan molekul sintetik. Efisiensi
teknik ini hanya sekitar 0,1% tetapi bisa ditingkatkan.
Photo Electrochemical
Teknik ini menggunakan lapisan bahan semikonduktor yang dipisahkan oleh air.
Ketika terkena cahaya, lpisan semikonduktor menghasilkan tegangan listrik yang
memecah air menjadi hidrogen dan oksigen. Efisiensi yang telah dicapai sudah
sebesar 13% tetapi efisiensi maksimumnya secara teoritis bisa mencapai 35%.
10. Thermo Chemical Process
-
11
Proses ini menggunakan panas untuk memecah air menjadi hidrogen dan
oksigen. Secara konseptual, teknik ini adalah konversi termal langsung yaitu
pemanasan air untuk suhu ekstrim (3400 K). karena suhu tinggi diperlukan,
namun konversi termal langsung belum begitu praktis untuk dilakukan di luar
laboratorium karena reaksi kimia dapat digunakan untuk mengurangi suhu yang
diperlukan. Berbagai alternatif telah dipelajari dengan melibatkan proses
kompleks multistep. Teknik hybrid yang menggunakan elektrolisis menjadi satu
atau lebih dengan langkah-langkah yang sedang diselidiki.
11. Radiolysis
Proses ini adalah pemisahan air molekul oleh tabrakan dengan partikel
berenergi tinggi yang diproduksi dalam reactor nuklir. Karena hidrogen dan atom
oksigen akan menyatu kembali dengan cepat sehingga menghasilkan air. Efisiensi
radiolysis hanya sekitar 1%.
12. Solar Hidrogen
Dalam bentuk asli dan sederhana produksi energi hidrogen, membayangkan
skenario hidrogen surya memproduksi listrik dari sinar matahari dengan
menggunakan sel fotovoltatik, mengelektrolisis air untuk menghasilkan hidrogen
lalu hidrogen ini dipakai untuk mengganti minyak dan lainnya sebagai bahan
bakar fosil yang sat ini digunakan oleh umum. Sekarang istilah ini sering
digunakan lebih luas untuk elektrolisis berbasis pada sumber listrik terbaharukan,
seperti angin. Ide ini telah menerima banyak perhatian sebagian besar karena
manfaat lingkungan menggunakan hidrogen sebagai alternatif untuk bahan bakar
alternatif.
13. Partial Oxidation of Hydrocarbons
Hidrogen mungkin terbentuk dari tidak adanya katalitik oksidasi parsial (yaitu
gasifikasi) dari hidrokarbon seperti minyak residu. Hidrokarbon apa saja dapat
dikompresi atau dipompa dalam teknologi ini. Namun, efisiensi keseluruhan
proses ini adalah sekitar 50% dan diperlukan oksigen murni. Tersedia dua
-
12
komersial teknologi untuk konversi ini yaitu Texaco gasification process dan Shell
gasification process.
Pada saat ini, telah dikenal empat sistem penyimpanan hidrogen, yaitu pencairan
hidrogen, hidrogen bertekanan, metal hidrida, dan adsorpsi pada material
berpori. Teknik pencairan dan metal hidrida merupakan sistem yang dapat
mengurangi volume hidrogen 600 sampai 1000 kali dari volume pada kondisi
kamarnya. Walaupun begitu beberapa kekurangan dari kedua teknik ini
menyebabkan kurang dapat digunakan secara komersial sebagai penyimpan
hidrogen. Teknik pencairan hidrogen memerlukan energi yang besar untuk
mencairkan hidrogen pada temperatur minus 253OC dan sering terjadi boil off.
Teknik penyimpanan dalam bentuk metal hidrida relatif aman, tetapi memiliki
bobot yang berat dan memerlukan panas yang tinggi untuk melepaskan hidrogen
dari ikatan kimia dengan logamnya.
APLIKASI
Dalam bidang industry, bidang otomotif, kimia, pembangkit listrik,
kedirgantaraan, dan industri telekomunikasi.
Sejumlah besar H2 diperlukan dalam industri petrokimia dan kimia.
Penggunaan terbesar H2 adalah untuk memproses bahan bakar fosil dan dalam
pembuatan ammonia. Konsumen utama dari H2 di kilang petrokimia meliputi
hidrodealkilasi, hidrodesulfurisasi, dan penghidropecahan (hydrocracking). H2
memiliki beberapa kegunaan yang penting. H2 digunakan sebagai bahan
hidrogenasi, terutama dalam peningkatan kejenuhan dalam lemak takjenuh dan
minyak nabati (ditemukan di margarin), dan dalam produksi metanol. Ia juga
CnHm + n/2 O2 nCO + m/2 H2
-
13
merupakan sumber hidrogen pada pembuatan asam klorida. H2 juga digunakan
sebagai reduktor pada bijih logam.
Selain digunakan sebagai pereaksi, H2 memiliki penerapan yang luas
dalam bidang fisika dan teknik. Ia digunakan sebagai gas penameng di metode
pengelasan seperti pengelasan hidrogen atomik. H2 digunakan sebagai pendingin
rotor di generator pembangkit listrik karena ia mempunyai konduktivitas termal
yang paling tinggi di antara semua jenis gas. H2 cair digunakan di riset kriogenik
yang meliputi kajian superkonduktivitas. Oleh karena H2 lebih ringan dari udara,
hidrogen pernah digunakan secara luas sebagai gas pengangkat pada kapal udara
balon.
Baru-baru ini hidrogen digunakan sebagai bahan campuran dengan
nitrogen (kadangkala disebut forming gas) sebagai gas perunut untuk
pendeteksian kebocoran gas yang kecil. Aplikasi ini dapat ditemukan di bidang
otomotif, kimia, pembangkit listrik, kedirgantaraan, dan industri telekomunikasi.
Hidrogen adalah zat aditif (E949) yang diperbolehkan penggunaanya dalam
ujicoba kebocoran bungkusan makanan dan sebagai antioksidan.
Isotop hidrogen yang lebih langka juga memiliki aplikasi tersendiri.
Deuterium (hidrogen-2) digunakan dalam reaktor CANDU sebagai moderator
untuk memperlambat neutron. Senyawa deuterium juga memiliki aplikasi dalam
bidang kimia dan biologi dalam kajian reaksi efek isotop. Tritium (hidrogen-3)
yang diproduksi oleh reaktor nuklir digunakan dalam produksi bom
hidrogen,sebagai penanda isotopik dalam biosains, dan sebagai sumber radiasi di
cat berpendar.
Dalam bidang militer
Bom hidrogen, sejauh ini, merupakan senjata paling merusak yang pernah
diciptakan manusia, bom ini merupakan jenis yang paling kuat dari bom nuklir,
dengan kekuatan hingga 25.000 kali bom nuklir yang dijatuhkan di Hiroshima dan
-
14
Nagasaki, tidak seperti bom atom konvensional (juga dikenal sebagai A-bombs),
yang melepaskan energi dengan reaksi fisi dari inti atom berat seperti uranium
dan plutonium, bom hidrogen melepaskan energi dengan menggabungkan
bersama-sama inti ringan seperti deuterium atau tritium (fusi) yang mampu
mengubah lebih banyak materi menjadi energi.
RESET
PENDAHULUAN
Banyak aplikasi dari atom hydrogen tersebut, di paper ini akan di jelaskan
dengan lanjut tentang Sel Bahan Bakar Hidrogen.
Fuelcell adalah alat elektrokimia yang mengkonversi energi reaksi kimia
secara langsung menjadi energi listrik arus searah (Fuel Cell Handbook,
2000). Ia terdiri dari lapisan elektrolit yang berkontak dengan anoda dan
katoda berpori. Berbeda dengan baterai yang sudah lama dikenal, fuelcell
bukanlah alat penyimpan energi seperti baterai. Fuelcell mengkonversi energi
reaksi elektrokimia menjadi energi listrik. Selama bahan bakar diumpankan ke
dalam fuelcell maka ia akan tetap menghasilkan arus listrik.
Fuelcell sebagai suatu pilihan penyedia daya masa depan menjanjikan
manfaat yang tak diperoleh dari sistem penyedia energi lain. Sistem fuelcell
memberikan efisiensi yang relatif tinggi karena perubahan energi kimia secara
langsung menjadi listrik tanpa harus dibatasi oleh siklus Carnot. Tingkat
kebisingannya jauh lebih rendah daripada yang dihasilkan teknologi penyediaan
daya lainnya yang ada saat ini. Hal ini disebabkan karena tidak ada bagian
fuelcell yang bergerak dalam pembangkitan listrik.
Kita ketahui bahwa energi dari bahan bakar fosil seperti minyak
bumi menimbulkan banyak persoalan bagi manusia yaitu polusi SO2, NOx, dan
abu dan efek rumah kaca. Emisi CO2 dan asap knalpot kendaraan berbentuk
jelaga karbon.Oleh karena itu, fuelcell merupakan suatu sistem teknologi energi
-
15
yang dampak negatifnya lebih kecil daripada sistem pembakaran bahan bakar
fosil.
Fuel cell adalah suatu sistem elektrokimia yang mengubah energi kimia
dari hidrogen dan oksigen langsung menjadi energi listrik. Keunggulan utama fuel
cell dibandingkan pembangkit listrik konvensional adalah :
Mempunyai efisiensi tinggi dari 40% sampai 60%, sedangkan untuk
kogenerasi dapat mencapai 80%.
Tidak menimbulkan suara bising.
Konstruksinya modular sehingga fleksibel dalam menyesuaikan
dengan sumber bahan bakar yang ada.
Mampu menanggapi dengan cepat terhadap perubahan bahan bakar
atau oksigen.
Fuel cell dapat mengubah hidrogen dan oksigen menjadi listrik dan air
sebagai alternatif menarik untuk mesin pembakaran bahan bakar fosil untuk
efisiensi, fleksibilitas, dan ramah lingkungan. Operasi dasar dari sebuah fuel cell
yang digambarkan pada gambar berikut.
-
16
Fuel cell menghasilkan potensi listrik dengan efisiensi 60%, listrik dapat
digunakan secara langsung atau con-dikonversi menjadi gerak, cahaya atau
panas. Sebaliknya dalam mesin bensin, beroperasi dengan efisiensi ~25% dan
digunakan hampir secara eksklusif untuk memproduksi gerak. Analisis hasil dari
dua tahun pertama dari US Department of Energy pembelajaran fuel cell
demonstrasi berdasarkan armada 77 kendaraan fuel cell menunjukkan bahwa
efisiensi sel bahan bakar pada seperempat bagian yang diuji pada dinamometer
mencapai 52,5-58,1%, dekat dengan efisiensi target 60%.
Membran elektrolit primer (PEM) fuel cell untuk transportasi
mengandalkan tersebarnya nanopartikel katalis Pt didukung pada substrat
karbon untuk meningkatkan reaksi proton, elektron, dan molekul oksigen ke air.
Meskipun Pt adalah katalis paling terkenal untuk reaksi ini, hidrogen tidak dapat
memenuhi tuntutan dari ekonomi dewasa ini karena biaya tinggi dan kelangkaan
relatif. Banyaknya kebutuhan meningkat dalam aktivitas katalitik yang diperlukan
untuk mengurangi jumlah yang dibutuhkan, atau harus digantikan oleh katalis
alternatif yang aktif, berlimpah, dan murah.
Membran Elektrolit
Komponen ini mempunyai pori yang sangat kecil sehingga tidak mengijinkan atom
hidrogen untuk melewati pori membran. Membran elektrolit ini bersifat proton
exchange (H+) di mana dalam strukturnya akan terjadi suatu mekanisme pertukaran ion
sehingga konduktifitas proton yang diharapkan pada kondisi humidified membrane 2 x
-
17
10-2 S/cm (ketahanan 0,05 ohm cm2 untuk membran dengan ketebalan 50 mikrometer).
Selain itu ketahanan dan kestabilan terhadap zat kimia dan termal (300OC) sangatlah
menentukan performance arus yang dihasilkan.
PRODUKSI HIDROGEN
Salah satu jenis bahan bakar alternatif yang banyak dicermati saat ini adalah
hidrogen. Seperti diketahui bahwa hidrogen dapat berfungsi sebagai energi untuk
semua kegunaan sebagaimana layaknya minyak bumi dan gas alam. Hidrogen tersedia
dalam air dan senyawa organik dalam bentuk senyawa hidrokarbon. Pemotongan
ikatan-ikatan kimia di dalam air akan menghasilkan hidrogen yang dapat dipergunakan
sebagai bahan bakar.
Hidrogen dapat dihasilkan melalui beberapa proses seperti : elektrolisa,
fotoelektrokimia, steam reforming, fotobiologi, dan lain-lain. Hidrogen dapat pula
dihasilkan dengan menggandeng sumber-sumber energi terbarukan, seperti : energi air,
energi surya, energi angin, dan energi panas bumi. Hidrogen yang dihasilkan dapat
disimpan dalam bentuk gas atau cair, sedangkan transportasi dan distribusinya dapat
dilakukan dengan berbagai cara. Karena hidrogen hanya ditemukan di alam dalam
bentuk senyawa, maka hidrogen harus diproduksi melalui penggunaan energi, sebelum
hidrogen tersebut tersedia sebagai sumber energi.
Penerapan Fuel Cell di Sektor Transportasi
-
18
Gambar : Suatu mobil yang mengguakan sel bahan bakar hidrogen
Suatu alat transportasi sangat berhubungan dengan berat total kendaraan, dan
bahan bakar yang digunakan merupakan suatu zat dari sistem yang mempengaruhi
berat total kendaraan dan kinerjanya. Jika digunakan bahan bakar yang mempunyai
nilai kalor tinggi, maka kinerja akhir kendaraan dapat dikatakan baik. Seperti diketahui,
hidrogen sebagai energi
alternatif merupakan senyawa bahan bakar yang pada saatnya nanti menjadi
suatu sumber energi yang sangat potensial, bersih, dan efisien. Bila hidrogen digunakan
sebagai bahan bakar fuel cell, maka mobil listrik akan menjadi ringan dibandingkan
bahan bakar lain. Hal ini disebabkan energi per satuan beratnya lebih tinggi
Pengembangan mobil listrik dengan baterai konvensional dirasakan tidak
realibel karena jarak tempuhnya pendek dan waktu pengisian batere yang lama jika
dibandingkan mobil konvensional. Namun dengan adanya teknologi fuel cell dan
reformernya, kendala jarak tempuh dan pengisian batere dapat diatasi. Pada beberapa
jenis prototipe mobil listrik selain tangki penyimpan gas hidrogen juga digunakan
reformer di mana campuran metana dan air dirubah menjadi gas hidrogen. Sebagai
salah satu contoh penerapan fuel cell pada mobil listrik.
-
19
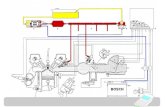
Gambar : Mesin mobil sel bahan bakar hydrogen
KESIMPULAN
Fuel Cell sebagai teknologi pembangkit energi prospeknya sangat baik di masa
mendatang, baik diaplikasikan pada sektor pembangkit listrik maupun di sektor
transportasi. Khusus untuk di Indonesia yang merupakan negara kepulauan,
teknologi ini merupakan salah satu teknologi alternatif yang sangat sesuai untuk
penyediaan energi listrik.
Perkembangan teknologi fuel cell yang pesat dapat meningkatkan pengoperasian
produksi hidrogen dengan cara digandengkan dengan generator lain seperti
penggunaan teknologi fotovoltaik.
Aplikasi sistem fuel cell akan sangat menguntungkan bagi negara kita seperti :
membuka lahan bisnis baru termasuk bisnis sistem pendukungnya menghemat devisa
negara, dan mengurangi pencemaran udara di sektor transportasi.
Aplikasi sistem fuel cell untuk sektor transportasi perlu diprioritaskan, karena sarana
transportasi merupakan kontributor terbesar, baik dalam penggunaan BBM secara
nasional maupun pencemaran lingkungan.
-
20
Dimulainya penggunaan sistem fuel cell merupakan tantangan dalam
menghadapi masalah global seperti faktor pencemaran lingkungan akibat penggunaan
energi fosil, dan terbatasnya sumber daya energi fosil serta penyimpanan energi untuk
daerah terpencil
Dampak positif sel bahan bakar hidrogen yaitu :
1. Kurang Emisi Gas Rumah Kaca
2. Kurang Polutan Udara
3. Mengurangi Ketergantungan Minyak
4. Memiliki efisiensi yang lebih tinggi daripada mesin diesel atau gas.
5. Menghilangkan ketergantungan ekonomi pada negara-negara politis tidak
stabil untuk bahan bakar fosil.
6. Beberapa memiliki panas rendah transmisi-ideal untuk aplikasi militer.
7. Kebanyakan beroperasi diam-diam dibandingkan dengan mesin
pembakaran internal.
8. Pemeliharaan sederhana karena ada beberapa bagian yang bergerak
dalam sistem.
9. Waktu operasi yang lebih lama dibandingkan dengan baterai.
Dampak negatif sel bahan bakar hidrogen yaitu :
1. Reformasi secara teknis menantang dan tidak ramah lingkungan.
2. Produksi, transportasi, distribusi dan penyimpanan hidrogen yang sulit.
3. Jarak tempuh mobil yang lebih pendek daripada di kendaraan tradisional.
4. Pengisian bahan bakar dan mulai saat kendaraan sel bahan bakar yang
lebih lama.
5. Saat mahal untuk diproduksi, karena sebagian besar unit adalah buatan
tangan.
6. Sel bahan bakar umumnya sedikit lebih besar daripada baterai sebanding
atau mesin.
7. Teknologi ini belum sepenuhnya dikembangkan dan beberapa produk
yang tersedia.
8. Sebagian menggunakan bahan-bahan yang mahal.
-
21
Referensi
1. Hasan, Achmad. Aplikasi Sistem Fuel cell sebagai Energi Ramah Lingkungan di
Sektor Transportasi dan Pembangkit. ISSN 1441-318X Vol.8, No.3 (September
2007): Pp.277-286.
2. Sirait LR. 2007. Produksi Gas Produksi Gas Hidrogen Dari Limbah Alumunium.
Program Studi Kimia, Fakultas Sains dan Teknologi UIN Syarif Hidayatullah
Jakarta.
3. Habibi, Muhammad Sidiq. 2009. Produksi Biohidrogen Melalui Fermentasi
Bakteri Fotosintetik Rhodobium marinum dan Isolat Sanur. Bogor. Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
4. Sirait LR. 2007. Produksi Gas Hidrogen dari Limbah Cair Tahu dengan Bakteri
Fotosintetik Rhodobium marinum [tesis]. Depok: Sekolah Pascasarjana,
Universitas Indonesia..
5. Sriyono, Teknologi Proses Produksi Hidrogen Berbasis Energi Nuklir, Sigma
Epsilon, ISSN 0853-9103, (2008)
6. Sutarno, Malik A, Analisis Efisiensi Efisiensi Energi dan Energi Listrik pada
Proses Produksi Hidrogen dengan Elektrolisis Air, Prosiding: Seminar Nasional
Rekayasa Kimia dan Proses, ISSN 1411-4216, (2004)
7. Prasodjo, Prolessara. 2010. Studi Kapasitas Adsorpsi serta Dinamika Adsorpsi
dan Desorpsi dari Nanotube Karbon sebagai Penyimpan Hidrogen [tesis].
Depok: Fakultas Teknik, Universitas Indonesia.
-
22
8. Anonymous. 2013. Hydrogen Energy (online).
(http://www.renewableenergyworld.com/rea/tech/hydrogen, diakses pada
tanggal 13 April 2014 )
9. Anonymous. 2012. Aplikasi Hidrogen (H2) Dalam Dunia Industri (online).
(http://www.umpgas.com/news/24/Aplikasi-Hidrogen-H2-Dalam-Dunia-
Industri, diakses pada tanggal 13 April 2014)