Perkembangan model atom
-
Upload
firda-mawaddah-aulia -
Category
Science
-
view
198 -
download
5
Transcript of Perkembangan model atom

Belinda Alifa Desi Rohmaeni Ferita Firda Mawaddah Aulia Nur Afifah Nurul Aulia Tammah Syifa
Perkembangan Model Atom
Disusun Oleh :

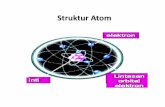
Struktur atom• merupakan satuan dasar materi yang terdiri dari inti atom
beserta awan elektron bermuatan negatif yang mengelilinginya.
• Inti atom mengandung campuran proton yang bermuatan positif dan neutron yang bermuatan netral (terkecuali pada Hidrogen-1 yang tidak memiliki neutron).
• Elektron-elektron pada sebuah atom terikat pada inti atom oleh gaya elektromagnetik.
• Sekumpulan atom dapat berikatan satu sama lainnya membentuk sebuah molekul.
• Atom yang mengandung jumlah proton dan elektron yang sama bersifat netral, sedangkan yang mengandung jumlah proton dan elektron yang berbeda bersifat positif atau negatif dan merupakan ion.

• Atom dikelompokkan berdasarkan jumlah proton dan neutron pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
• Istilah atom berasal dari Bahasa Yunani, yang berarti tidak dapat dipotong ataupun sesuatu yang tidak dapat dibagi-bagi lagi.
• Jadi, pengertian atom adalah partikel terkecil yang tidak dapat dibagi bagi lagi.
• Relatif terhadap pengamatan sehari-hari, atom merupakan objek yang sangat kecil dengan massa yang sama kecilnya pula.
• Atom hanya dapat dipantau menggunakan peralatan khusus seperti mikroskop penerowongan payaran.
• Elektron pada atom menentukan sifat-sifat kimiawi sebuah unsur dan memengaruhi sifat-sifat magnetis atom tersebut.

John Dalton
J.J Thomson
Ernest Rutherford
Niels Bohr
Mekanika Kuantum
PERKEMBANGAN TEORI ATOM

Teori Atom Dalton
Dalton menggambarkan model atom seperti bola pejal. Menurut Dalton, setiap unsur tersusun atas partikel – partikel terkecil yang tidak dapat dibagi bagi lagi

Kelebihan Teori Atom Dalton: Dapat menerangkan Hukum Kekekalan Massa
(Hukum Lavoisier) Dapat menerangkan Hukum Perbandingan
Tetap (Hukum Proust)
Kelemahan Teori Atom Dalton: Tidak dapat menjelaskan sifat listrik materi. Tidak dapat menjelaskan cara atom-atom
saling berikatan. Model atom Dalton tidak dapat menjelaskan
perbedaan antara atom unsur yang satu dengan unsur yang lain

Teori Atom Thomson
Atom menurut Thomson terdiri dari partikel bermuatan positif dan terdapat elektron – elektron yang tersebar secara merata (seperti roti kismis) sehingga atom bersifat netral

Kelebihan Teori Atom Thomson: membuktikan adanya partikel lain yang
bermuatan negatif dalam atom. berarti atom bukan bagian terkecil dari suatu unsur.
Kelemahan Teori Atom Thomson: Model Thomson ini tidak dapat
menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.

Teori Atom Rutherford
Rutherford menggambarkan atom seperti tata surya dimana atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, sikelilingi oleh elektron yang bermuatan negatif

Kelebihan Atom Rutherford: membuat hipotesa bahwa atom tersusun dari
inti atom dan elektron yang mengelilingi inti.
Kelemahan Atom Rutherford: tidak dapat menjelaskan mengapa elektron
tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron mengitari inti ini disertai pemancaran energi sehingga lama – kelamaan energi elektron akan berkurang dan lintasannya makin lama akan mendekati inti dan jatuh ke dalam inti

Teori Atom Bohr
Bohr menyatakan bahwa elektron – elektron mengelilingi inti atom pada lintasan – lintasan tertentu yang disebut kulit elektron

Kelebihan Teori Atom Bohr:•Bahwa atom terdiri dari beberapa kulit
untuk tempat berpindahnya elektron
Kekurangan Teori Atom Bohr:•Tidak dapat menjelaskan spekrum warna
dari atom berelektron banyak. Sehingga diperlukan model atom yang lebih sempurna dari model atom Bohr.

Teori Mekanika Kuantum
Model atom mekanika kuantum mirip dengan model atom Bohr, tetapi kedudukan elektron berada di daerah sekitar inti, yaitu awan elektron yang disebut orbital. Letak elektron tidak dapat ditentukan dengan pasti.

Perkembangan Tabel Periodik Unsur
Triade Dobereiner
Teori Oktaf Newlands
Sistem Periodik Mendeleev
Sistem Periodik Modern

Triade Dobereiner
Bila unsur-unsur dikelompokan berdasarkan kesamaan sifat dan diurutkan massa atomnya, maka di setiap kelompok terdapat tiga unsur dimana massa unsur yang di tengah merupakan rata-rata dari massa unsur yang di tepi

Tabel Unsur Triade Dobereiner
Massa atom Li=3 dan K=19 maka massa atom

Teori Oktaf Newlands
Jika unsur-unsur disusun berdasarkan kenaikan massa atom, maka sifat unsur tersebut akan berulang setelah unsur kedelapan

Tabel Unsur Oktaf Newlands
Sifat Li mirip dengan sifat Na, K, Cu, Rb, Ag, dan Cs.Sifat Be mirip dengan sifat Mg, Ca, Zn, Sr, Cd, dan Hg

Sistem Periodik Mendeleev
Disusun berdasarkan kenaikan massa atom dan kemiripan sifat. Dari susunan tersebut didapatkan hukum periodik, dimana sifat unsur merupakan fungsi periodik dari massa atom.
Artinya, bila unsur-unsur disusun berdasarkan kenaikan massa atomnya, maka sifat unsur akan berulang secara periodik

Tabel Unsur Sistem Periodik Mendeleev

Kelemahan Sistem Periodik Mendeleev
•Panjang periode tidak sama
•Beberapa unsur tersusun dengan urutan massa atom yang terbalik, tidak naik tetapi turun
•Unsur golongan Lantanida yang jumlahnya 14 ditempatkan dalam satu golongan (satu kotak berisi lebih dari satu unsur)

Sistem Periodik Modern Keperiodikan sifat tidak didasarkan pada
massa atom, tetapi didasarkan pada nomor atom atau muatan inti.
Bila unsur-unsur disusun berdasarkan kenaikan nomor atom maka sifat unsur akan berulang secara periodik.
Disebut juga sebagai sistem periodik bentuk panjang, dimana terdapat lajur mendatar disebut periode, dan lajur tegak diebut golongan.

Tabel Sistem Periodik Modern

Golongan A (Golongan Utama)IA : Alkali VA : Nitrogen-FosforIIA : Alkali Tanah VIA : Oksigen-
BelerangIIIA : Boron-Aluminium VIIA : HalogenIVA : Karbon VIIIA : Gas Mulia
Golongan B (Golongan Transisi)IIIB : Transisi VII B: TransisiIV B : Transisi VIII B: TransisiV B : Transisi I B : TransisiVI B : Transisi II B : Transisi