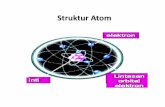
Model Atom Bohr dan Bilangan Kuantum
-
Upload
smpn-3-taman-sidoarjo -
Category
Education
-
view
3.447 -
download
6
Transcript of Model Atom Bohr dan Bilangan Kuantum
MODEL ATOM BOHR
Keunggulan dapat menjelaskan:
kestabilan atom
spektrum garis pada atom hidrogen
Kekurangan Tidak dapat menjelaskan :
Efek Zeeman
Spektrum garis yang dipancarkan oleh atom berelektron banyak
Beberapa garis spektrum memiliki intensitas lebih besar dari garis spektrum yang lain
Efek zeeman adalah gejala
tambahan garis-garis
spektrum jika atom-atom
tereksitasi diletakan dalam
medan magnet
BILANGAN KUANTUM
Dalam teori kuantum, keadaan stasioner tidak dinyatakan dalam satu bilangan bulat n, melainkan dinyatakan dengan sekumpulan bilangan kuantum. Ada empat bilangan kuantum:
bilangan kuantum utama (n)
bilangan kuantum orbital ( )
bilangan kuantum magnetik (m )
bilangan kuantum spin (ms)
l
l
l
BILANGAN KUANTUM UTAMA
(N) digunakan untuk menentukan tingkatan-tingkatan energi
elektron pada setiap kulit
energi total dalam atom kekal dan terkuantisasi oleh n
nilai bilangan kuantum utama mulai dari 1 sampai tak hingga
orbit tempat elektron bergerak disebut kulit
BILANGAN KUANTUM ORBITAL
Bilangan kuantum orbital teramati karena efek Zeeman ( garis-garis tambahan dalam spektrum emisi jika atom-atom tereksitasi diletakan dalam medan magnet luar homogen)
Sommerfeld mengusulkan orbit elips karena gerakan elektron mengelilingi atom dipengaruhi gaya
Bilangan kuantum orbital ( ) adalah bilangan kuantum yang menentukan besar momentum sudut elektron (L) dan kepipihan elips
Nilai bilangan kuantum orbital dibatasi oleh n yaitu (n-1)
bilangan kuantum orbital menyatakan subkulit
l
l
NAMA-NAMA SUB KULIT
Bilangan kuantum
orbital
Subkulit
0
1
2
3
s (sharp = tajam)
p (principal = utama)
d (diffuse = kabur)
f (fundamental = pokok)
Bilangan kuantum menentukan besar jari-jari orbit elektron semakin besar n maka semakin besar jari-jarinya.
Bilangan kuantum orbital menentukan kepipihan orbit elektron, semakin kecil bilangan kuantum orbital semakin pipih elips.
KEGUNAAN BILANGAN KUANTUM
ENERGI KINETIK ELEKTRON TERDIRI DARI DUA BAGIAN YAITU EK RADIAL
YANG DITIMBULKAN OEH GERAK MENDEKATI ATAU MENJAUHI INTI DAN EK
ORBITAL YANG DITIMBULKAN OLEH GERAK MENGELILINGI INTI.
2
2
2
)1(
mr
llE
orbitalK
orbitalorbitalKvmE
2
2
1
rvmL orbital
2
2
2 rm
LE
orbitalK
2
2
2
2
2
)1(
2 mr
ll
mr
L
)1(llL
BILANGAN KUANTUM MAGNETIK
Menunjukan arah dari momentum sudut orbital
12lml
llml
,........0,......
Arah momentum sudut dikuantisasi dengan acuan
ke medan magnet luar
lZ
mL
BILANGAN KUANTUM SPIN
Menunjukan arah perputaran elektron pada sumbunya
Ada 2 nilai
2
1s
m
1(ss
mmSBesar momentum sudut spin
MENENTUKAN KEPIPIHAN ORBIT
ELEKTRON
l
l berkurang identik dengan L berkurang orbit menjadi
lebih pipih dan memanjang
Semakin besar n semakin besar jari-jarinya
Semakin kecil l semakin pipih ellips
Semakin kecil ml semakin miring ellips